4 种生防菌对烟草黑胫病的防治效果及对根际土壤微生物群落结构的影响
2022-12-20王亚月贾方方马文辉阎海涛许跃奇王晓强
王亚月,贾方方,常 栋,马文辉,阎海涛,许跃奇,王晓强
1. 商丘师范学院生物与食品学院,河南省商丘市睢阳区文化路298 号 476000
2. 河南省烟草公司平顶山市公司,河南省平顶山市建设路263 号 467000
烟草黑胫病是威胁烟叶产量与品质的严重土传性病害之一,病原菌为烟草疫霉菌(Phytophthora parasiticavar. nicotianae),该病害极易在高温和高湿环境下爆发[1]。近年来,随着我国植烟区域的变化和烟田连作面积的进一步扩大,以及多数种植品种不抗(耐)黑胫病,致使部分产烟区烟草黑胫病频繁发生和流行,严重者发病率高达75%以上,造成烟叶减产甚至绝收,严重影响了我国烟草业的发展[1-2]。目前烟草生产上通常采用农业防治、化学防治与生物防治等措施来防治烟草黑胫病。农业防治中采取间作和套作方式或者使用抗病品种,但间套作其他种类的作物可能会影响烟叶品质[3-5]。化学防治中甲霜灵、氟吡菌胺、霜霉威盐酸盐、烯酰吗啉以及丁吡吗啉等化学药剂对烟草黑胫病均有一定防效,但长时间大面积使用这些化学药剂,易使病原菌产生抗药性而导致防效逐渐降低,同时也易造成环境污染及烟叶农药残留超标[6-9]。而微生物防治具有无毒、无残留和环境友好等优点,符合烟草行业绿色发展的需要,在烟草病害防治中备受关注[1,10-13]。因此,针对土壤品质下降及土传病害日益严重的问题,开发新型微生物菌剂成为烟草生产上的重要任务之一。
烟草黑胫病的发生与根际土壤微生物间关系密切,土壤中有益菌群数量的减少以及有害菌群数量的增加都会提高病害发生率。张维等[14]通过盆栽试验发现,施用复配拮抗菌FP246 后与有益细菌相关的OTU比对照组显著增加,提高了烟草根际土壤有益微生物的种类和数量。变形菌门和酸杆菌门是健康和受感染烟草植物根际土壤中的两个主要门类,生防菌解淀粉芽胞杆菌ZM9 的施用可以提高促进植物生长的根际细菌的相对丰度,尤其是显著提高变形杆菌的相对丰度,降低病原菌丰度[15];田间施用解淀粉芽胞杆菌菌株Y4 与假单胞菌菌株Y8 生防菌,可改变根际土壤微生物群落,提高有益细菌的相对丰度,降低有害细菌的相对丰度,改善烟草抗病性,如Y4处理后乳酸杆菌和双歧杆菌富集,Y8处理后乳酸杆菌富集[16]。目前,有关烟草黑胫病的研究主要集中在生防菌的分离鉴定以及生防菌的定殖,而通过大田试验同时研究生防菌对烟草黑胫病的防控效果及对烟草根际土壤微生物多样性的影响则报道较少。为此,以烟草黑胫病的微生物防治为目标,通过盆栽与大田试验测定亚麻假单胞菌、沙福芽胞杆菌、暹罗芽胞杆菌与哈茨木霉菌对黑胫病的防效;同时,通过大田试验研究了不同生防菌的施用对烟草根际土壤微生物群落丰度、组成和结构的影响,旨在筛选有效的生防菌,为烟草黑胫病的生物防治提供依据。
1 材料与方法
1.1 材料、试剂与仪器
材料:供试品种为中烟100,由河南省烟草公司平顶山市公司提供;微生物菌亚麻假单胞菌菌剂(Pseudomonas lini,KY)、沙福芽胞杆菌(Bacillus safensis,L9)、暹罗芽胞杆 菌(Bacillus siamensis,Q29)、哈茨木霉(Hypocrea lixii,M01)等由本实验室发酵获得;甲霜·锰锌可湿性粉剂(有效成分58%,甲霜灵含量10%,代森锰锌含量48%,江苏宝灵化工股份有限公司)。
试剂:PCR Kit(北京全式金生物技术有限公司);E.Z.N.A.®soil DNA Kit(美国Omega Bio-tek公司);AxyPrep DNA Gel Extraction Kit(美国Axygen Biosciences 公 司);NEXTFLEX®Rapid DNA-Seq Kit(美国Bioo scientific 公司);琼脂糖(大连宝生物工程有限公司)。
仪器:NanoDrop2000(美国Thermo Scientific 公司);Quantus™Fluorometer(美国Promega 公司);PCR 仪(美国ABI 公司);摇床(美国Thermo Scientific公司);pH计(瑞士Mettler Toledo公司)。
1.2 方法
1.2.1 盆栽与大田防效测定
按照常栋等[17]的方法测定拮抗菌KY、L9、M01和Q29 盆栽防效。试验设置6 个处理:①对照CK0,仅接病原菌进行处理;②化学药剂对照CK1,以稀释2 000倍的甲霜·锰锌进行灌根,每株10 mL,浇灌时间和次数同生防菌处理。拮抗菌处理③~⑥,为KY、L9、M01和Q29菌剂,烟苗还苗后灌根法接种拮抗菌浓度为1.0×108cfu/mL 的发酵液,接种量为10 mL/盆,培养烟株7 d 后划伤烟株茎基部,灌根法接种10 mL 烟草黑胫病病原菌(孢子浓度约1.0×108cfu/mL),此后继续接种拮抗菌液2次,每次间隔7 d,每个处理为9 盆,3 次重复,于接种完毕14 d 开始调查烟株发病情况。
大田试验于2020 年在河南省平顶山市白龙庙村烟草种植基地进行,此基地为黑胫病高发田地,烟苗移栽后接种稀释20倍的拮抗菌发酵液,每株菌剂灌根量为200 mL,确保接种孢子总量与盆栽试验一致,鉴于大田烟株生育期长于盆栽烟株,调整大田接种周期为15 d,灌根3 次。每处理63 株烟苗,重复3次。以自然条件下未进行处理的烟株为对照,按照标准方法(GB/T23222—2008)[18]调查发病情况,并计算烟株发病率、病情指数以及生防菌相对防效。
计算公式:

1.2.2 土壤样品采集与测定
运用棋盘采样法在试验大田中选择取样点,抖土法采集烟苗移栽后30 d(伸根期)、50 d(旺长期)、70 d(成熟期)处理和对照根际土壤样品,于无菌袋中混匀,密封,低温保存。
1.2.3 DNA抽提和PCR扩增
采用E.Z.N.A.®soil DNA Kit抽提样品总DNA,1%琼脂糖凝胶电泳检测DNA 质量,NanoDrop 测定DNA 浓度和纯度,以此为模板,运用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA 基因V3~V4可变区进行PCR 扩增;使用SSU0817F(5'-TTAGCATGGAATAATRRAATAGGA-3')和1196R(5'-TCTGGACCTGGTGAGTTTCC-3')对18S rRNA基因V5~V7可变区进行PCR扩增。PCR反应体系20 μL,包括5×TransStart FastPfu 缓冲液4 μL,2.5 mmol·L-1dNTPs 2 μL,上游引物(5 μmol·L-1)0.8 μL,下游引物(5 μmol·L-1)0.8 μL,TransStart FastPfu DNA 聚合酶0.4 μL,模板DNA 10 ng,加灭菌蒸馏水补足至20 μL。每个样本重复3 次。扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,27 个循环后72 ℃延伸10 min,最后4 ℃保存。
1.3 Illumina Miseq测序
将同一样本PCR 产物混合,2%琼脂糖凝胶回收PCR 产物,利用AxyPrep DNA Gel Extraction Kit纯化回收产物,2%琼脂糖凝胶电泳检测,并用Quantus™Fluorometer 对回收产物进行检测定量。使用NEXTFLEX®Rapid DNA-Seq Kit建库:①接头链接;②使用磁珠筛选去除接头自连片段;③利用PCR 扩增进行文库模板的富集;④磁珠回收PCR 产物得到最终的文库。利用Illumina Miseq PE300 平台进行测序(上海美吉生物医药科技有限公司)。
1.4 数据处理
①使用Trimmomatic 软件对原始测序序列进行质控,使用FLASH 软件进行拼接:过滤reads 尾部质量值20以下的碱基,设置50 bp窗口,如果窗口内平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的reads,去除含N碱基reads;②根据PE reads之间的overlap关系,将成对reads拼接成1 条序列,最小overlap 长度为10 bp;③拼接序列overlap区允许的最大错配比率为0.2,筛选不符合序列;④根据序列首尾两端的barcode 和引物区分样品,并调整序列方向,barcode 允许的错配数为0,最大引物错配数为2。使用的UPARSE 软件(version 7.1,http://drive5.com/uparse/),根据97%相似度对序列进行OTU 聚类并剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva 数据库(SSU128),设置比对阈值为70%。
防效数据运用Microsoft Excel 2010 和SPSS软件进行分析,采用Duncan's 新复极差法进行显著性差异检验(P<0.05)。
2 结果与分析
2.1 生防菌株的盆栽和大田防效
盆栽试验结果如表1所示,与对照CK0相比,甲霜·锰锌(CK1)、亚麻假单胞菌(KY)、沙福芽胞杆菌(L9)、哈茨木霉(M01)与暹罗芽胞杆菌(Q29)菌液处理的烟株发病率和病情指数均降低,分别降低30%和45.4%、66.7%和95.0%、75%和96.2%、75%和88.9%、60%和90.9%;且经生防菌处理后的烟株发病率和病情指数均低于甲霜·锰锌,其中生防菌L9处理的烟株发病率与病情指数最低,分别为25%和2.8。生防菌株KY、L9、M01 和Q29 均表现出较高的防效,分别是甲霜·锰锌防效的2.1 倍、2.1 倍、2.0倍和2.0倍,其中L9菌液相对防效最高,达96.2%。
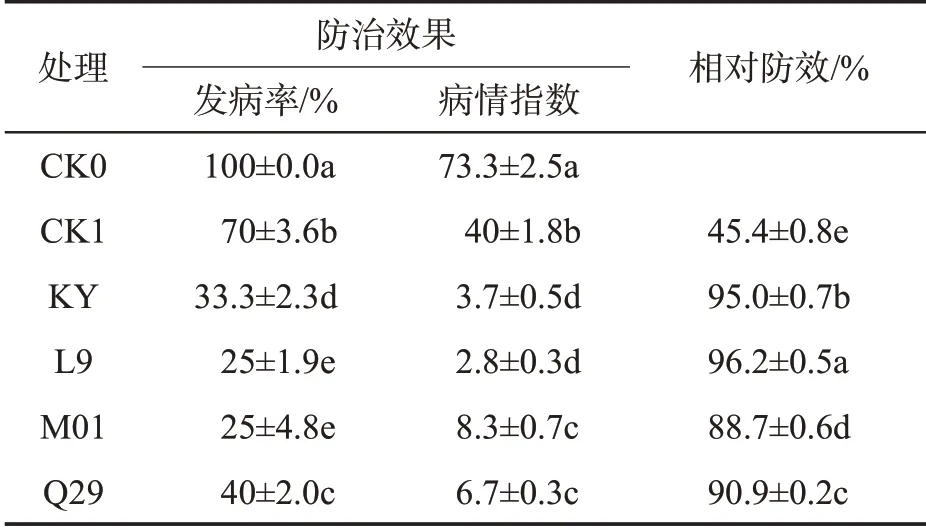
表1 不同处理的盆栽防效比较①Tab.1 Control efficiencies of different treatments in pot experiments
大田试验结果如表2所示,与对照CK0相比,甲霜·锰锌与菌液处理的烟株黑胫病的发病率和病情指数均较低。施用生防菌的烟株发病率和病情指数均低于甲霜·锰锌,其中亚麻假单胞菌处理后的烟株发病率和病情指数最低,分别为4.3%和2.1。同比施用甲霜·锰锌对烟株的防效,生防菌KY、L9、M01和Q29 相对防效分别提高4.8 倍、4.1 倍、2.0 倍和4.0倍。与盆栽试验结果一致,亚麻假单胞菌在大田中对烟草黑胫病也表现出较高防治效果,可应用于烟草黑胫病的生物防治。同比盆栽试验,生防菌L9、M01与Q29施用于大田后防效均降低。
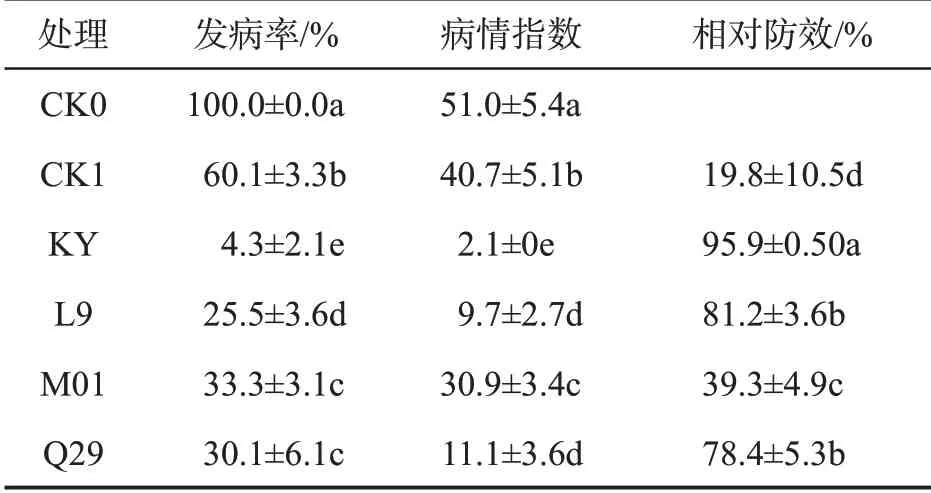
表2 不同处理大田防效比较Tab.2 Control efficiencies of different treatments in field experiments
2.2 生防菌对烟草根际土壤微生物组成的影响
2.2.1 微生物多样性分析
如表3 所示,各处理的Coverage 值均高于0.9,表明测序序列群落覆盖度高,具有代表性。与空白对照相比,施用化学药剂与生防菌后,Shannon 指数与ACE 指数均降低,表明烟株根际土壤细菌群落多样性与群落丰富度降低。进一步分析各处理分类水平群落数的变化(表4),发现化学药剂与生防菌处理后细菌群落数在各分类水平上均低于CK0 处理,推测化学药剂甲霜·锰锌与4 种生防菌的施用可能抑制了烟株根际土壤中部分有害细菌的生长,从而达到一定的防效。
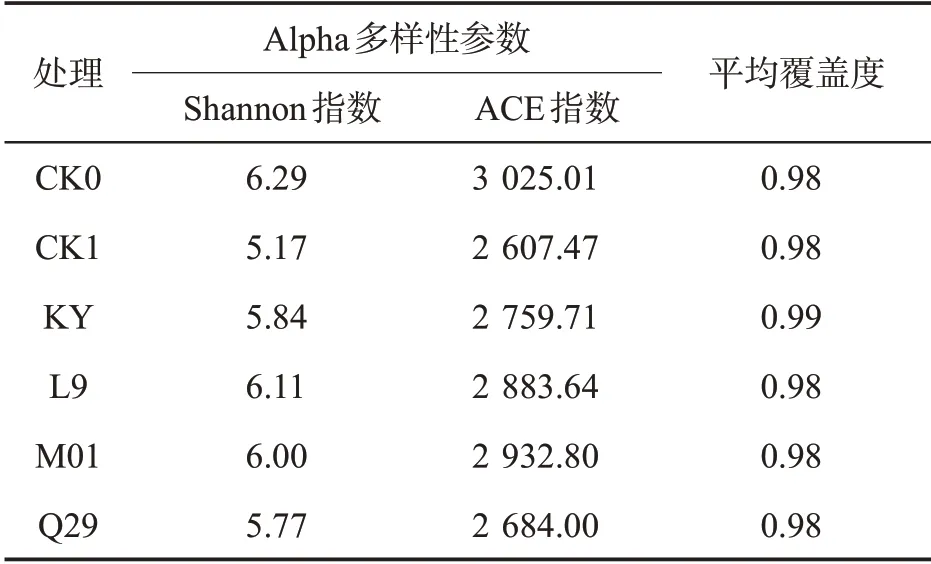
表3 不同处理根际土壤细菌Alpha多样性比较Tab.3 Alpha diversity of rhizosphere soil bacteria of different treatments
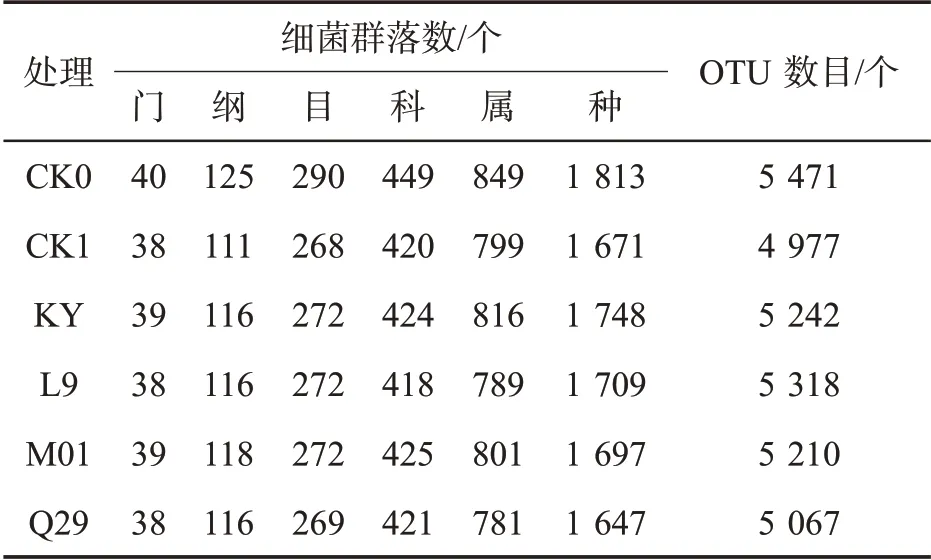
表4 不同处理烟株根际土壤细菌群落数及OTU数目比较Tab.4 Total amounts of bacterial communities and OTU number of rhizosphere soil bacteria of different treatments
如表5 所示,各处理的Coverage 值为1,测序序列群落覆盖程度高。与对照相比,施用化学药剂与生防菌后,Shannon 指数、ACE 指数均降低,表明烟株根际土壤真菌群落丰富度与群落多样性降低;进一步分析发现真菌在目、科、属及种分类水平上群落数均低于CK0 处理,其变化趋势与细菌类似。与细菌分类水平变化不同的是,施用甲霜·锰锌、KY、L9与M01 后真菌在门水平上分别增加了3 个、2 个、3个与1 个门;在纲水平上,甲霜·锰锌与L9 的施用分别增加2个与1个纲(表6)。
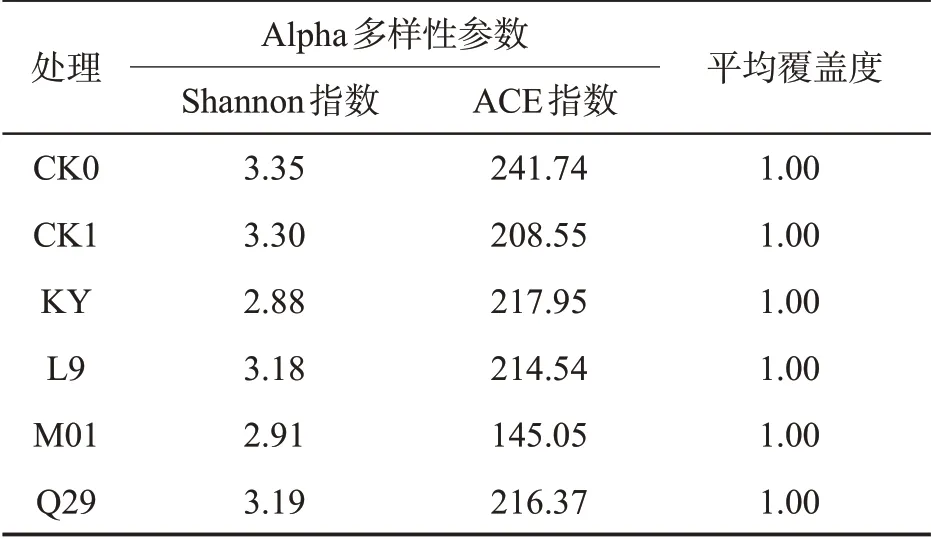
表5 不同处理根际土壤真菌Alpha多样性比较Tab.5 Alpha diversity of rhizosphere soil fungi of different treatments
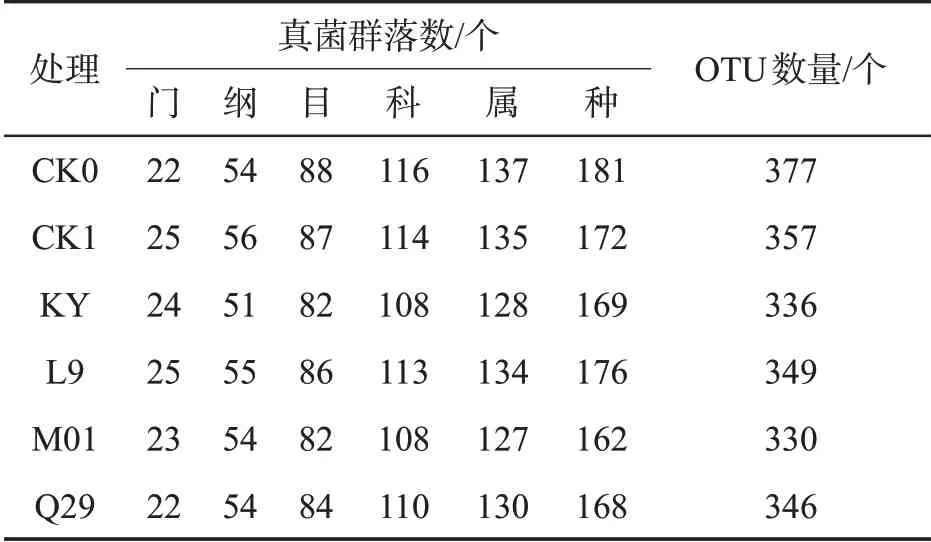
表6 不同处理烟株根际土壤真菌群落数及OTU数量比较Tab.6 Total amounts of bacterial communities and OTU number of rhizosphere soil fungi of different treatments
2.2.2 不同处理对土壤微生物丰度的影响
如图1 所示,与空白对照CK0 相比,施用甲霜·锰锌(CK1)、KY、L9、M01 和Q29 后,烟株根际土壤中细菌的核心物种(核心物种是所有样本共有的物种)数量均增加,而真菌的核心物种数量则降低,表明土壤中核心物种细菌菌群对烟株病害的防治有促进作用。无论是真菌还是细菌,伸根期、旺长期与成熟期的烟株根际土壤微生物核心物种数量依次表现出降低趋势。
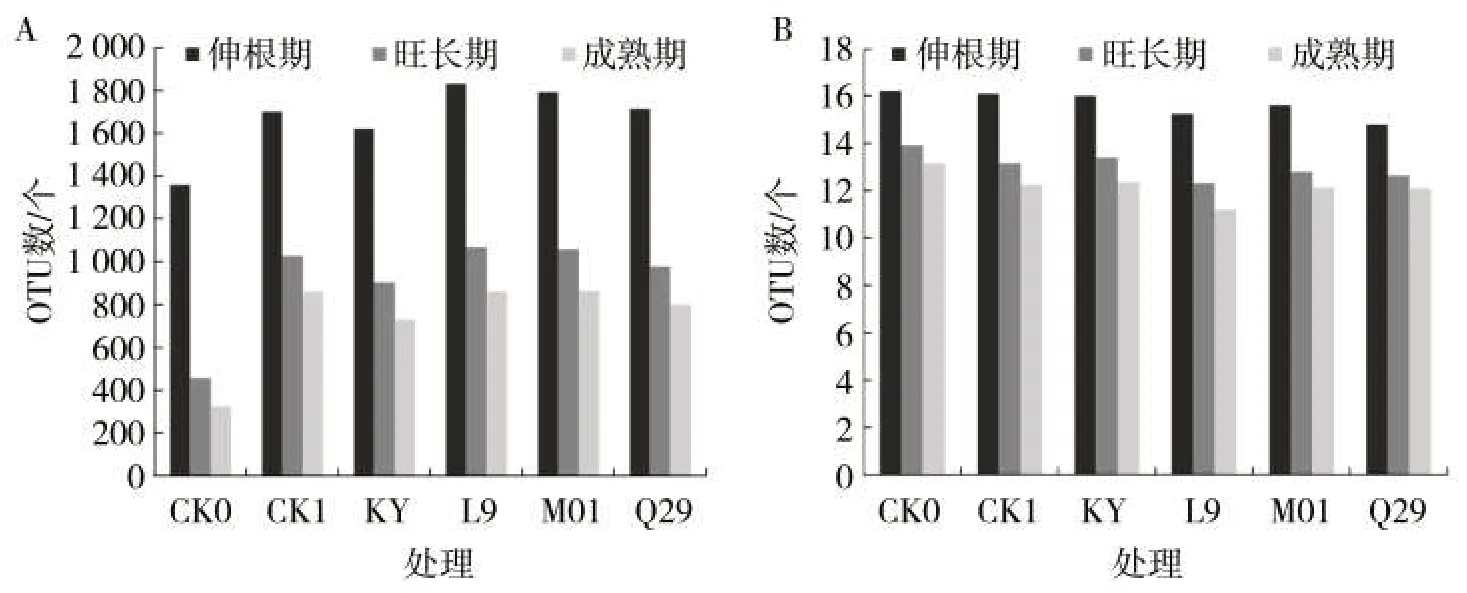
图1 不同处理烟株根际土壤中细菌(A)和真菌(B)核心物种数量变化Fig.1 Quantitative variations of main bacterial(A)and fungal(B)species in rhizosphere soil of different treatments
不同生防菌处理后,烟株根际土壤细菌优势菌群组成类似。在门水平上,优势菌群均为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、黏菌门(Myxococcota)及Patescibacteria 等优势菌组成(表7)。与CK0相比,化学药剂与生防菌处理后,变形菌门、放线菌门、厚壁菌门和Patescibacteria 4类菌群数量有所增加,酸杆菌门、绿弯菌门和芽单胞菌门菌群均有所减少。KY 处理后,优势菌群厚壁菌门所占百分比为11%,分别是CK0、CK1、L9、M01与Q29的1.9倍、1.6倍、1.1倍、1.7倍与1.1倍,且随着防效的降低呈现减少趋势。
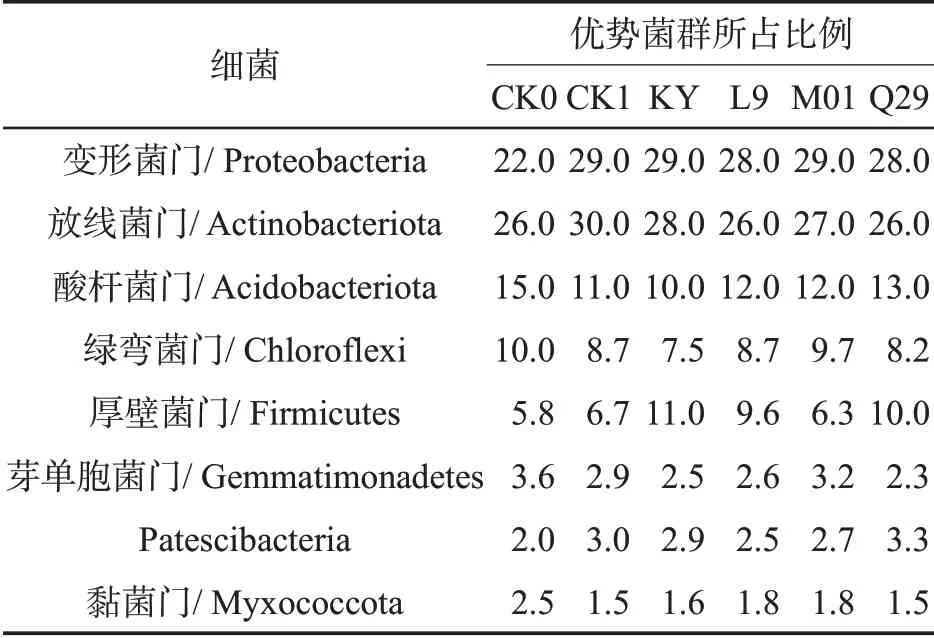
表7 不同处理烟株根际土壤细菌优势菌群所占比例比较Tab.7 Proportions of dominant bacteria in rhizosphere soil of different treatments (%)
在属水平上,微生物丰度变化与门水平上相呼应,则由放线菌门中的Gaiellales 与节细菌属(Arthrobacter)、厚壁菌门的芽胞杆菌属(Bacillus)以及变形菌门的鞘氨醇单胞菌属(Sphingomonas)等组成(图2),KY 的施用提高了烟株根际芽胞杆菌属菌群数量,从而使得其表现出较高防效。
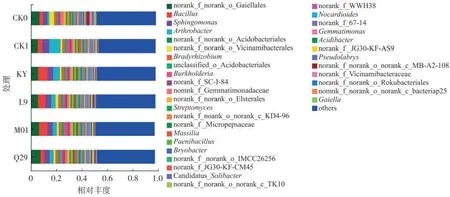
图2 不同处理对烟株根际土壤细菌属水平相对丰度的影响Fig.2 Effects of different treatments on relative abundances of bacteria in rhizosphere soil at genus level
经甲霜·锰锌和生防菌处理后的烟株,根际土壤真菌优势菌群组成类似。在门水平上,优势菌群依次均为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉门(Mucoromycota)。与对照CK0 相比,子囊菌门与担子菌门群落所占百分比变化不大,毛霉门群落数量升高(表8)。
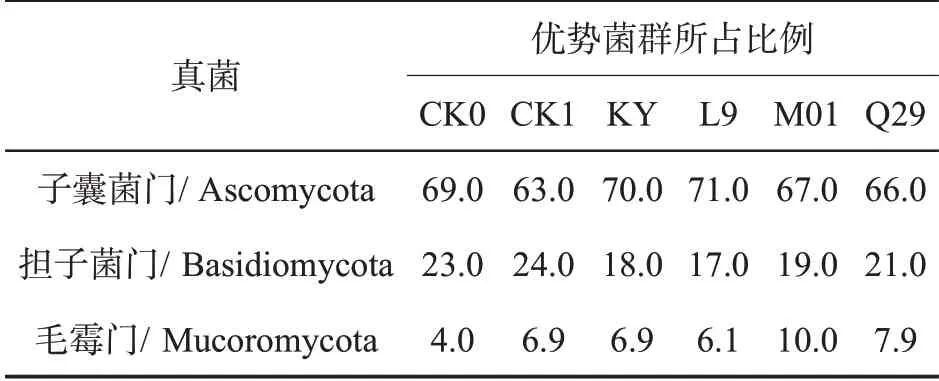
表8 不同处理烟株根际土壤真菌优势菌群所占比例比较Tab.8 Proportions of dominant fungi in rhizosphere soil of different treatments (%)
甲霜·锰锌和生防菌虽然对烟草黑胫病都表现出防治效果,然而对烟株根际土壤优势群落丰度却表现出不同影响。甲霜·锰锌的施用增加了担子菌门群落丰度,而生防菌的施用却降低了该类群丰度。在属水平上均由毛壳菌属(Chaetomium)、子囊菌纲(Sordariomycetes)未分类属、木霉属(Trichoderma)、散囊菌属(Eurotium)、norank_p_Mucoromycota、Solicoccozyma、Heterocephalacria、缨霉属(Thysanophora)等优势菌群组成(图3);经KY处理后,烟株根际土壤散囊菌属丰度明显多于其他处理。
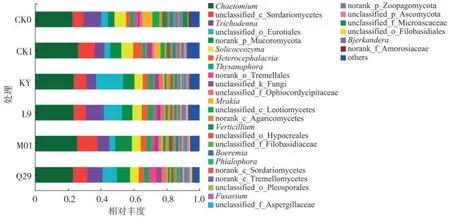
图3 不同处理对烟株根际土壤真菌属水平相对丰度的影响Fig.3 Effects of different treatments on relative abundances of fungi in rhizosphere soil at genus level
3 讨论
微生物菌剂可以提高土壤酶活性、改变土壤微生物菌群、改良土壤养分环境,从而调控土壤微生物群落,改变其功能多样性,进而抑制作物病虫害[19-22]。目前已发现多种微生物可以抑制烟草黑胫病病原菌的生长,如细菌类包括解淀粉芽胞杆菌(Bacillus amyloliquefaciens)、绿针假单胞 菌(Pseudomonas chlororaphis)、多黏类芽胞杆 菌(Paenibacillus polymyxa)、枯草芽胞杆菌(Bacillus subtilis)、伯克氏菌(Burkholderia cepacia)、芽胞杆菌(Bacillus sp.)、铜绿假单胞菌(Pseudomonas aeruginosa)、烟草节杆菌(Arthrobacter nicotianae) 、荧光假单胞菌(Pseudomonas fluorescens)[1,11,13,23-26];真菌类如哈茨木霉(Trichoderma harzianum)[27];放线菌如链霉菌(Streptomyces)[28]。这些生防菌分布于芽胞杆菌属、假单胞菌属、伯克氏菌属、节细菌属、木霉属和链霉菌属中,在本试验中也发现芽胞杆菌属、伯克氏菌属、节细菌属、木霉属为优势菌群,这些菌群与烟草生长有密切关系[5,29-30]。本试验中亚麻假单胞菌在盆栽和大田试验中均表现出较高防效,假单胞菌属中的许多菌株如铜绿假单胞菌、荧光假单胞菌、绿针假单胞菌、恶臭假单胞菌等对烟草病害均具有防治作用。这些菌株可通过产生抑菌次生代谢产物如吩嗪-1-羧酸、藤黄绿脓菌素、环状脂多肽或者铁载体等活性物质破坏病原菌细胞壁、改变细胞膜通透性或者影响病原菌蛋白质合成而达到抑菌作用,或者通过诱导植物系统抗性及促进植物生长等机制发挥防治功能[31-32]。亚麻假单胞菌施用后提高了烟株根际土壤芽胞杆菌属与散囊菌属菌群数量,芽胞杆菌属中的许多菌株已被报道应用于植物病害的防治,如枯草芽胞杆菌、苏云金芽胞杆菌、地衣芽胞杆菌、侧胞芽胞杆菌、蜡样芽胞杆菌、多黏类芽胞杆菌和短小芽胞杆菌等,这些菌可以产生抑菌活性物质、诱导植物抗性或者促进植物生长[33-34];散囊菌也可产生抑菌活性物质[35-36]。推测亚麻假单胞菌的生物防治作用与这些有益微生物数量增加有关,然而该菌株是通过产生活性次生代谢产物或者诱导植物系统抗性或者促进植物生长等机理而实现防控效果仍需进一步研究。
烟草黑胫病的发生与根际土壤微生物群体的作用密切相关。土壤从“细菌型”到“真菌型”的转变会加重作物病害的发生;生防菌的施用可以使土壤从“真菌型”到“细菌型”转变,改善土壤微生态环境[19]。在本研究中,甲霜·锰锌、亚麻假单胞菌、沙福芽胞杆菌、暹罗芽胞杆菌与哈茨木霉菌的施用虽然降低了烟株根际土壤微生物多样性,然而却增加了细菌核心物种数量,降低了真菌核心物种数量,即意味着土壤核心物种是向细菌化状态转变,为烟株提供良好生长环境,提高其抗病能力。
4 结论
通过盆栽和大田试验比较4 株生防菌对烟草黑胫病的防治效果,获得具有较高防效的亚麻假单胞菌、沙福芽胞杆菌和暹罗芽胞杆菌,相对防效均高于75%。高通量测序分析表明药剂与生防菌的施用并不影响细菌和真菌优势菌群群落结构,但改变了烟株根际土壤菌群丰度,微生物多样性降低,细菌和真菌核心物种数量分别呈现上升和下降的趋势。
