生防菌XM—10对黄瓜枯萎病菌的拮抗机理
2015-10-20张雪辉唐蕊孟春燕马锡
张雪辉 唐蕊 孟春燕 马锡

摘要:采用对峙培养法、菌落直径法,测定了生防菌XM-10菌体及其发酵液各组分对黄瓜枯萎病菌的抑制作用。结果表明,生防菌XM-10对黄瓜枯萎病菌抑制作用较强,抑菌率为83.7%,抑菌带达6.9mm;其主要的抑菌物质存在于生防菌的胞内,且抑菌活性与其菌体数量呈正相关;通过显微观察,发现其对黄瓜枯萎病菌的菌丝和孢子均有强烈的抑制作用。
关键词:黄瓜枯萎病菌;抑菌机理;生防菌
中图分类号:S436.421.1+3 文献标志码:A 文章编号:1002-1302(2015)05-0127-02
黄瓜枯萎病是由半知菌亚门的尖孢镰刀菌黄瓜专化型(Fusariumoxysporum f.sp.cucumberium)引起的,是影响黄瓜生长的主要病害之一,在我国普遍发生,危害很大。目前防治此类病害主要采用喷施化学农药的方法,但采用化学农药防治易造成环境污染、人畜中毒、农药残留等问题。轮作、嫁接等方式也不能从根本上解决这一问题。随着人们对蔬菜数量和质量要求的不断提高和对保护人类生存环境的日益重视,以及可持续农业观念的不断深入,“以菌治菌”的方法以安全、无残留、无污染等优点,成为防治农业病害的最佳选择。本研究利用从土壤中筛选出的对黄瓜枯萎致病菌有较好拮抗作用的生防菌XM-10,进行了对黄瓜枯萎病菌生长的抑制活性及其抑菌机理的初步研究,为开发环境友好型微生物农药奠定基础。
1.材料与方法
1.1材料
菌株:生防菌XM-lO、黄瓜枯萎病菌均由邢台学院微生物实验室提供。
培养基:高氏一号培养基、PDA培养基和高氏一号液体培养基。
1.2方法
1.2.1生防菌XM-10对黄瓜枯萎病菌抑菌活性测试采用对峙培养法,将生防菌XM-10与黄瓜枯萎病菌同步活化,以黄瓜枯萎病菌为靶标菌,用打孔器取直径为1.0cm的菌盘,置于PDA平皿的中央,取平皿靠近边缘一侧某点用接种针接人生防菌XM-10菌株,3次重复,在25qC培养箱中培养。4d后,用“十”字交叉法测量记录菌落直径,测量抑菌带.
1.2.2生防菌XM-10抑菌机理探究
1.2.21菌体培养时间的确定
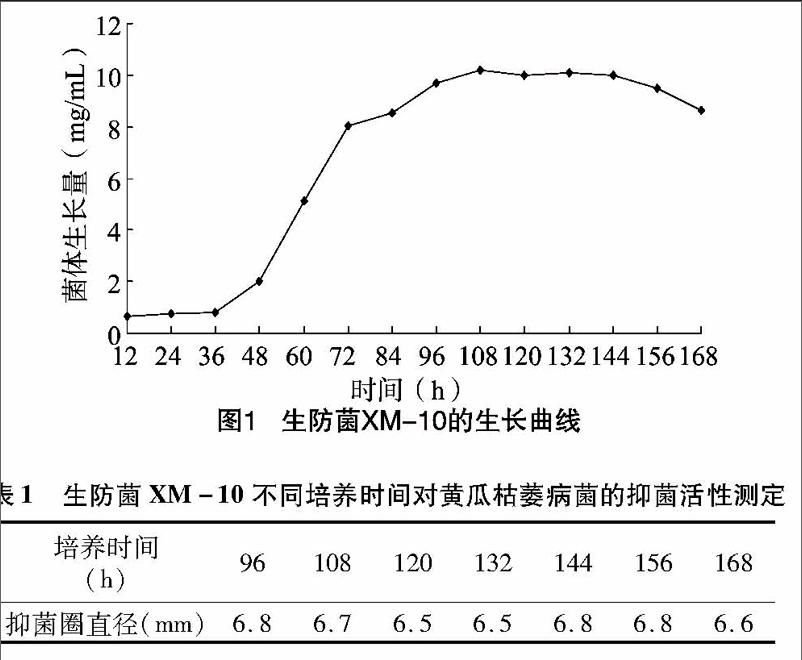
用接种针挑取活化好的XM-10菌体,接于高氏一号液体培养基中,在其他条件均适宜的情况下培养,每隔12h取3瓶,观察菌体生长情况,过滤得到菌体,测得菌体干质量,用于质量法测定菌体生长量,取平均值。以时间为横坐标、菌体生长量为纵坐标,绘制生防菌XM-10的生长曲线,确定最佳培养时间。
1.2.2.2抑菌机理探究取生防菌XM-10的培养液,利用细菌过滤器和定性滤纸分别过滤得无菌滤液和粗滤液(含少量放线菌)。将无菌滤液和粗滤液加入融化好的PDA培养基中,每20mLPDA加入1mL菌液,混匀后倒平板。在平板中央接入直径为1.0cm的黄瓜枯萎菌盘,利用无菌水为对照组,3个重复,25℃条件下培养96h,观察、测定菌落直径,计算抑菌率。
抑菌率=[1-(处理生长直径-菌饼直径)/(对照生长直径一菌饼直径)]×100%。
胞内产物抑菌活性测定:取XM-lO的培养液,在3500r/min条件下离心5min,去上清,保留菌体。分别取0.10、0.20、O.30、0.40、O.50、0.60g菌体,用研钵研磨5~10min,加入10mL无菌水稀释,再加10m∥mL的溶菌酶溶液10μ,37℃水浴1h,过滤得滤液。在融化好的PDA培养基中加入各浓度的滤液,20mLPDA加入1mL滤液,混匀后倒平板。方法同上,测定抑菌活性。
1.2.2.3黄瓜枯萎病菌菌体形态变化观察
取PDA平板,在平板的两侧分别接入黄瓜枯萎病菌菌盘及少量XM-10菌体。在其连线上插入灭好菌的盖玻片,并在黄瓜枯萎病菌菌盘一侧插入另一灭菌的盖玻片为对照组。在25qC条件下培养。一段时间后,取出盖玻片,显微观察,比较正常生长的黄瓜枯萎病菌菌体与受抑制后的黄瓜枯萎病菌菌体形态特征上的变化。2结果与分析
2.1生防菌XM-10对黄瓜枯萎病菌的抑菌活性测试
抑菌活性结果显示,菌株XM-10对黄瓜枯萎病菌有很好的拮抗作用。靠近生防菌一侧的黄瓜枯萎病菌菌丝生长受到抑制,形成明显的抑菌带,抑菌带为6.9mm。经计算,生防菌XM-10对黄瓜枯萎病菌的抑菌率达83.7%。
2.2抑菌机理探究
2.2.1最适培养时间的确定生防菌XM一10的生长曲线如图1所示。结果表明,0~36h期间菌体处于生长的迟缓期,在36~96h时间段内菌体快速生长,处于对数生长期;96~144h逐渐处于稳定期并保持稳定;144h之后菌体干质量略有下降,开始进入衰亡期。考虑到菌体生长量刚刚达到最大时,抑菌物质积累不一定最大,因此选取不同培养时间的生防菌分别进行抑菌活性测试,测量其与黄瓜枯萎病菌间产生的抑菌带的大小。由表1可见,不同培养时间间抑菌活性差别不大,故培养时间确定为96h。
2.2.2抑菌机理探究通过添加无菌水、无菌滤液和粗滤液(含少量放线菌)的抑菌活性测试对比试验(图2),得知无菌滤液对黄瓜枯萎病菌抑制作用不明显,而添加粗滤液的平板中长出生防菌XM-10菌体,其抑制率高达80.2%,故可得知在菌体存在的情况下抑制效果更好,即抑菌活性物质源于胞内而非胞外。胞内物质抑菌效果测定结果(图3)表明,该生防菌的抑菌活性与菌体数量呈正相关,即胞内抑菌物质的量与其菌体牛长量是同步增加的.
2.2.3处理前后黄瓜枯萎病菌菌体形态变化观察待菌丝生长到盖玻片后,取出盖玻片,将抑菌带周围的黄瓜枯萎病菌菌丝体与正常部位的菌丝体在显微镜下进行对比观察。结果(图4)显示,正常部位菌丝生长茂盛,菌丝粗壮,细胞壁较厚(图4-A),孢子数量多(图4-C);受抑制部位的菌丝生长稀疏,菌丝纤细、畸形扭曲,菌丝体分枝减少,细胞破损甚至死亡(图4-B),产孢量明显减少(图4-D)。表明生防菌XM-10对黄瓜枯萎病菌的菌丝和孢子均有强烈的抑制作用,尤其是对孢子的抑制作用很明显。
3.结论与讨论
本试验以黄瓜枯萎病菌为靶标菌,测定生防菌XM-10对其抑菌活性,并对生防菌XM一10的抑菌机理进行了初步研究。结果表明,XM一10菌株对黄瓜枯萎病菌有很好的拮抗抗作用,抑菌率达到83.7%,抑菌带为6.9mm。在抑菌机理探究的试验过程中利用黄瓜枯萎致病菌与高氏一号液体培养基培养得到的生防菌XM-10的无菌滤液和粗滤液分别对峙培养,显示粗滤液对黄瓜枯萎病菌的拮抗作用更加明显,而不含XM一10菌体的滤液对黄瓜枯萎病菌表现很弱的拮抗作用。这种差异的产生在于其主要的抑菌物质存在于生防菌的胞内而非胞外。通过胞内物质抑菌效果测定可以得出,该生防菌的抑菌活性与菌体数量呈正相关,即胞内抑菌物质的量与其菌体生长量是同步增加的。通过生防菌xM-10作用黄瓜枯萎病菌菌体后的形态变化观察,结果显示其对黄瓜枯萎病菌的菌丝和孢子均有较强的抑制作用。
放线菌作为天然抗生素等生物活性物质的主要生产者,是生防菌的重要来源,是广泛实用的生物资源。黄瓜枯萎病是生产中危害较严重的土传性病害,防治困难。生防菌作为一种资源丰富的微生物类群,大力开展对黄瓜枯萎病的生物防治,合理利用其产生的抗菌物质控制病害的发生,是我国农业可持续发展的需要。目前,我国在生物防治方面虽然取得了一定的成绩,但仍面临着许多的技术难题,如何保持生防菌防治效果,将其大范围地应用到生产实践,使其与周围环境相适应,是目前及未来一段时间内需要解决的问题。
