基于MALDI-TOF MS技术快速检测产呕吐毒素蜡样芽胞杆菌
2022-12-14陈楷黄志深曾羲雷燕林秀敏蒋佳希陈贤驰肖剑
陈楷,黄志深,曾羲,雷燕,林秀敏,蒋佳希,陈贤驰,肖剑
(广州市食品检验所,广东广州 511400)
蜡样芽胞杆菌作为食品中重要防控的致病菌之一,也是食源性疾病中常见的条件致病菌。研究发现,蜡样芽胞杆菌在即食肉制品、乳制品及各种生鲜食品中均有一定的检出率,其中最为典型的是米面制品,作为主要污染源的湿粉类食品,蜡样芽胞杆菌检出率达到43.17%[1]。据统计,环境中的蜡样芽胞杆菌仅有1%~2%的菌株会产生呕吐毒素[2],但在食品和临床样品中产呕吐毒素菌株的流行率却高达32.8%[3]。
蜡样芽胞杆菌呕吐毒素(Cereulide,以下简称呕吐毒素)的结构为[D-O-Leu-D-Ala-D-O-Val-D-Val]3,如图1,是一种十二环形多肽,分子量为1,153.38 u[4,5],由位于巨质粒上的ces基因簇(Cereulide Synthetase Gene Cluster)编码的非核糖体肽合成酶(Networked Robot Perceptual System,NRPS)合成的,该毒素由携带ces基因的菌株在食物中预先产生且非常稳定,进入人体后在胃中与其受体结合,导致呕吐反应[6]。目前,国内蜡样芽胞杆菌的检测方法是GB 4789.14-2014《食品安全国家标准食品微生物学检验蜡样芽胞杆菌检验》[7],该方法只进行蜡样芽胞杆菌的鉴定,无法区分菌株是否产呕吐毒素,而区分该菌株的方法通常用聚合酶链反应(Polymerase Chain Reaction,PCR)检测[8],通过检测菌株是否携带ces基因进行辨别,但无法确定呕吐毒素是否产生,要测定呕吐毒素生成量还需通过液相色谱-质谱联用等仪器进行检测[9],前处理复杂、基质效应大。基质辅助激光解吸电离飞行时间质谱(Matrix Assisted Laser Desorption Ionization Time Of Flight Mass Spectrometry,MALDI-TOF MS)技术被广泛运用于微生物鉴定,该技术通过高度复杂的统计软件自动生成实验结果,具有快速便捷、操作相对简单、运行成本低等特点[10]。目前,Ulrich 等[11]通过MALDI-TOFMS 测量700~3 500 u 质量范围内的蛋白,确定了呕吐毒素的两个特定生物特征峰分别为m/z1 171 和m/z1,187,Doellinger 等[12]在MALDI-TOF MS 反射模式下测得呕吐毒素的钠和钾加合物信号峰为m/z1 175([M+Na]+)和m/z1 191([M+K]+),MALDI-TOF MS 在检测产呕吐毒素蜡样芽胞杆菌方面的潜力得到了检验。

图1 呕吐毒素的分子结构Fig.1 Molecular structure of cereulide
但由于呕吐毒素的合成不仅受细菌内部基因的调控,还受所在环境因素的影响,研究显示,蜡样芽胞杆菌合成呕吐毒素的最适温度为20~30 ℃[13]。此外,营养条件、pH 值、湿度和NaCl 等也会影响呕吐毒素的产生[14,15]。为此,本研究通过对呕吐毒素标准品进行分析,对特征峰进行定位并测定其灵敏度,评估国内常用于培养蜡样芽胞杆菌不同培养基和其他条件之间检测结果的差别,优化实验方案,并采用已确定含有ces基因型的蜡样芽胞杆菌菌株进行方法特异性验证,建立一种能简单、快速、高通量直接进行产呕吐毒素蜡样芽胞杆菌的鉴别方法,为食品中病原微生物靶标性监测和食品安全事件应急检验提供一种快捷鉴别技术。
1 材料与方法
1.1 材料
1.1.1 试验用菌株
蜡样芽胞杆菌标准菌株(CICC 10352)、蕈状芽胞杆菌标准菌株(CICC 21473),来自于中国工业微生物菌种保藏管理中心(CICC);苏云金芽胞杆菌标准菌株(ATCC 10792),来自于广东环凯微生物科技有限公司;49 株野生蜡样芽胞杆菌菌株[16](编号BC-1~49,其中BC-43、49 携带ces基因,实验室分离)。
1.1.2 主要试剂
呕吐毒素标准品,荷兰Chiralix 公司;甘露醇卵黄多黏菌素琼脂(Mannitol Yolk Polymyxin Agar Base,MYP)、胰酪胨大豆羊血琼脂平板(Trypticase Soy Sheep Blood Agar Plate,TSSB)、胰酪大豆胨琼脂(Tryptic Soytone Agar,TSA),广东环凯微生物科技有限公司;乙腈(色谱纯),德国Meker 公司;甲酸(色谱纯),美国Fisher Scientific 公司;三氟乙酸(色谱纯),美国Sigma-Aldrich 公司;α-氰基-4-羟基肉桂酸(α-Cyano-4-hydroxycinnamic acid,HCCA)、Bacterial Test Standard,德国Bruker 公司。
1.2 主要仪器设备
基质辅助激光解吸电离飞行时间质谱仪(Ultrafle Xtreme),德国Bruker 公司;生化培养箱,宾德环境试验设备(上海)有限公司;生物安全柜,赛默飞世尔(上海)有限公司;高压灭菌器,致微(厦门)仪器有限公司。
1.3 试验方法
1.3.1 呕吐毒素标准品的检测
将呕吐毒素标准品(2 mg)用纯乙腈溶解后定容至200 μg/mL 制成标准储备液,用φ=75%乙醇进行梯度稀释,分别制备10、5、1、0.1、0.01 μg/mL 的稀释液,从这些稀释液中分别吸取1 μL 至MTP 384 靶板上,在室温下风干,覆盖1 μL 基质HCCA,待基质干燥后进行MALDI-TOF MS 检测。
1.3.2 不同培养条件菌株的检测
依据GB 4789.14[7]中蜡样芽胞杆菌分离鉴定使用的培养基及培养温度,将携带ces基因的蜡样芽胞杆菌菌株分别接种到TSA、TSSB 和MYP 三种培养基平板,并将每种培养基平板分别放置于30 ℃和36 ℃条件下进行培养,分别培养12、18、24 和48 h 后用1 μL的一次性接种环直接从培养基中挑取典型菌落,均匀的涂抹到MTP 384 靶板上,用1 μL 体积分数70%甲酸覆盖菌苔,在室温下风干,再覆盖1 μL 基质HCCA,待基质干燥后上机进行MALDI-TOF MS 检测。
根据试验要求,试验指标为特征峰的响应值,不考虑交互作用,试验因素水平如表1,其中因素A 为四水平,而因素B、C 由于受试验条件的限制,分别只取二水平和三水平,为此把因素B 虚拟二个水平,因素C 虚拟一个水平,虚拟结果相当于把L16(43)表2作了改造,第2 列为1→1,2→2,3→1,4→2,第三列为1→1,2→2,3→3,4→1,通过正交试验对结果进行极差分析。

表1 因素水平表Table 1 Factor level table

表2 试验方案Table 2 Test scheme
1.3.3 方法特异性检验
将实验室现有的49 株蜡样芽胞杆菌野生菌株(其中2 株含ces基因)和标准菌株蜡样芽胞杆菌(CICC 10352)、蕈状芽胞杆菌(CICC21473)、苏云金芽胞杆菌(ATCC10792),使用1.3.2 的最优培养条件培养后,用1 μL 的一次性接种环直接从培养基中挑取典型菌落,均匀的涂抹到MTP 384 靶板上,用1 μLφ=70%甲酸覆盖菌苔,在室温下风干,再覆盖1 μL 基质HCCA,待基质干燥后上机进行MALDITOF MS 检测。
1.3.4 质谱条件
正离子反射模式;检测范围:700~3 500 u;激光强度:30%;激光点击数:每图谱200 次(8 次激光累积);激光频率;2 000.0 Hz;离子源加速电压:20 kV;采用速率:5.00 GS/s。
1.4 数据处理
1.4.1K值和k值的计算
以第一列A 因素为例:
K1=x3+x5+x8+x15
K2=x1+x7+x10+x14
K3=x4+x6+x11+x16
K4=x2+x9+x12+x13
ki=
式中:
Ki——各因素同一水平之和;
i——第i个水平;
ki——各因素同一水平的平均值;
n——该水平的总试验数。
1.4.2 极差R的计算
R=max(ki)-min(ki)
式中:
R——该因素在其取值范围内试验指标变化的幅度。
2 结果与讨论
2.1 呕吐毒素标准品的检测结果
分别吸取1 μL 质量浓度为10、5、1、0.1、0.01 μg/mL的呕吐毒素标准溶液进行MALDI-TOF MS 检测,试验结果如图2所示,每个浓度均可以检测到呕吐毒素相应m/z值为1 175 的[M+Na]+和1 191 的[M+K]+加合物特征峰,峰高响应值均大于104,检验结果与Doellinger等[12]在MALDI-TOF MS反射模式下测得的呕吐毒素钠和钾加合物信号峰位置和响应值结果一致,均检测到响应值大于104的m/z值为1 175 [M+Na]+和m/z值为1 191 [M+K]+。Ulrich 等[11]在线性正模式下测得呕吐毒素的两个特征峰为m/z1 171 和1 187,最高响应值均大于104,但因仪器和检测模式条件不同,故特征峰出峰位置存在一定差异。
本次检验结果中,在最低质量浓度0.01 μg/mL 的稀释液1 μL 中仍可以检测到相应的加合物特征峰,响应值大于104,说明该方法具有较高的检测灵敏度,达到0.01 μg/mL。Ulrich 等[11]使用MALDI-TOF/TOF MS(Bruker Daltonics Gmbh)在线性正模式(m/z800~1 800)下,对不同浓度的呕吐毒素标准溶液测量的检出限为1.0 μg/mL;Doellinger 等[12]使用MALDITOF/TOF MS 在正离子反射模式(m/z700~3 500)下,对不同浓度的呕吐毒素标准溶液测量精密度的为0.25 ng,均低于本次试验结果的灵敏度0.01 μg/mL。将各个质量浓度的呕吐毒素特征峰响应值与质量浓度做折线图,如图2所示,从趋势线上看,两个呕吐毒素特征峰m/z值为1 175 [M+Na]+和m/z值为1 191[M+K]+的响应值与标准溶液浓度梯度不成线性关系,这也反映了MALDI-TOF MS 在定量检测方面存在一定的局限性。
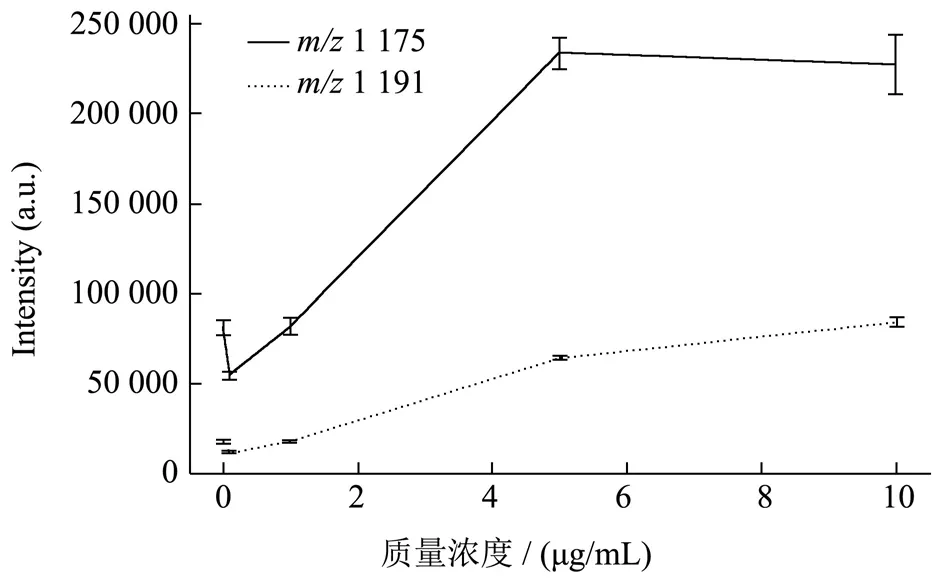
图2 呕吐毒素标准品的浓度曲线(n=2)Fig.2 Concentration curve of cereulide standard (n=2)
2.2 不同培养条件的检测结果
通过表2的试验方案进行16 次试验,检测分析结果如表3所示。其中,K为第j列因素m 水平所对应的试验指标和,k为K的平均值。由k的大小可以判断第j列因素优水平和优组合。故在m/z1 175 因素A(培养时间)的优水平:k4>k1>k3>k2,因素B(培养温度)的优水平:k1>k2,因素C(培养基)的优水平:k1>k2>k3,优组合为A4B1C1,即MYP 培养基30 ℃培养48 h 的培养物;在m/z1 191 因素A(培养时间)的优水平:k1>k4>k2>k3,因素B(培养温度)的优水平:k1>k2,因素C(培养基)的优水平:k1>k2>k3,优组合为A1B1C1,即MYP 培养基30 ℃培养12 h 的培养物。
R为第j列因素的极差,反映了第j列因素水平波动时,试验指标的变动幅度。R越大,说明该因素对试验指标的影响越大。因此,根据表3中极差R的大小,判断本次试验各因素的影响主次顺序分别是m/z1 175:因素A(培养时间)>因素C(培养基)>因素B(培养温度);m/z1 191:因素C(培养基)>因素B(培养温度)>因素A(培养时间)。
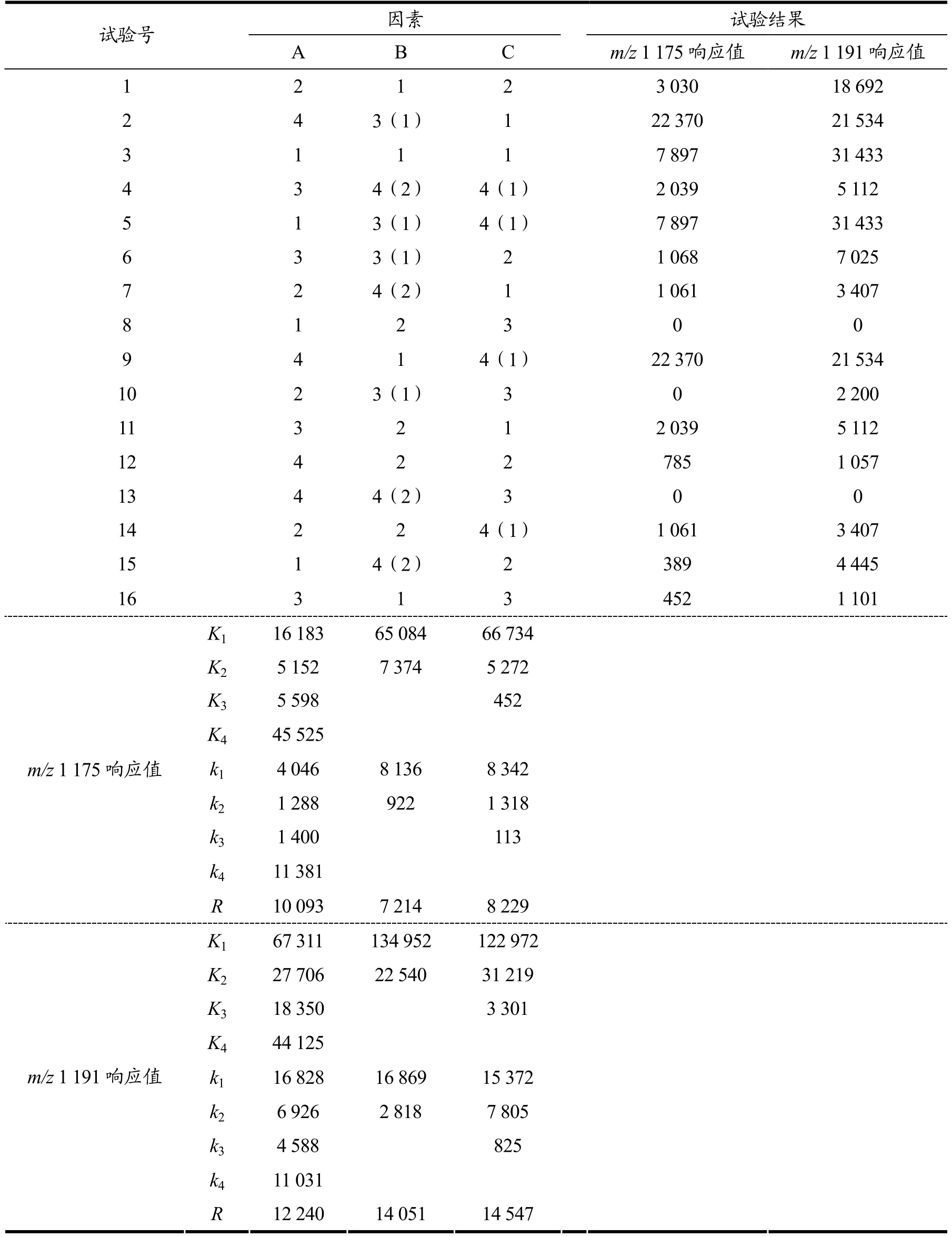
表3 试验结果及极差分析Table 3 Test results and range analysis
以上对m/z1 175 响应值和m/z1 191 响应值两项指标单独分析出的优化条件中,除了因素A(培养时间)不一致,因素B(培养温度)、C(培养基)均一致,综合快速鉴别的时效性考虑,为了在食品监督控制过程中尽快找出产呕吐毒素蜡样芽胞杆菌,故因素A 取A1(12 h),选定最优培养条件组合为A1B1C1,即接种MYP 培养基在30 ℃培养12 h 后进行检验。
Ulrich 等[11]用5wt%羊血哥伦比亚琼脂上37 ℃培养48 h 的培养物,在线性正模式下进行MALDI-TOF MS 检测,虽然可以检测到m/z1 171 和1 187 的两个特征峰,但响应值低于104;Doellinger 等[12]用Caso 琼脂和血平板上37 ℃培养24 h 的培养物,在反射模式下进行MALDI-TOF MS 检测,可直接检测到呕吐毒素相应m/z值为1 175的[M+Na]+和1 191的[M+K]+加合物特征峰,但响应值均小于104,只有经过溶剂提取处理后再进行检测,测量数据响应值才大幅提高(>105)。Carroll等[13]研究显示,蜡样芽胞杆菌合成呕吐毒素的最适温度为20~30 ℃。故笔者认为,使用MYP 培养基上30 ℃培养12 h 的培养物直接进行检测,与CB 4789.14[7]中样品分离培养使用的培养基及培养温度高度契合,有利于产呕吐毒素蜡样芽胞杆菌的生长产毒,可以更快速高效的对产呕吐毒素蜡样芽胞杆菌进行区分。
2.3 方法特异性检验结果
将49 株野生蜡样芽胞杆菌和3 株标准菌株,蜡样芽胞杆菌(CICC 10352)、蕈状芽胞杆菌(CICC 21473)、苏云金芽胞杆菌(ATCC 10792)接种到MYP 琼脂平板上经过30 ℃培养12 h 后,挑取培养物进行MALDI-TOF MS 检测,试验结果如表4、图3、图4所示,其中2 株含ces基因的蜡样芽胞杆菌均检测到呕吐毒素相应的m/z值为1 175 的[M+Na]+和m/z值为1 191 的[M+K]+加合物特征峰,响应值均大于104,其他未携带ces基因的菌株均未检测到相应的特征峰;标准菌株蜡样芽胞杆菌、蕈状芽胞杆菌、苏云金芽胞杆菌均不携带ces基因,试验结果均未检测到相应的m/z值为1 175 的[M+Na]+和m/z值为1 191 的[M+K]+加合物特征峰,特异性达到100%。
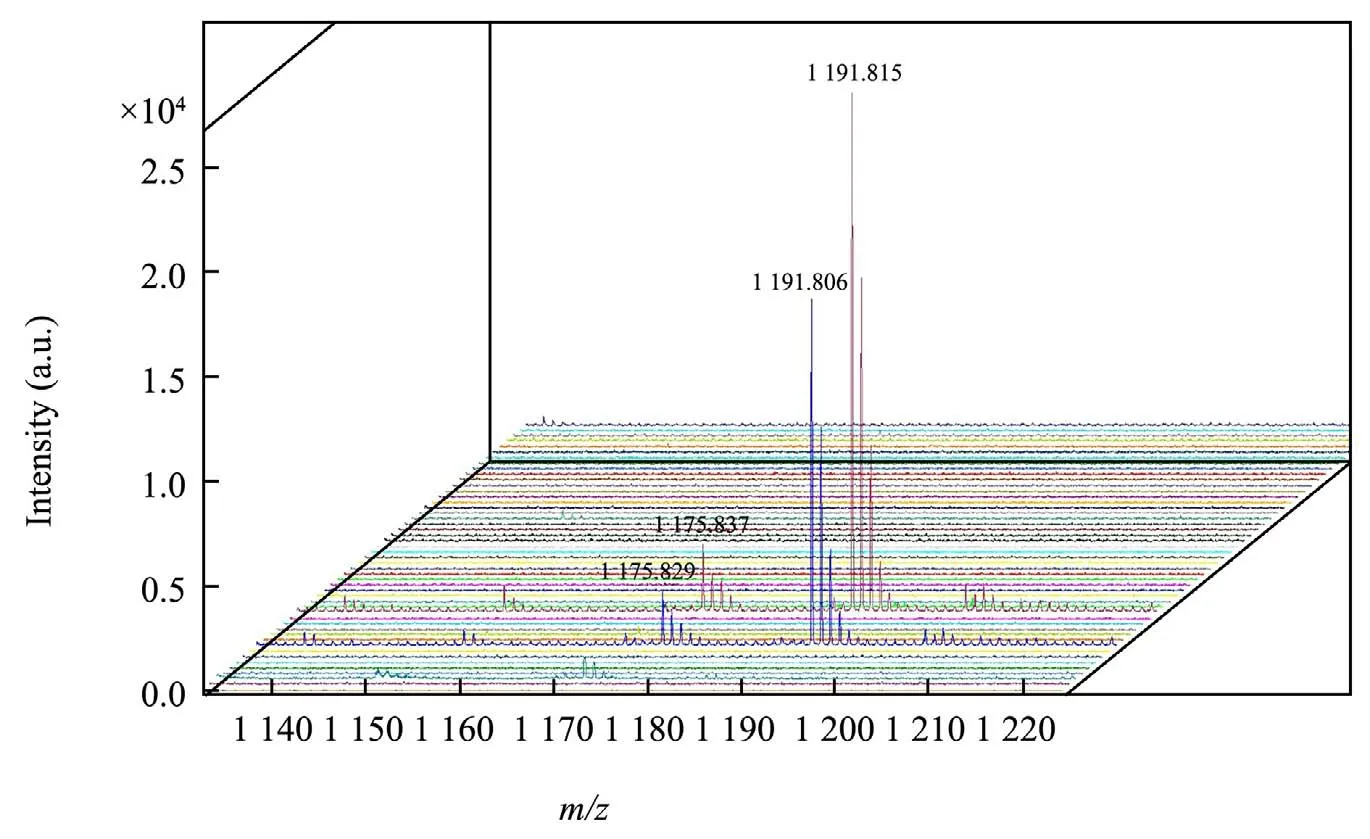
图3 49 株阳性蜡样芽胞杆菌的MALDI-TOF MS 检测结果Fig.3 MALDI-TOF MS detection results of 49 positive strains of Bacillus cereus

图4 标准菌株的检测结果Fig.4 Detection results of standard strains

表4 菌株的检测结果Table 4 Detection results of strains
Ulrich 等[11]对产呕吐毒素和非产呕吐毒素蜡样芽胞杆菌分离株的区分研究中,121 株测试菌株中有120株MALDI-TOF MS 测定结果和PCR 分析的比对结果一致,只有一株产呕吐毒素菌株在MALDI-TOF MS中呈假阴性,主要是因为该菌株产毒能力极低,无法被检测到,作者认为该低产毒菌无法构成公共卫生危害,故MALDI-TOF MS 对产呕吐毒素蜡样芽胞杆菌的检测方法具有较强的特异性(>99%)。Doellinger等[12]共测试了8 株蜡样芽胞杆菌,包括高产毒菌2 株,中产毒菌1 株,低产毒菌3 株,非产毒菌2 株,但未给出8 株菌全部的检测结果和谱图,未进行特异性判断。因此,笔者认为后续若有条件仍可增大样本量对该方法的特异性再进一步验证。
3 结论
蜡样芽胞杆菌是食品生产过程中污染食物的一个主要来源,是食物中毒的主要致病因子之一。虽然目前有国标方法可以检测食品中的细菌污染,但该方法不能区分产呕吐毒素蜡样芽胞杆菌。MALDI-TOF MS技术的易用性和广泛可用性有助于在常规鉴定中检出产呕吐毒素蜡样芽胞杆菌,实验结果表明,运用MALDI-TOF MS 技术检测呕吐毒素相应m/z值为1 175 的[M+Na]+和1 191 的[M+K]+加合物特征峰,可以有效的区分产呕吐毒素蜡样芽胞杆菌,该方法的检测灵敏度可达到0.01 μg/mL。通过正交试验极差分析结果,选用样品培养条件为接种MYP 培养基在30 ℃培养 12 h,培养后直接挑取典型菌落进行MALDI-TOF MS 检测,这与国标检测方法GB 4789.14中对食品中蜡样芽胞杆菌检验的分离条件刚好契合,且培养时间减少一半以上,仅需12 h,且上机检测结果响应值高(>104)。该方法对产呕吐毒素蜡样芽胞杆菌检测特异性强(100%),灵敏度高(0.01 μg/mL),因此可在食品样品检测过程中,使用MYP 培养基平板上的典型菌落直接进行MALDI-TOF MS 检测,如果检测到m/z值为1 175 的[M+Na]+和m/z值为1 191的[M+K]+加合物特征峰且响应值大于104,即可判断该菌为疑似产呕吐毒素蜡样芽胞杆菌,从而锁定该样品并进行进一步的传统细菌鉴定和毒力基因检测确认。该方法是一种适合产呕吐毒素蜡样芽胞杆菌的高通量筛查技术,操作简单、灵敏,可为食品生产危害控制及快速监管提供技术支持,可实现对消费者的保护和食品加工质量的保障,应用前景广阔。
