密生波罗花中神经酰胺类成分的抗炎作用
2022-12-14宋超管雪婷袁巧云何洋张迹胡卫成
宋超,管雪婷,2,袁巧云*,何洋,2*,张迹,2,胡卫成
(1.淮阴师范学院生命科学学院,江苏淮安 223300)(2.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
主产于西藏、云南、四川、甘肃等省的密生波罗花(Incarvillea compactaMaxim.),是我国特有植物,为紫葳科(Bignoniaceae)角蒿属(Incarvillea A.Juss)多年生草本植物,生长于海拔3 300~4 900 m 的草坡[1],是常用藏药,全草入药。据《中华本草:藏药卷》和《藏药志》记载,密生波罗花具有清热、解毒、燥湿、消食之功效[2,3],主要用于治疗肺炎、发热、黄疸、中耳炎、高血压、胃痛等病症[4],其中,以其抗炎作用最为引人注目。然而,目前关于密生波罗花药理作用的机理和生物活性成分的研究仍仅有很少的文献报道。吴海峰等[5]从密生波罗花根中分离了Z-3′′-异甲氧基圆齿列当苷、3′-甲氧基圆齿列当苷、圆齿列当苷和异角胡麻苷等4 个苯乙醇苷类化合物。Zhao 等[6]分析了密生波罗花的化学组成,鉴定了23 种化合物,包括苯丙素苷类、黄酮类、环烯醚萜苷类、三萜类、类固醇等化合物。王明明等[7]从密生波罗花醇提物中分离鉴定了亚麻酸甲酯、苜蓿素、鼠李秦素等10 种化合物。近年来,郭佳佳等[8]从密生波罗花的不同萃取物中鉴定出25 种化合物,并初步证实了密生波罗花水提物具有显著的抗氧化作用和镇痛作用。本实验室在之前的研究中也从密生波罗的根部分离了多种苯乙醇苷类化合物,证明其具有显著的抗氧化活性和肝保护作用[9,10]。
神经酰胺(Ceramides)作为一种鞘脂类物质,是近年来新兴的功能食品、药品和化妆品中的活性成分,对皮肤角质层形成、维持皮肤屏障、保湿、抗衰老等生理功能具有重要作用[11]。此外,神经酰胺还具有调控细胞凋亡、调节应激反应、促进细胞内钙平衡等多种生理作用[12]。纪漫等[13]从龙眼核中分离了富含神经酰胺的活性脂质组分,并发现其对人皮肤成纤维细胞和人永生化角质形成细胞的增殖活性具有明显的促进作用。赵超等[14]采用反复硅胶柱色谱法等分离纯化方法,并通过质谱、核磁共振等波谱分析方法从黑骨藤中分离鉴定了2 个神经酰胺类化合物。李海池等[15]则采用超临界CO2萃取-分子蒸馏法提取了魔芋神经酰胺。目前,从食用或药用植物资源中分离神经酰胺类物质及生理活性应用研究仍显不足。此外,神经酰胺在动植物中的含量普遍较少,因此选取富含神经酰胺的动植物资源,开发功能食品、药品和化妆品已成为神经酰胺开发利用的研究热点。
炎症是动物机体在受到损伤或感染后,在各种致炎因子作用下所发生的一系列由多种细胞、多种因子参与的复杂保护性应激反应,通常在原发的具有血管系统的组织附近首先出现[16,17]。适度炎症会通过激活免疫系统来清除病原体,并促进受损伤组织的愈合,如吞噬搬运坏死组织,消除致病因子等,但是过量的细胞因子、趋化因子等炎症介质会产生级联放大效应,将进一步加剧炎症损伤[18],从而增加包括癌症在内的多种疾病的发病率和死亡率[19,20]。引起炎症的因素很多,主要有细菌、病毒、支原体等病原微生物感染,菌体成分如存在于革兰阴性细菌外膜的脂多糖毒素(LPS)等是细菌感染导致的急性炎症反应中的关键介质,LPS 介导的信号传导途径可引起炎症信号的级联传导或瀑布反应,刺激免疫细胞过量分泌肿瘤坏死因子(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-17(IL-17)及白细胞介素-1β(IL-1β)等促炎细胞因子,可引起多个器官衰竭,甚至出现中毒性休克乃至患者死亡[21,22]。因此,抑制前炎症分子的产生成为预防和治疗各种疾病的重要靶点[23]。本研究通过构建密生波罗花神经酰胺类成分对LPS 刺激RAW264.7 细胞体外细胞炎症模型来探讨密生波罗花神经酰胺类成分的抗炎功效,为保护和合理开发利用我国这一民族药用植物资源提供科学依据。
1 材料与方法
1.1 材料与试剂
密生波罗花:购于青海省西宁市药材市场,由中国医学科学院药用植物研究所吴海峰研究员鉴定,样品保存在淮阴师范学院生命科学学院。四甲基乙二胺(TEMED),上海碧云天生物技术有限公司;亚硝酸钠、噻唑蓝(MTT)、台盼蓝、脂多糖(LPS)、胎牛血清(FBS),美国Sigma 公司;1640 培养基、抗生素,美国Gibco 公司;蛋白质Marker,美国NEB 公司;微量BCA 蛋白定量试剂盒、RIPA 裂解液、30%丙烯酰胺-甲叉双丙烯酰胺溶液,北京康为世纪生物科技有限公司;过硫酸铵,国药集团化学试剂有限公司;Trizol,美国Invitrogen 公司;抗体TNF-α、COS-2、iNOS、β-actin,美国Cell Signaling 公司。
1.2 仪器与设备
Bruker Avance III 400 M 核磁共振波谱仪(氘代吡啶)、Ultimate 3000 型超高效液相色谱仪,美国Dionex公司;串联Thermo Q Exactive Plus 型高分辨质谱,美国Thermo Fisher Scientific 公司;化合物分析鉴定软件,美国Thermo Fisher Scientific 公司;PCR 扩增仪,ABI公司;电泳槽、Gel XP System 伯乐凝胶成像系统,Bio-Rad 公司;数码凝胶图像处理系统,上海天能科技有限公司;分析天平,北京赛多利斯仪器系统有限公司;Tecan Infinite M200PRO 酶标仪,瑞士Tecan 公司;二氧化碳培养箱,日本SANYO 公司;台式高速冷冻离心机,Eppendorf 公司;KQ-500B 超声波清洗器,昆山市超声仪器有限公司。
1.3 方法
1.3.1 密生波罗花神经酰胺的提取与分离
取2.0 kg 干燥的密生波罗花全草粉碎,在60 ℃条件下,用10 L 体积分数95%乙醇提取10 h,重复提取3 次后合并提取液,减压浓缩得提取物382.4 g。将350 g 提取物悬浮于3 L 纯水中,用3 L 乙酸乙酯萃取,重复萃取3 次后合并萃取液,60 ℃减压浓缩,得到乙酸乙酯萃取物86.6 g。取80.0 g 乙酸乙酯萃取物溶于300 mL 甲醇中,然后吸附于柱层析硅胶上(200 g,100~200 目),进行硅胶柱层析(800 g,100~200 目)。先以石油醚-乙酸乙酯(V/V=1:1)的混合溶剂充分洗脱除去其中的中性化合物,然后以二氯甲烷-甲醇-三乙胺(V/V/V=80:20:1)的混合溶剂洗脱,通过薄层色谱(TLC)合并含有生物碱的洗脱液并减压浓缩得密生波罗花神经酰胺(762.3 mg)。
1.3.2 色谱和质谱条件
色谱柱:Waters BEH Amide Column(2.1 mm×100 mm,1.7 μm),柱温:45 ℃,进样体积:5 μL,流速:0.25 mL/min,流动相:A(乙腈-水-10 mmol 乙酸铵-0.1%甲酸);B(异丙醇-乙腈-10 mmol 乙酸铵-0.1%甲酸)。梯度洗脱:0~5 min,15% B~30% B;5~10 min,30%~50% B;10~15 min,50% B~54% B;15~20 min,54% B~70% B;20~35 min,70% B~99% B;35~45 min,99% B;45~50 min,99% B~15% B;50~60 min,15% B。
离子源:加热电喷雾离子化源(HESI);鞘气流量40 arb,辅助气体流量15 arb,毛细管温度320 ℃,辅助气体加热器温度350 ℃,正喷雾电压3.2 kV,负喷雾电压3.0 kV。MS 的分辨率为70 000,MS/MS 的分辨率为17 500,扫描方式为全扫模式,正离子模式检测,质谱扫描范围m/z:100~1 500。未知化合物的鉴定采用Compound discover 3.2、mzcloud 和mzVault数据库。
1.3.3 细胞培养
RAW264.7 细胞培养在温度为37 ℃,CO2体积分数为5%的培养箱中进行,培养基为含有链霉素(100 μg/mL)、青霉素(100 U/mL)及胎牛血清(10wt%)的RPMI 1640 培养基,24~48 h 更换一次培养基,当细胞融合率达80%时,进行继代培养。
1.3.4 密生波罗花神经酰胺对RAW264.7 细胞增殖活性的影响
MTT 工作液配制:取1 g 噻唑蓝试剂溶于200 mL PBS 中,避光条件下用0.22 μm 滤膜过滤除菌,放4 ℃冰箱保存,保存容器需包裹锡箔纸用以避光[24]。MTT终止液配制:称取5.00 g SDS 试剂溶于0.01 mol/L HCl溶液并定容至50 mL。
用细胞刮刮取对数生长期的RAW264.7 细胞加入RPMI 1640 培养基中,将细胞密度调整为每毫升1×106个后接种于96 孔培养板(每孔100 µL),培养16 h。向培养板中加入不同浓度密生波罗花神经酰胺,每个浓度梯度重复3 次,置于37 ℃、体积分数5% CO2培养箱中培养24 h,吸弃孔内培养液并加入MTT 工作液(每孔100 µL),继续培养4 h 后加入MTT 终止液(每孔100 µL),用酶标仪测其550 nm 处A 值。实验同时设置空白组和样本处理组。

式中:
C——相对细胞存活率,%;
A0——空白组孔A 值;
A1——样本处理组孔A 值;
A2——实验组孔A 值。
1.3.5 密生波罗花神经酰胺对 LPS 诱导RAW264.7 细胞释放NO 的影响
取细胞密度为每毫升1×106个的对数生长期RAW264.7 细胞,接种于96 孔培养板(每孔100 µL),培养16 h。加入50 μL 的LPS(最终质量浓度1 μg/mL)刺激30 min 后,加入不同浓度密生波罗花神经酰胺,实验设置LPS 组、实验组和空白对照组,每组重复3次。用Griess 法检测细胞上清液中NO 含量[25]。
1.3.6 密生波罗花神经酰胺对 LPS 诱导RAW264.7 细胞炎症因子mRNA 表达的影响
取对数生长期的RAW264.7 细胞,并用RPMI 1640培养基将细胞浓度调整为每毫升5×106个。取5×106个RAW264.7 细胞,接种于4 mL 培养皿中,培养16 h 后加入LPS(1 μg/mL)刺激30 min,再分别加入质量浓度50 μg/mL、100 μg/mL 的密生波罗花神经酰胺处理细胞6 h,实验设置空白对照组,LPS 组和实验组。用Trizol试剂提取细胞总RNA,取2 μL RNA 逆转录为cDNA用于PCR 扩增。半定量PCR 检测IL-1β、TNF-α及iNOS等炎症因子mRNA 的表达量,PCR 反应体系为:10 μL 2×Taq MasterMix、上下游引物各1 μL、cDNA 2 μL、无菌超纯水6 μL。GAPDH、IL-1β、TNF-α及iNOS 的PCR 扩增条件为:预变性94 ℃、2 min,变性94 ℃、30 s,退火(GAPDH、56 ℃,COX-2、60 ℃,TNF-α、55 ℃)、30 s,延伸72 ℃、40 s,PCR 扩增30 个循环,终延伸72 ℃、5 min。PCR 扩增所用引物由上海生工合成,具体序列见表1。

表1 本文所用相关引物Table 1 Primers used in this work
1.3.7 密生波罗花神经酰胺对 LPS 诱导RAW264.7 细胞IκBα、PDK1 及AKT 蛋白表达和活化的影响
在4 mL培养皿中接种对数生长期RAW264.7 细胞5×106个,培养16 h。加入LPS(终浓度1 μg/mL)刺激30 min 后,分别加入质量浓度为50、100 μg/mL 的密生波罗花神经酰胺处理6 h。吸除培养基并用PBS 冲洗细胞,离心15 min 后(4 ℃、14 000 r/min),加入200 μL 蛋白酶裂解液及一勺玻璃珠充分振荡后再离心10 min(4 ℃、14 000 r/min),上清液即为细胞总蛋白。运用BCA 试剂盒法制作标准曲线测定细胞总蛋白的浓度,通过Western Blot 检测p-IκBα/IκBα、p-PDK1/PDK1及p-AKT/AKT 蛋白表达。将样品蛋白在94 ℃温度下变性5 min 后,SDS-PAGE 电泳分离蛋白并转膜。将蛋白转膜移至封闭液中,室温摇床脱色,分别加入一抗、二抗并室温孵育洗涤,加入显色剂采集图像。实验同时设置空白对照组,LPS 组和药物处理组。
1.3.8 数据分析
本研究细胞实验设立3 个复孔,结果以Mean±SD表示,数据分析在SPASS 20.0 统计分析软件中完成,Sigma Plot 绘图,电泳条带的灰度值采用Image J 软件检测。
2 结果与讨论
2.1 密生波罗花神经酰胺的定量和定性
神经酰胺类生物碱一般含有一个氮原子,在正离子模式下易形成[M+H]+,m/z值显示为偶数。图1为密生波罗花神经酰胺在正离子模式下超高效液相-高分辨质谱总离子流图,依据compound discover 3.2 软件及mzcloud 和mzVault 数据库从中鉴定了138 个化合物,其中113 个化合物为神经酰胺类成分,根据面积归一化法,这113 个化合物的峰面积总和占全部138 个化合物峰面积总和的81.53%。从表2可看出密生波罗花神经酰胺中非生物碱成分主要为滨蒿内酯、verrucarol、乌苏酸和皮诺敛酸,明确化学结构的生物碱有α-linolenoyl ethanolamide 和mexedrone,但含量最高的为各种神经酰胺(Cer)和己糖基神经酰胺(Hexcer)。
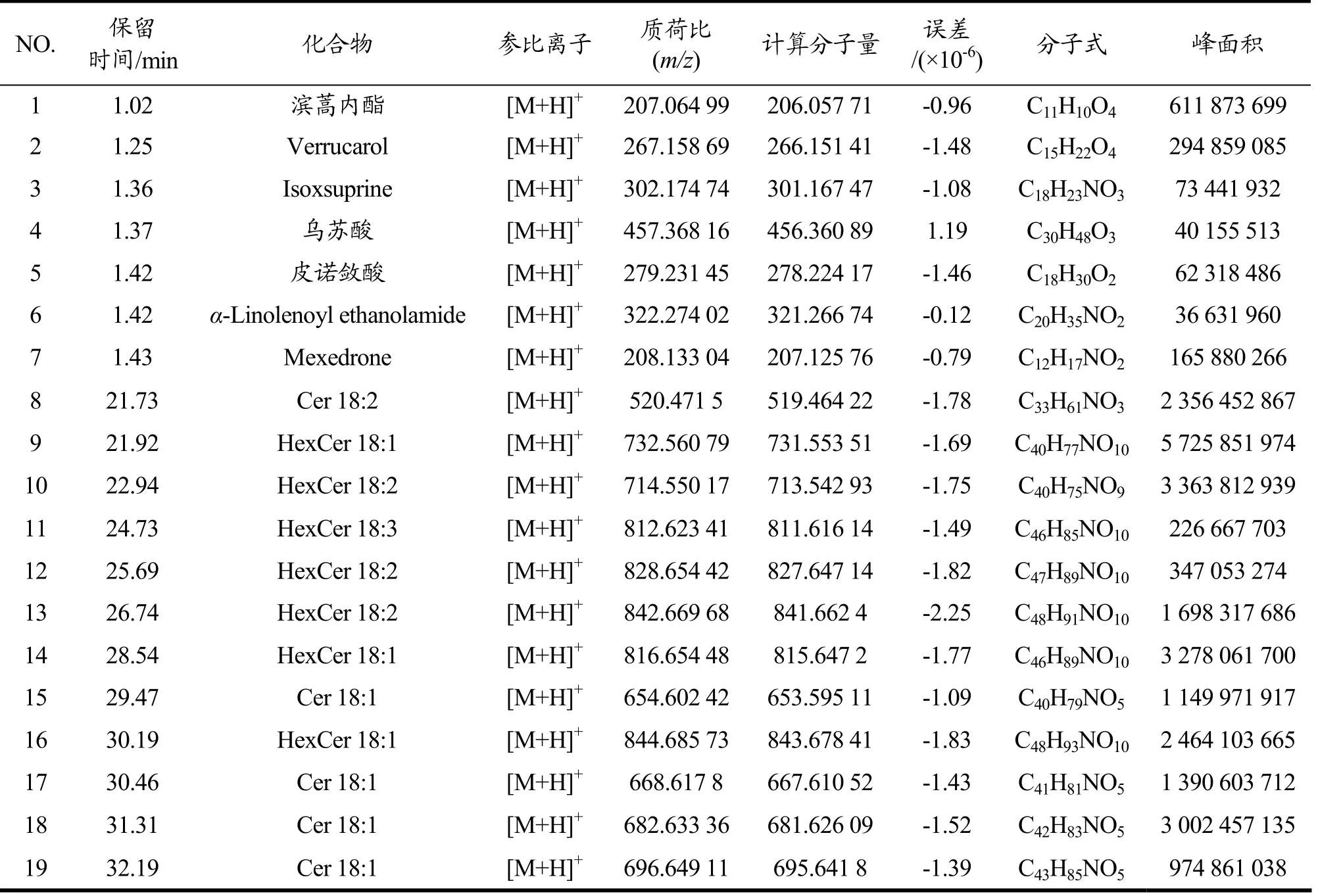
表2 密生波罗花神经酰胺中代表性成分结构信息Table 2 Structural information of some representative compounds in the total ceramides from I.compacta

图1 密生波罗花神经酰胺在正离子模式下超高效液相-高分辨质谱总离子流图Fig.1 UPLC-HR-MS spectrum of the total ceramides from I.compacta in positive ion mode
神经酰胺类化合物的主要结构特点是其含有的2条长脂肪链通过酰胺键相连接,脂肪链大部分以饱和碳原子的形式存在,存在少数双键,少数饱和碳原子连接羟基或通过醚键成环。图2为密生波罗花神经酰胺的核磁共振氢谱图,对比同属植物两头毛中神经酰胺的核磁数据[26],发现两个植物中神经酰胺结构极为类似。δ5.36~5.73 为双键上的烯氢信号,δ3.70~4.92为连氧次甲基信号,δ1.24~2.37 为脂肪链中的亚甲基信号,δ0.86 为脂肪链的末端甲基信号。由于测试样品为一组混合物,结构差异较小,核磁信号重叠严重,导致各组信号的裂分不是很明显。
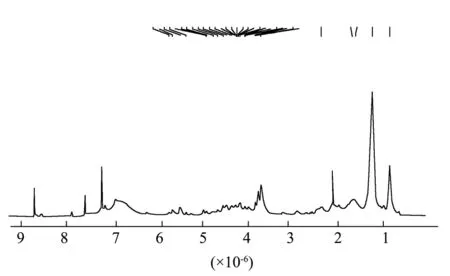
图2 密生波罗花神经酰胺的核磁共振氢谱Fig.2 1H-NMR spectrum of the total ceramides from I.compacta
图3为密生波罗花神经酰胺的核磁共振碳谱图,与两头毛中神经酰胺的核磁数据对比[26],δ14.1 为末端甲基碳信号,δ22.7 为末端甲基旁边的亚甲基碳信号,δ29.2~29.8 为脂肪链中间系列亚甲基碳信号,δ31.9~37.0 为双键、酰胺键或连氧碳原子旁边的亚甲基碳信号,δ55.0~79.0 为各种连氧次甲基碳信号,δ128.0~130.7 为双键碳信号,δ173.0~175.5 为酰胺键碳信号。

图3 密生波罗花神经酰胺的核磁共振碳谱Fig.3 13C-NMR spectrum of the total ceramides from I.compacta
综合UPLC-HR-MS/MS、核磁共振氢谱和核磁共振碳谱数据,并结合文献[26]报道的数据,确定密生波罗花提取物中的主要成分为神经酰胺类化合物。
2.2 密生波罗花神经酰胺对RAW264.7 细胞增殖活性的影响
如图4所示,与正常对照组相比LPS 对细胞无明显毒性,可排除实验中LPS 的影响。浓度为6.25~50 μg/mL的密生波罗花神经酰胺可促进RAW264.7 细胞增值,且细胞相对存活率分别为105.16%、110.86%、111.36%、107.53%。当浓度达100 μg/mL 时,密生波罗花神经酰胺对RAW264.7 细胞有毒性作用(p<0.01),降低了RAW264.7 细胞的增殖活性,细胞相对存活率为88.12%。有学者研究显示,乙酰氨基酚[27]、吲哚美辛[28]等常用抗炎药物的有效成分都具有不同程度的细胞毒性,对细胞的增殖活性具有负影响,甚至有研究指出,临床常用的抗炎药物布洛芬可致患者出现中毒性表皮坏死松解症[29],表现出较强的细胞毒性。与上述抗炎药物相比,密生波罗花神经酰胺具有毒副作用小,安全性高的特点。

图4 密生波罗花神经酰胺对RAW264.7 细胞增殖活性的影响Fig.4 Effects of the total ceramides from I.compacta on RAW264.7 cell proliferative viability
2.3 密生波罗花神经酰胺对LPS 诱导RAW264.7细胞释放NO 的影响
NO 作为毒性很强的气体自由基,过量会对细胞产生毒性作用,促使细胞变性、组织黏连,产生组织损伤,加剧炎症反应[30],且iNOS 是NO 合成所必需的限速酶,iNOS 的表达量与NO 合成量呈正相关。因此,抑制NO的释放或iNOS表达可能成为治疗炎症反应的重要靶点[31]。本研究运用Griess 法检测细胞释放的NO量,得到的NO 反应标准曲线为:y=0.007 4x+0.002 6(R2=0.999 8)。其中,x为样品浓度,y为A 值。
如图5所示,LPS 可刺激RAW264.7 细胞释放远高于正常状态下的NO,且对照组比较差异性显著(p<0.05)。加入密生波罗花神经酰胺后,RAW264.7细胞NO 释放量明显降低(p<0.01),且NO 释放量与加入的密生波罗花神经酰胺浓度呈现出负相关关系,加入6.25、12.5、25、50、100 μg/mL 的密生波罗花神经酰胺后,RAW264.7 细胞NO 释放量分别为45.13、38.85、28.79、12.27、4.61 μmol/L,抑制率分别为12.53%、24.71%、44.19%、76.23%、91.07%。因此,LPS 能诱导RAW264.7 细胞释放NO,而密生波罗花神经酰胺能够不同程度抑制LPS 诱导RAW264.7 细胞分泌NO 呈浓度依赖性。

图5 密生波罗花神经酰胺对RAW264.7 细胞释放NO 的影响Fig.5 Effects of the total ceramides from I.compacta on RAW264.7 production of NO
有学者研究表明,浓度为0.625 mg/mL 的常用抗炎药物安儿宁颗粒,对LPS 诱导RAW264.7 细胞释放NO的抑制率为43.64%[32],100 μg/mL 的柴桂口服液对LPS诱导RAW264.7 细胞释放NO 的抑制率为70.85%[33],低于本研究中相近浓度密生波罗花神经酰胺对LPS 诱导RAW264.7 细胞释放NO 的抑制率。
2.4 密生波罗花神经酰胺对LPS 诱导RAW264.7细胞转录IL-1β、TNF-α 及iNOS mRNA 的影响
细菌脂多糖(LPS)为革兰氏阴性细菌细胞壁外膜主要成分,也是重要的致炎因子,可诱导小鼠单核巨噬细胞表达、释放多种炎症介质[21,34],如TNF-α、IL-1β、iNOS 及NO 等,从而引发和加重炎症并产生组织损伤[35]。其中TNF-α是炎症反应初期最早产生的重要炎症介质,可刺激其他致炎因子的表达、释放[36],并促使炎症介质聚集[37],诱发并扩大炎症反应。IL-1β是炎症反应中的重要介质,且在组织损伤后会在浓度升高,能够维持、促进炎症反应,导致疼痛产生[38]。
如图6所示,由半定量PCR 结果可知,LPS 可促使RAW264.7 细胞内IL-1β、TNF-α及iNOS 相关炎症因子的mRNA 表达水平显著升高。密生波罗花神经酰胺对IL-1β、TNF-α及iNOS 的mRNA 表达均有一定的抑制作用,电泳条带灰度值分析结果显示,密生波罗花神经酰胺对IL-1β和TNF-αmRNA 表达的抑制作用更为明显,且浓度越高,抑制效果越好。
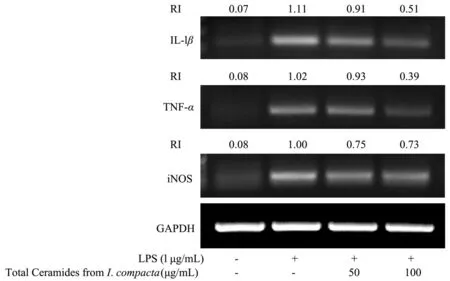
图6 密生波罗花神经酰胺对LPS 诱导RAW264.7 细胞IL-1β、TNF-α 及iNOS mRNA 表达的影响Fig.6 Effects of the total ceramides from I.compacta on IL-1β and TNF-α and iNOS mRNA expression in RAW264.7 cells in response to LPS stimulation
2.5 不同浓度密生波罗花神经酰胺对LPS 诱导RAW264.7 细胞IκBα、PDK1 及AKT 蛋白表达及活化的影响
磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路是介导细胞炎症反应和免疫应答的重要细胞信号传导途径[39],在多种慢性疾病中发挥促炎作用[40,41]。IκBα、PDK1 及AKT 蛋白是PI3K/AKT 信号通路传导过程中的关键媒介底物,在静息状态下,通常以失活的状态存在于细胞质中,当有信号激活后,IκBα、PDK1及AKT 蛋白会磷酸化,产生p-IκBα、p-PDK1 及p-AKT蛋白,从失活状态活化后转移到细胞核内,与相应的炎症相关基因结合,启动炎性细胞因子转录,诱发炎症[42]。Western Blot 检测结果显示,正常情况下,RAW264.7 细胞中IκBα、PDK1 及AKT 蛋白均有所表达,但p-IκBα、p-PDK1 及p-AKT 蛋白表达水平相对较低,即IκBα、PDK1 及AKT 蛋白活化程度较弱。在LPS 刺激下,p-IκBα、p-PDK1 及p-AKT 蛋白含量明显提升,即IκBα、PDK1 及AKT 蛋白活化程度提高。
密生波罗花神经酰胺对IκBα、PDK1 及AKT 蛋白的表达有抑制作用,且对其活性亦有抑制作用,且密生波罗花神经酰胺对PDK1 及AKT 蛋白表达的抑制作用具有浓度依赖性(如图7所示)。该结果表明在LPS刺激下,即IκBα、PDK1 及AKT 蛋白活化程度提高,但在密生波罗花神经酰胺干预后,其可通过抑制IκBα、PDK1 及AKT 蛋白的表达及活化来调控PI3K/AKT 信号转导通路,从而控制炎性细胞因子转录,减轻炎症反应[43]。

图7 密生波罗花神经酰胺对LPS 诱导RAW264.7 细胞IκBα、PDK1 及AKT 蛋白表达及活化程度的影响Fig.7 Effects of the total ceramides from I.compacta on IκBα and PDK1 and AKT expression and activation in RAW264.7 cells in response to LPS stimulation
3 结论
本文从紫葳科角蒿属植物密生波罗花中提取了神经酰胺类成分,并对其体外抗炎活性进行了初步的研究。结果显示,低浓度的密生波罗花神经酰胺对LPS诱导的RAW264.7 细胞增殖活性具有促进作用,且密生波罗花神经酰胺干预可通过抑制iNOS mRNA 和蛋白表达,从而有效控制NO 的产生,减轻炎症反应和组织损伤。在密生波罗花神经酰胺干预后,LPS 刺激RAW264.7 细胞TNF-α、IL-1βmRNA 表达量明显降低,且呈剂量依赖性递减,表明密生波罗花神经酰胺对IL-6和IL-1β的表达具有抑制作用,有利于炎症的治疗和炎症引起的组织损伤恢复。密生波罗花神经酰胺干预还可抑制IκBα、PDK1 及AKT 蛋白的表达及活化,从而控制炎性细胞因子转录,减轻炎症反应。综上所述,密生波罗花神经酰胺可以通过抑制IκBα、PDK1 及AKT 蛋白的表达及其活化,减少IL-1β、TNF-α及iNOS相关炎症因子mRNA 和蛋白质的表达和NO 产生,从而抑制炎症反应的过程。
