乳双歧杆菌V9对头孢曲松钠作用小鼠肠道菌群的变化
2022-12-14熊雪梅李可文陈苗苗文艺冯文祎郑秋生
熊雪梅,李可文,陈苗苗,文艺,冯文祎,郑秋生*
(1.石河子大学药学院,新疆植物药资源利用教育部重点实验室,新疆石河子 832000)(2.东北农业大学,黑龙江哈尔滨 150030)(3.北京联合大学生物化学工程学院,北京 100023)
头孢曲松钠属于第三代头孢菌素类药物,能够抑制细胞壁的合成发挥抗菌作用[1],对革兰氏(+)菌、革兰氏(-)菌都能发挥杀菌作用,在临床上可以用于治疗金黄色葡萄球菌、肺炎链球菌、屎肠球菌、大肠埃希菌、产气肠杆菌等敏感菌导致的各种感染[2]。长期使用头孢曲松钠会引起肠道菌群失调、肠道组织病变及脾脏指数降低等[3]。研究结果表明,广谱抗生素可以影响肠道中大约三分之一的细菌类群的丰度,导致分类丰富度、多样性和均匀性迅速而显著地发生变化[4]。肠道菌群平衡是维持人体微生态环境稳定的重要条件,与机体的免疫、代谢等密切相关[5],其组成和丰度变化可能会造成与肠道菌群改变相关的疾病,如代谢综合征、过敏、Ι 型糖尿病、癌症等[6,7]。
通过补充益生菌能够对抗生素造成的肠道微生物紊乱起到一定的调节作用[8]。蒋丰岭等[9]研究证明益生菌复合制剂的使用可通过增加双歧杆菌、减少某些致病菌的方式一定程度上改善头孢曲松导致的菌群紊乱。陈大卫等[10]研究证实混合乳酸菌能够混合乳酸菌菌悬液及其发酵乳可以改善由盐酸林可霉素诱导的小鼠肠道菌群紊乱。根据2002年世界卫生组织的定义,益生菌是给予适量的时候能够对宿主健康有积极影响的活的微生物[11]。在临床实践中,最常用的益生菌是乳酸菌属、双歧杆菌属、链球菌属以及酵母菌属,而人类正常的胃肠道菌群主要有乳杆菌属、双歧杆菌属等[12]。益生菌调节和重建宿主肠道微生物群的功效已得到公认,如加强肠道屏障、抑制肠道黏膜炎症等[13]。一些报道证实了益生菌在各种疾中的临床有效性,包括急性胃肠道感染和炎症性肠病[14,15],以及调节抗生素导致的肠道内菌群失调来增强机体的免疫力。乳双歧杆菌 V9(Bifidobacterium lactisV9)是从蒙古族健康儿童肠道中分离得到的一株益生菌,是动物双歧杆菌乳亚种,对人工胃液,肠液以及胆盐有良好的耐受性,具有调节肠道菌群平衡、抗炎、防止腹泻、增强免疫的功能[16,17]。
因此,本实验通过给予小鼠头孢曲松钠建立肠道菌群失调实验动物模型,乳双歧杆菌V9 灌胃,同时采用高通量测序技术测定小鼠粪便菌群以分析灌胃前后的肠道菌群差异,HE 染色法观察小肠组织病理学改变,免疫组化法检测IL-1β、IL-6 和TNF-α表达,从而探讨益生菌乳双歧杆菌V9 对小鼠肠道菌群失衡的恢复作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
60 只健康SPF 清洁级BALB/c 雄性小鼠,体质量18~20 g,购自北京华阜康生物科技股份有限公司,实验动物使用许可证号:SYXK(京)2017-0038。所有小鼠饲养于北京联合大学应用文理学院保健食品功能检测中心SPF 级动物室,温度(20±2)℃,相对湿度46%~60%。本研究的动物实验设计方案符合北京联合大学伦理委员会审核标准(实验动物伦理委员会意见书编号2021-5)。
1.1.2 主要实验试剂
头孢曲松钠,上海阿拉丁生化科技股份有限公司;乳双歧杆菌V9,北京科拓恒通生物技术股份有限公司;伊红美蓝(EMB)琼脂培养基、叠氮钠-结晶紫-七叶苷(BEA)琼脂培养基、双歧杆菌(BS)琼脂培养基、乳酸杆菌选择性(LBS)琼脂培养基、产气荚膜梭菌选择性培养基,青岛海博生物技术有限公司;IL-2、IL-6、IL-1β、TNF-α,武汉华美生物工程有限公司;MDA、SOD、GSH、GSH-PX 测定试剂盒,南京建成生物工程研究所有限公司;Qiagen Gel Extraction Kit 试剂盒,QIAgen 公司;Gene JETTMGel Extraction Kit 试剂盒,Thermo Fisher scientific 公司;TruSeq PCR-Free DNA 建库试剂盒,Illumina 公司;HE 染液,武汉塞维尔生物科技有限公司。
1.1.3 主要实验设备
TECAN 酶标仪,广州深华公司;电子分析天平,Sartorius 公司;高压灭菌锅,Zealway 公司;低温超高速台式离心机,Eppendorf 公司;漩涡振荡器,IKA 公司;紫外可见分光光度计,尤尼柯(上海)仪器有限公司;Qubit@2.0 荧光仪,Thermo Fisher scientific 公司;Donatello 脱水机、Giotto 染色机,DANJIER 公司;RM2016 病理切片机,上海徕卡仪器有限公司。
1.2 方法
1.2.1 动物及样品处理
将60 只雄性BALB/c 小鼠适应性饲养7 d 后随机抽12 只作为对照组,其余48 只小鼠用200 mg/mL 头孢曲松钠(0.2 mL/d)连续灌胃5 d,然后随机分为4 组,每组12 只,分别为模型组、低(乳双歧杆菌1.3×108CFU/kg)、中(乳双歧杆菌2.6×108CFU/kg)、高(乳双歧杆菌8.0×108CFU/kg)剂量组,每只灌胃0.2 mL/d,连续灌胃23 d。在此期间每天测量小鼠体重和记录摄食情况。灌胃益生菌23 d 结束后,将小鼠脱颈处死,腹主动脉取适量血,4 ℃静置后离心,取上清,分装,保存于-80℃冰箱备用。取全部小鼠的心、肝、脾、肺、肾、空肠及小肠组织,部分用多聚甲醛固定,剩余部分保存于-80 ℃冰箱备用。计算脏器系数及小肠重量和长度。
1.2.2 血清细胞因子含量测定
取出保存于-80 ℃冰箱中的血清,按照ELISA 试剂盒说明书要求测定血清中IL-1β、IL-6、TNF-α及IL-2 含量。
1.2.3 小肠及肝脏抗氧化水平测定
取出保存于-80 ℃冰箱中的小肠及肝脏组织,称取约0.2 g,加入预冷的PBS 缓冲液,匀浆,制备成10%的组织匀浆液,离心,取上清,按照试剂盒说明书测定小肠及肝脏组织中SOD、MDA、GSH 及GSH-Px 含量。
1.2.4 小肠组织病理学观察
多聚甲醛固定空肠组织24 h 后,石蜡包埋切片,HE染色,脱水封片,在显微镜下观察空肠组织形态学改变。
1.2.5 粪便活菌计数
在无菌条件下分别收集灌胃益生菌第0、23 天的小鼠粪便,与稀释液充分混合,依10倍系列稀释至10-8,分别接种于选择性培养基上,采用平板活菌计数法计算菌落数,计算每克粪便中的活菌数(CFU/g)。肠杆菌:接种在伊红美蓝琼脂培养基上,37 ℃有氧培养24 h,计数发酵乳糖、G-杆菌的所有菌落。肠球菌:接种在叠氮钠-结晶紫-七叶苷琼脂培养基上,37 ℃有氧培养48 h,计数有明显褐色圈、G+球菌的所有菌落。乳杆菌:接种在LBS 琼脂培养基上,37 ℃有氧培养48 h,计数过氧化氢酶试验阴性、G+无芽孢杆菌的所有菌落。双歧杆菌:接种在双歧杆菌琼脂培养基上,37 ℃厌氧培养48 h,计数过氧化氢酶试验阴性、G+无芽孢多形态杆菌的所有菌落。产气荚膜梭菌:接种在胰眎-亚硫酸盐-环丝氨酸(TSC)培养基上,37 ℃厌氧培养24 h,计数所有在紫外光下有荧光的黑色菌落。
1.2.6 粪便DNA 提取及高通量测序
连续灌胃23 d 后,无菌条件下收集各组小鼠粪便置于干燥的灭菌试管中,-40 ℃冻存备用,采用CTAB 法提取样品的基因组DNA 并用2wt%琼脂糖凝胶进行电泳检测其浓度和纯度,然后进行PCR 扩增和测序。16S rDNA V3-V4 区域扩增,上游引物为:5’-CCTAYGGGR BGCASCAG-3’,下游引物为3’-GGACTACNNGGGT ATCTAAT-5’,使用TruSeq® DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,通过Illumina NovaSeq6000 对该文库进行双末端测序,将数据结果处理过滤后,对样品进行物种多样性和菌群构成进行分析。
1.3 数据处理
实验数据用平均值±标准偏差(±s)表示,并使用SPSS Statistics 21.0和Origin 2021统计软件进行数据处理,组间的比较采用单因素方差分析。p<0.05 即认为差异有统计学意义。
2 结果与分析
2.1 小鼠的摄食与体重
如图1a 和图1b 所示,与对照组相比,抗生素干预后各组小鼠的体重有轻微的降低,停止抗生素干预后体重逐渐恢复正常,且在正常范围内逐渐增加,而灌胃后各组小鼠摄食量随着天数逐渐增加,与对照组小鼠趋势一致,表明益生菌干预对小鼠体重及摄食均无影响。

图1 乳双歧杆菌V9 对小鼠体重(a)和(b)摄食影响Fig.1 Effect of Bifidobacterium lactis V9 on body weight (a) and food intake (b) level of mice
2.2 乳双歧杆菌V9 对小鼠脏器系数的影响
如图2b 所示,与模型组相比,中剂量组小鼠肝系数有一定差异(p<0.05)。说明头孢曲松钠对小鼠肝系数有一定影响。由图2a、2c、2d、2e、2f 可知,与模型组相比,各剂量组小鼠的心、肝脏、脾脏、肺、肾、胸腺系数不存在显著性差异,说明乳歧杆菌V9 对小鼠脏器系数基本无影响。
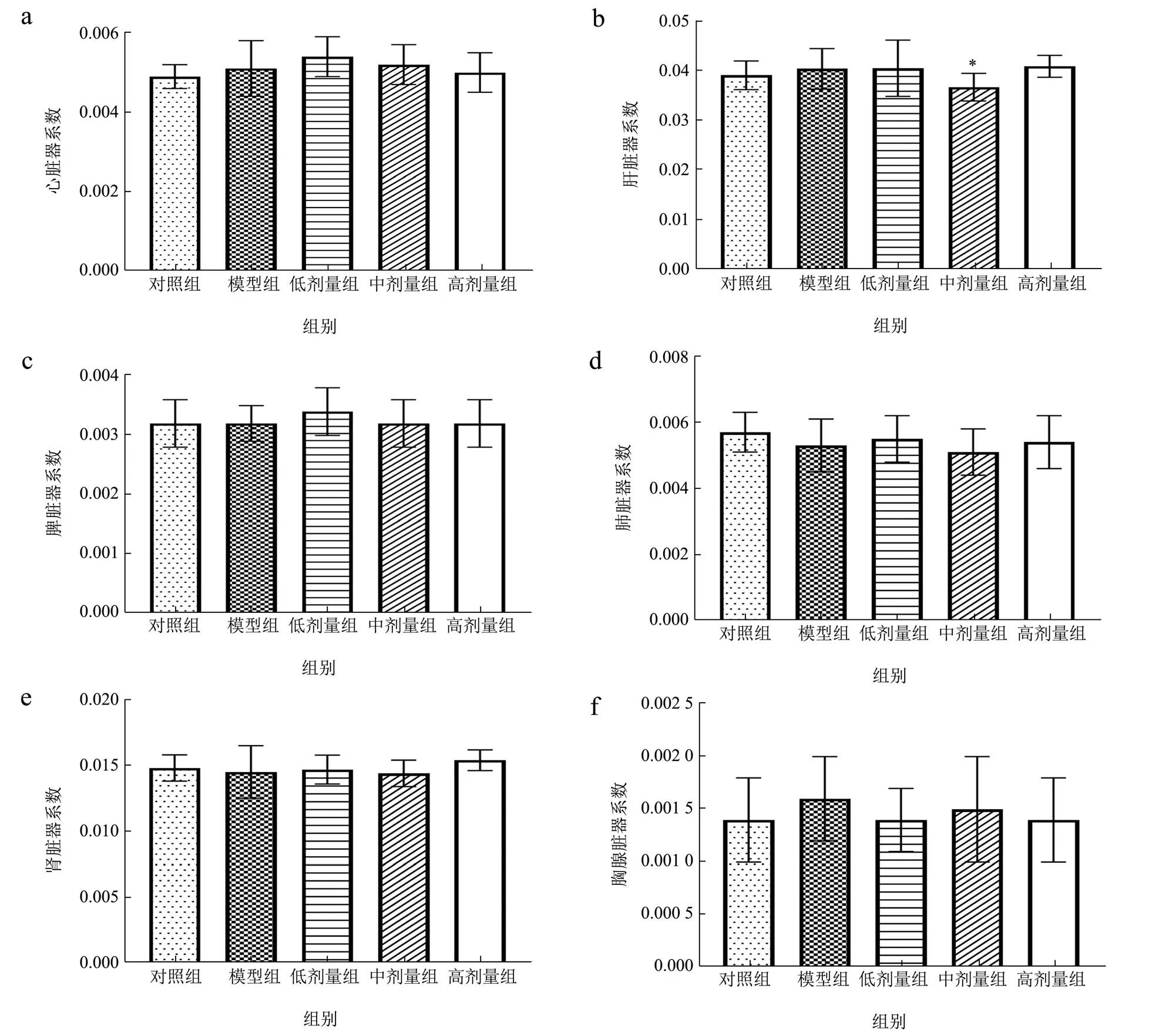
图2 乳双歧杆菌V9 对小鼠心(a)、肝(b)、脾(c)、肺(d)、肾(e)和胸腺(f)脏器系数的影响Fig.2 Effects of Bifidobacterium lactis V9 on organ coefficients of heart (a),liver (b),spleen (c),lung (d),kidney (e) and thymus (f) in mice
2.3 乳双歧杆菌V9 对小鼠小肠重量及长度的影响
如图3a、3b 所示,对照组、模型组和各剂量组小鼠小肠的重量和长度没有显著性差异,说明灌胃头孢曲松钠和乳双歧杆菌V9 对小鼠小肠重量和长度没有影响。

图3 乳双歧杆菌V9 对小鼠小肠重量(a)和长度(b)影响Fig.3 Effect of Bifidobacterium lactis V9 on weight (a) and length (b) of mice
2.4 乳双歧杆菌V9 对小鼠血清中细胞因子的影响
肠道菌群失调会导致多种促炎因子的产生,如IL-1β、IL-6、TNF-α及IL-2,它们与炎症发生发展密切相关,参与介导炎症细胞的激活。在正常机体中含量非常低,但是当炎症发生时水平会有明显升高[8]。
如表1可知,与对照组比较,模型组IL-1β、IL-6、TNF-α及IL-2 的含量极显著升高(p<0.01),分别增加48.22、7.35、7.37 及18.48 pg/mL;与模型组相比,低剂量组血清细胞因子IL-6、TNF-α含量极显著降低(p<0.01),IL-1β含量显著降低(p<0.05),IL-2 的含量有降低的趋势,但差异不具有统计学意义(p>0.05);中剂量组以及高剂量组血清细胞因子IL-1β、IL-6、TNF-α及IL-2 的含量均极显著降低(p<0.01),分别降低31.73、17.04、12.57 及31.71 pg/mL。以上结果表明,抗生素头孢曲松钠引起促炎因子IL-1β、IL-6、TNF-α及IL-2 水平升高,使得机体产生炎症反应,而乳双歧杆菌V9 可显著降低血清中炎症因子水平,使炎症反应得到有效改善。这与Azad 等[18]的研究一致,益生菌能够降低机体炎症因子水平。

表1 小鼠血清中各细胞因子的含量Table 1 The content of each cytokine in mouse serum (pg/mL, n=12)
2.5 乳双歧杆菌V9 对小鼠小肠及肝脏组织抗氧化的影响
大量研究的表明,肠道菌群失调大多和体内产生大量的自由基有关。在正常情况下,动物机体内都存在自由基清除系统,SOD、GSH 和GSH-Px 酶可以清除体内产生的自由基,MDA 是脂类物质氧化应激的终产物,可以反映机体损伤程度。当机体受到刺激损伤时,SOD、GSH 和GSH-Px 酶活性显著降低,MDA 水平显著升高[19],因此联合测定这4 个指标可衡量机体的抗氧化能力。
如表2所示,在肝脏中,与对照组比较,模型组GSH 及GSH-Px 的含量极显著降低(p<0.01),SOD含量显著降低(p<0.05),MDA 含量显著升高(p<0.05)。与模型组相比,中、高剂量组SOD、GSH 及GSH-Px的含量均极显著升高(p<0.01),在小肠中分别增加122.34 U/mg prot、13.93 mg GSH/mg prot 及13.29 U/mg prot,在肝脏中分别增加90.9 U/mg prot、4.97 mg GSH/mg prot 及13.21 U/mg prot;高剂量组MDA 含量极显著降低(p<0.01),小肠中降低1.31 nmol/mg prot,肝脏中降低1.0 nmol/mg prot。以上结果表明,头孢曲松钠可抑制机体抗氧化物质SOD、MDA、GSH 及GSH-Px 产生,而乳双歧杆菌V9 可显著恢复抗氧化物质在体内的水平,说明乳双歧杆菌V9可增强小鼠机体清除自由基的能力,提高机体抗活性氧损伤的能力。

表2 乳双歧杆菌V9 对小鼠小肠组织SOD、MDA、GSH 和GSH-Px的测定Table 2 Determination of SOD,MDA,GSH and GSH-PX in small intestine of mice by Bifidobacterium lactis V9
2.6 乳双歧杆菌V9 对小鼠小肠组织病理学改变的影响
如图4所示,对照组、抗生素干预后模型组以及益生菌灌胃后各剂量组小肠病理切片图可知,各组小肠组织形态结构完整,绒毛细长且密集,柱状细胞和上皮细胞,未见明显炎症。说明短时间头孢曲松钠灌胃对小肠绒毛没有影响,各剂量乳双歧杆菌V9 灌胃对小肠组织形态也无明显影响。
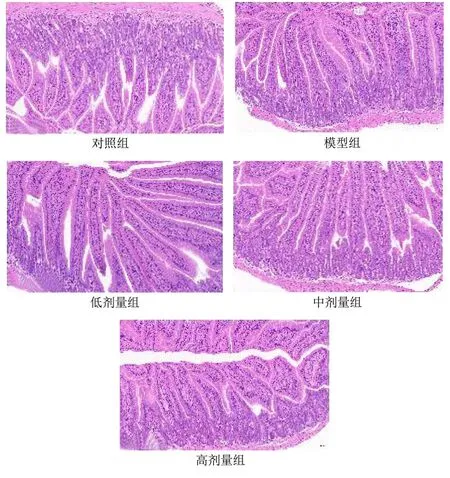
图4 小肠苏木精和伊红染色光镜图Fig.4 Light micrograph of the small intestine stained with hematoxylin and eosin
2.7 乳双歧杆菌V9 对小鼠肠道菌群的影响
2.7.1 粪便活菌数分析
由表3可知,用抗生素造成肠道菌群紊乱后,与对照组相比,模型组肠杆菌、肠球菌、乳杆菌、双歧杆菌数量显著降低(p<0.01),分别减少2.68、2.93、2.84、17.07 lg cfu/g。产气荚膜梭菌数量无显著差异(p>0.05)。灌胃益生菌后,与模型组比较,高剂量组肠杆菌的数量显著降低(p<0.01),降低0.34 lg cfu/g。乳杆菌以及双歧杆菌的数量显著增加(p<0.01),分别增加0.40 lg cfu/g 和0.26 lg cfu/g。各剂量组肠球菌、产气荚膜梭菌数量均无显著性差异(p>0.05)。以上结果表明乳双歧杆菌V9 可以抑制肠杆菌生长,显著促进乳杆菌和乳双歧杆菌生长,对肠球菌和产气荚膜梭菌无明显影响。说明乳双歧杆菌V9 具有促进有益菌的生长,抑制有害菌的生长,对肠道菌群有一定的调节作用。

表3 0 d 和23 d 粪便肠道菌群计数Table 3 Count of fecal intestinal flora at 0 d and 23 d (lg cfu/g)
2.7.2 Alpha 多样性分析
Alpha 多样性主要关注局域均匀生境下的物种数目,可以衡量物种分布的多样性和均匀度,并直接反映测序的深度和数量,包括Observed-species、ACE、Chao1、Shannon 和Simpson 等多样性指数[20]。ACE 指数和Chao1 指数可以评估样本的菌群丰度,Shannon指数和Simpson 指数评估样本菌群多样性[21]。
由表4可知,与对照组相比,短时间灌胃头孢曲松钠使小鼠肠道菌群的丰度和多样性异常升高(p>0.05),而益生菌乳双歧杆菌V9 灌胃可显著改善此现象(p<0.01)。
表4 各组肠道菌群α 多样性Table 4 Alpha diversity of intestinal microbial flora among groups (±s)
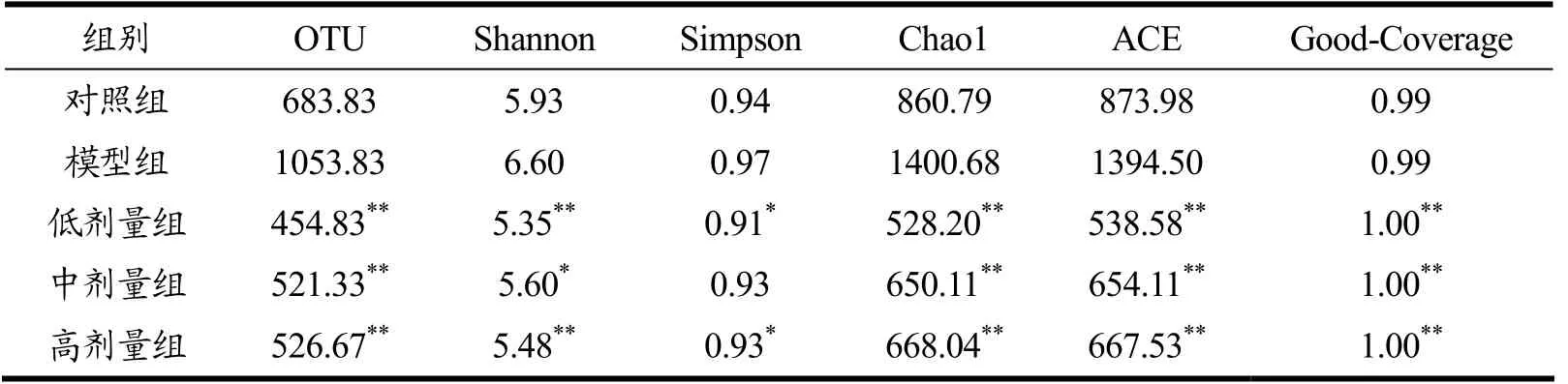
表4 各组肠道菌群α 多样性Table 4 Alpha diversity of intestinal microbial flora among groups (±s)
组别 OTU Shannon Simpson Chao1 ACE Good-Coverage对照组 683.83 5.93 0.94 860.79 873.98 0.99模型组 1053.83 6.60 0.97 1400.68 1394.50 0.99低剂量组 454.83** 5.35** 0.91* 528.20** 538.58** 1.00**中剂量组 521.33** 5.60* 0.93 650.11** 654.11** 1.00**高剂量组 526.67** 5.48** 0.93* 668.04** 667.53** 1.00**
2.7.3 菌群构成分析
正常的健康肠道菌群主要由厌氧菌组成,主要由拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobiota)组成,其中前4 个菌门占肠道总菌群的98%。肠道菌群按照功能可以分为有益菌、有害菌和条件致病菌,主要集中在厚壁菌门和拟杆菌门,其他细胞只占很小的比例[22]。
由表5和图5可知,在门水平上,各组样本主要优势菌门为拟杆菌门和厚壁菌门,它们在肠道中通常是占主导地位的[23],它们能够参与能量的供应及肠道中多糖的发酵[24]。抗生素处理后,模型组小鼠肠道菌群中unidentified_Bacteria 和酸杆菌门Acidobacteriota丰度显著增加(p<0.05),分别增加2.23%、0.66%。乳双歧杆菌V9 处理后,Acidobacteriota、脱铁杆菌门Deferribacteres 和Others 丰度显著减少(p<0.01),分别减少0.83%、0.01%、2.77%,Proteobacteria 和Firmicutes丰度显著减少(p<0.05),分别减少3.14%、9.28%。门水平结果说明乳双歧杆菌 V9 可以抑制Acidobacteriota 的生长。
表5 门水平各组间肠道菌群分析Table 5 Analysis of intestinal microbial flora among groups in phylum level (±s)

表5 门水平各组间肠道菌群分析Table 5 Analysis of intestinal microbial flora among groups in phylum level (±s)
相对丰度/%菌群 对照组 模型组 低剂量组 中剂量组 高剂量组Bacteroidota 50.78±18.40 52.72±5.03 44.29±9.18 56.80±14.60 61.24±12.23 Firmicutes 33.88±13.45 27.63±3.96 35.24±10.83 23.87±10.87 18.35±7.71*Verrucomicrobiota 6.08±11.90 2.49±3.88 12.40±14.44 11.44±12.21 6.77±10.37 Actinobacteriota 0.94±0.53 2.52±2.23 17.29±0.59 1.44±0.73 6.02±6.49 Proteobacteria 2.68±1.47 3.47±2.08 1.00±1.64 0.33±0.39* 1.53±2.79 unidentified_Bacteria 1.87±0.90 4.10±1.35# 2.63±2.13 2.08±1.00* 2.02±1.54*Desulfobacterota 0.54±0.72 0.524±0.41 0.425±0.20 1.09±1.61 0.54±0.63 Campylobacterota 0.34±0.21 0.69±0.55 0.86±0.86 1.01±0.67 1.10±1.35 Acidobacteriota 0.19±0.27 0.85±0.43# 0.04±0.08** 0.08±0.17** 0.03±0.06**Deferribacteres 0.01±0.01 0.01±471.42 0.00±0.00** 0.02±0.02 0.17±0.34 others 2.68±1.08 5.01±2.14 1.38±0.60** 1.84±1.01* 2.24±1.56*
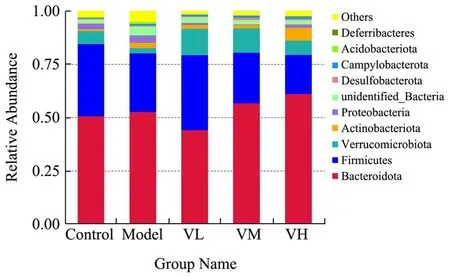
图5 灌胃前后小鼠肠道菌群在门水平上的丰度变化Fig.5 Changes in the abundance of intestinal microbiota at phylum level before and after gavage
由表6和图6知,在属水平各组主要优势菌有艾克曼菌属(Akkermansia)、杜波希氏菌属(Dubosiella)、毛螺旋菌(Lachnospiraceae_NK4A136_group)、乳酸杆菌属(Lactobacillus)。艾克曼氏菌具有抗炎,维持机体肠道健康和调节代谢紊乱的作用[25,26]。杜波希氏菌属与大多数差异脂类代谢产物显著相关[27]。乳酸杆菌属能够改善肠道屏障功能,抑制肠道病原菌的繁殖[28]。抗生素处理后,模型组拟普雷沃菌属(Alloprevotella)数量极显著增加(p<0.01),增加5.07%;而乳双歧杆菌V9 灌胃后,Bifidobacterium数量显著增加(p<0.05),增加0.68%,理研菌(Alistipes)数量极显著增加(p<0.01),增加2.91%,Alloprevotella数量显著减少(p<0.05),减少3.86%,Others数量极显著减少(p<0.01),减少17.07%。上述结果说明乳双歧杆菌V9 可以促进肠道内Alistipes增殖。Dziarski 等[29]研究表明,Alistipes finegoldii可以减缓肠道炎症,降低炎症性肠病的发病率。此外,有资料研究证明[30],Alistipes属数量减少可能引发Clostridium difficile感染。
表6 属水平各组间肠道菌群分析Table 6 Analysis of intestinal microbial flora among groups in genus level (±s)
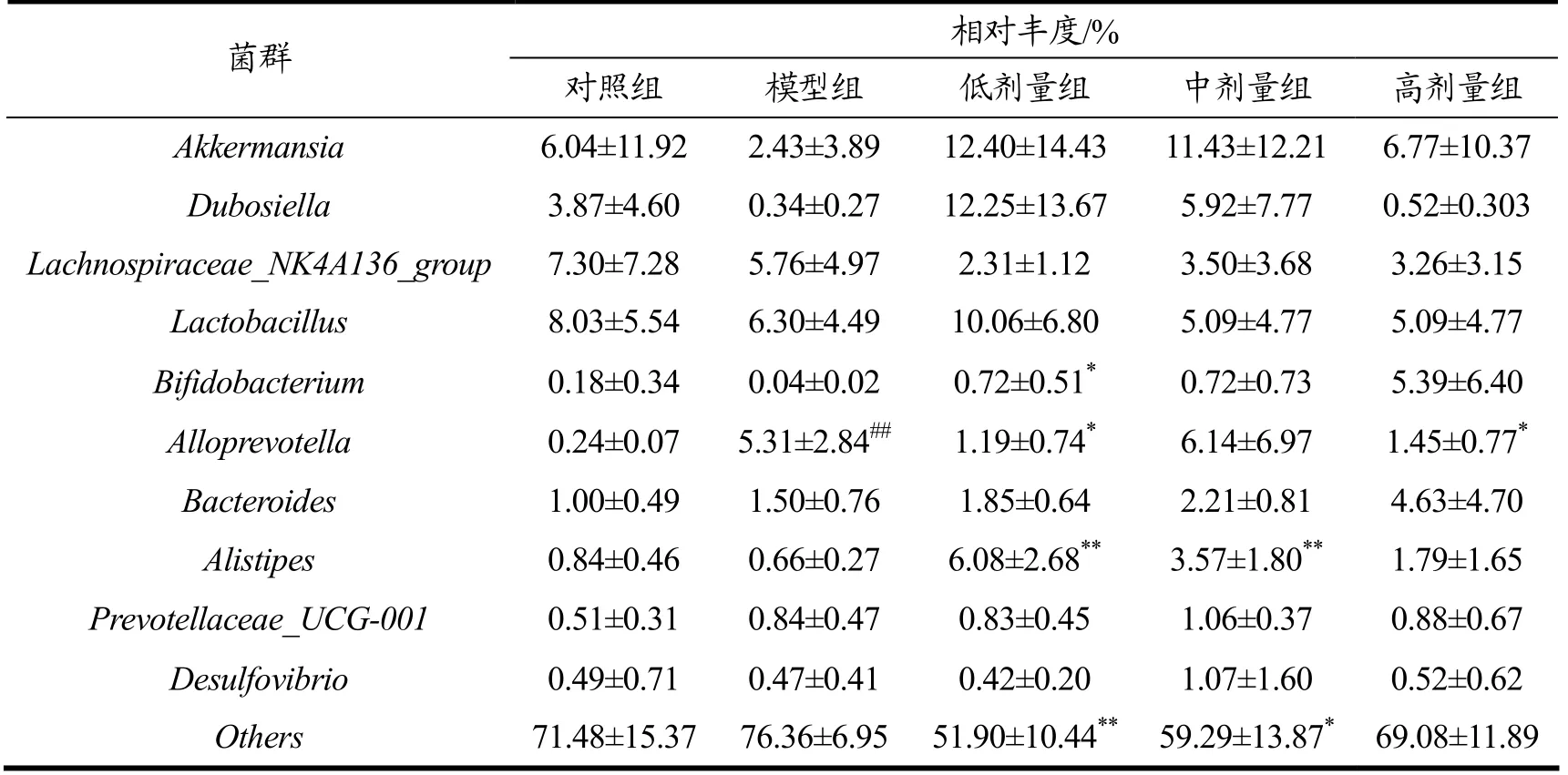
表6 属水平各组间肠道菌群分析Table 6 Analysis of intestinal microbial flora among groups in genus level (±s)
相对丰度/%菌群 对照组 模型组 低剂量组 中剂量组 高剂量组Akkermansia 6.04±11.92 2.43±3.89 12.40±14.43 11.43±12.21 6.77±10.37 Dubosiella 3.87±4.60 0.34±0.27 12.25±13.67 5.92±7.77 0.52±0.303 Lachnospiraceae_NK4A136_group 7.30±7.28 5.76±4.97 2.31±1.12 3.50±3.68 3.26±3.15 Lactobacillus 8.03±5.54 6.30±4.49 10.06±6.80 5.09±4.77 5.09±4.77 Bifidobacterium 0.18±0.34 0.04±0.02 0.72±0.51* 0.72±0.73 5.39±6.40 Alloprevotella 0.24±0.07 5.31±2.84## 1.19±0.74* 6.14±6.97 1.45±0.77*Bacteroides 1.00±0.49 1.50±0.76 1.85±0.64 2.21±0.81 4.63±4.70 Alistipes 0.84±0.46 0.66±0.27 6.08±2.68** 3.57±1.80** 1.79±1.65 Prevotellaceae_UCG-001 0.51±0.31 0.84±0.47 0.83±0.45 1.06±0.37 0.88±0.67 Desulfovibrio 0.49±0.71 0.47±0.41 0.42±0.20 1.07±1.60 0.52±0.62 Others 71.48±15.37 76.36±6.95 51.90±10.44** 59.29±13.87* 69.08±11.89

图6 灌胃前后小鼠肠道菌群在属水平上的丰度变化Fig.6 Changes in the abundance of intestinal microbiota at genus level before and after gavage
对各组物种进行差异分析,如图7所示,抗生素灌胃导致模型组有害菌拟普雷沃菌属(Alloprevotella)极显著增加(p<0.01),丹毒荚膜菌属(Erysipelatoclostridium)、库特氏菌属(Kurthia)显著增加(p<0.05),气味杆菌Odoribacter极显著降低(p<0.01)。
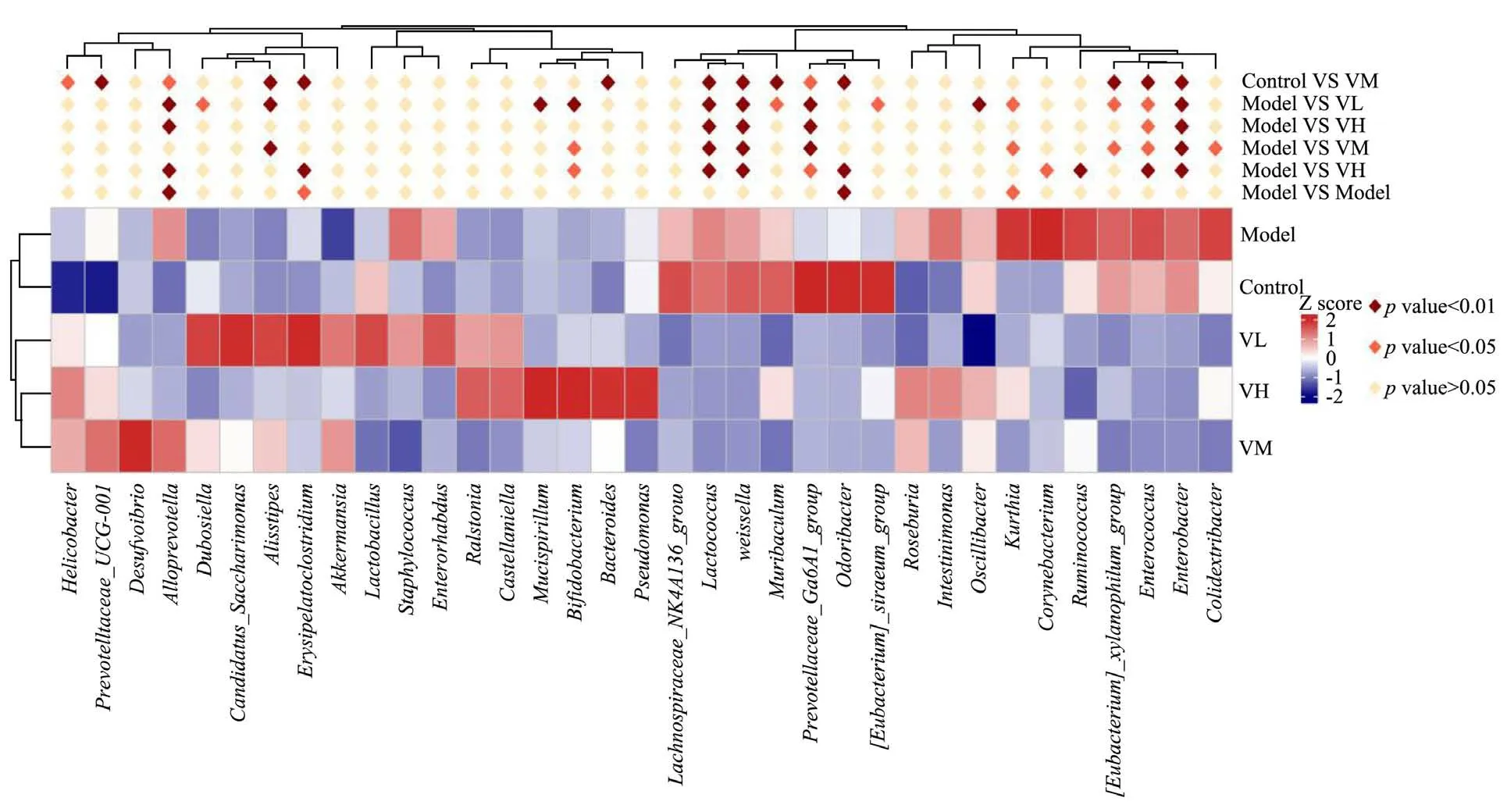
图7 差异物种相对丰度聚类热图Fig.7 Species relative abundance clustering heat map
乳双歧杆菌V9 灌胃后,低剂量组拟普雷沃菌属(Alloprevotella)、Mucispirillum、乳酸杆菌属、魏斯氏菌(Weissella)、(Prevotellaceae_Ga6A1_group)、Oscillibacter、Enterobacter极显著降低(p<0.01),Muribaculum、[Eubacterium]_siraeum_group、Kurthia、[Eubacterium]_xylanophilum_group、Enterococcus显著降低(p<0.05),Alidlipes、双歧杆菌Bifidobacterium极显著提高(p<0.01)。Dubosiella显著提高(p<0.05)。中剂量组乳酸杆菌属(Lactobacillus)、Weissella、(Prevotellaceae_Ga6A1_group)、(Enterobacter)极显著降低(p<0.01 )。Kurthia、[Eubacterium]_xylanophilum_group、Enterococcus、Colidextribacter显著降低(p<0.05),Alidlipes极显著提高(p<0.01),双歧杆菌显著提高(p<0.05)。高剂量组拟普雷沃菌属(Alloprevotella)、乳酸杆菌属、Weissella、Prevotellaceae_Ga6A1_group、Enterobacter极显著降低(p<0.01),Enterococcus显著降低(p<0.05)。
根据上述结果可知,头孢曲松钠处理后,有害菌拟普雷沃菌等致病菌的丰度增加,双歧杆菌和乳酸杆菌数量显著降低,使得肠道菌群严重失衡。研究资料表明,拟普雷沃菌属是临床上较常见的条件致病菌,常引起女性生殖道及口腔感染,与结缔组织的分解有关,其丰度的增加与有利于肠道健康和代谢内毒素的异常产生有关[31]。乳双歧杆菌V9 处理后拟普雷沃菌数量显著降低,说明乳双歧杆菌V9 能够抑制其生长。与表3粪便活菌计数结果一致,乳双歧杆菌V9 能够促进双歧杆菌等有益菌的生长,双歧杆菌、乳酸菌和疣微菌是肠道的重要生理菌群,能够降低肠道内环境的pH值,抑制有害菌的生长,具有抗氧化及提高机体免疫力的能力,与肥胖、糖尿病和过敏等各种疾病的发生密切相关,被认为是健康肠道的重要标志[32-34]。魏斯氏菌能够引起菌血症、脓肿、假体关节感染和感染性心内膜炎[35]。这说明乳双歧杆菌V9 在一定程度上促进了增加有益菌数量,抑制有害菌生长,从而对机体肠道菌群失调起到调节作用。
3 结论
综上所述,乳双歧杆菌V9 的干预使得头孢曲松钠导致的小鼠肠道炎症得到缓解,抗氧化能力恢复,以及肠道菌群有益菌双歧杆菌、疣微菌门丰度增加,并且抑制了有害菌拟普雷沃菌的增长,改善微生物群落。说明乳双歧杆菌V9 能够抑制炎症反应以及在一定程度上调节肠道菌群。
