不同益生菌对来曲唑诱导多囊卵巢综合征大鼠症状的改善作用
2022-12-14李新宇谢晨阳黄秋萍金斌董哲文钟萍宋家乐
李新宇,谢晨阳,黄秋萍,金斌,董哲文,钟萍,宋家乐,3*
(1.桂林医学院公共卫生学院,广西桂林 541101)(2.桂林医学院第二附属医院产科,广西桂林 541109)(3.广西卫生健康委员会全生命周期健康保健研究实验室,广西环境暴露组学与全生命周期健康重点实验室,广西桂林 541101)
多囊卵巢综合征(Polycystic Ovarian Syndrome,PCOS)是一种育龄期女性常见的内分泌紊乱疾病,其发病机制尚不明确,主要临床症状有高雄激素血症、多囊性卵巢、排卵障碍及卵巢纤维化等[1]。除生殖障碍与激素失衡外,PCOS 患者常伴有肥胖、胰岛素抵抗、血脂紊乱等代谢疾病[2]。目前,临床上常用胰岛素增敏剂对PCOS 进行治疗,但长期或过高剂量的使用会引起头痛、胃肠道不适等不良反应[3]。因此,寻找能有效治疗且副作用较小的方案是目前PCOS 疾病研究方向上的热点问题之一。
肠道菌群是正常定植于人体肠道的一类微生物的总称,可通过与宿主细胞的相互作用以及对营养物质的摄取和转化在不同程度上影响人体健康[4]。研究表明,肠道菌群失调与PCOS 之间存在密切联系[5]。临床研究发现,PCOS 患者的肠道菌群失调主要表现为α多样性下降,拟杆菌属增加和疣微菌门减少[6]。动物研究中也提示来曲唑诱导的PCOS 小鼠体内肠道菌群物种的多样性和丰富度明显减少[7]。此外,肠道菌群的紊乱将导致肠黏膜屏障功能受损,使机体免疫系统异常激活,并由此干扰胰岛素受体功能和性激素分泌,影响卵巢发育[8]。
益生菌作为肠道菌群的主要构成部分,是一类对宿主健康有益的活性微生物,其可以调节宿主肠道菌群比例,改善异常的性激素水平和糖脂代谢紊乱[9,10]。目前的研究提示,益生菌能够作为辅助手段来改善PCOS 的临床症状。连续服用12 周的益生菌补充剂(含嗜酸乳杆菌、罗伊氏乳杆菌、发酵乳杆菌和双歧杆菌)可以有效调节PCOS 患者体内激素和炎症指标的水平[11]。而Meta 分析也提示益生菌补充剂(含嗜酸乳杆菌、干酪乳杆菌、双歧杆菌等)可有效控制PCOS 患者的体质量和体质指数(Body Mass Index,BMI),并降低血糖、胰岛素(Insulin,INS)、甘油三酯(Triglyceride,TG)和睾酮(Testosterone,T)水平[12]。来曲唑作为一种芳香化酶抑制剂,可通过抑制雄激素向雌激素的转化导致高雄激素血症,引发类似PCOS 的症状[13]。因此,本研究以来曲唑诱导的PCOS 大鼠为模型,观察乳双歧杆菌、丁酸梭菌、植物乳杆菌三种益生菌对PCOS大鼠临床症状的改善作用并探讨作用机制,为益生菌应用于PCOS 的临床治疗提供实验依据。
1 材料与方法
1.1 材料与试剂
来曲唑(L833525,纯度大于98%),上海麦克林生化科技有限公司;植物乳杆菌(Lactiplantibacillus plantarum,SG1),本课题组自行分离保存菌株;乳双歧杆菌(Bifidobacterium lactis,HH-BA68),郑州和合生物工程技术有限公司;丁酸梭菌(Clostridium butyricum,GIM1.262),广东省微生物研究所菌种保藏中心;雌二醇(Estradiol,E2,MM-0575R1)、T(MM-0577R1)、黄体生成素(Luteinizing Hormone,LH,MM-0624R1)、卵泡刺激素(Follicle Stimulating Hormone,FSH,MM-70867R1)和INS(MM-0587R1)水平测定用ELISA 试剂盒,江苏酶免实业有限公司;总胆固醇(Total Cholesterol,TC,A111-1-1)、TG(A110-1-1)、低密度脂蛋白(Low-Density Lipoprotein Cholesterol,LDL-C,A113-1-1)、高密度脂蛋白(High-Density Lipoprotein Cholesterol,HDL-C,A112-1-1)、脂多糖(Lipopolysaccharide,LPS,H255)试剂盒,南京建成生物工程研究所;Masson 三色染色试剂盒(BP-DL021),南京森贝伽生物科技有限公司;BCA 蛋白浓度试剂盒(P0012)、5X SDS-PAGE 蛋白上样缓冲液(P0286-15 mL)、Smad4(AF1291)、Smad3(AF1501)、Phospho-Smad3(p-Smad3,AF1759)、Smad2(AF1300)、Phospho-Smad2(p-Smad2,AF2545)、GAPDH(AF1186)抗体,上海碧云天生物技术有限公司。
1.2 仪器与设备
FA2004 电子天平,上海舜宇恒平科学仪器有限公司;Eppendorf 5424R 型冷冻离心机,德国Eppendorf公司;Varioskan LUX 多功能酶标仪,美国Thermo Scientific 科技公司;Leica DM4B 正置显微镜,德国Leica 仪器有限公司;FluorChem M 超灵敏全自动化学发光成像分析系统,美国ProteinSimple 公司;KZ-II高速组织研磨仪,武汉塞维尔生物科技有限公司。
1.3 实验动物
雌性SD 大鼠(共35 只,6 周龄,体质量160~190 g),购于湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2016-0002,饲养于桂林医学院SPF级动物房,实验单位许可证号:SYXK(桂)2020-0005。所有大鼠均在标准环境内合笼饲养(每笼2~3 只),室温(22±1)℃,相对湿度60%,保持明暗周期(12 h/12 h)一致,自由摄食及清洁饮水。本研究经桂林医学院实验动物伦理委员会审查通过(GLMC201806003)。
1.4 益生菌培养及菌液制备
乳双歧杆菌和植物乳杆菌菌液依照李娜等[14]的方法,丁酸梭菌菌液依照亓秀晔等[15]的方法进行制备。将乳双歧杆菌、植物乳杆菌接种于MRS液体培养基中,丁酸梭菌接种于丁酸梭菌增殖培养基中,在厌氧环境下37 ℃培养24 h 后进行菌体计数。根据测定的活菌数将一定量的乳双歧杆菌、植物乳杆菌及丁酸梭菌重悬于生理盐水中各配置成浓度为1×109CFU/mL 的菌液[16]。
1.5 实验方法
1.5.1 动物实验方案
PCOS 大鼠模型建立参考He 等[17]的方法。总35只雌性大鼠经适应性喂养一周后,随机分成正常组、PCOS 组、PCOS+乳双歧杆菌组、PCOS+丁酸梭菌组、PCOS+植物乳杆菌组,每组7 只。正常组给予1wt%羧甲基纤维素钠(Sodium Carboxymethyl Cellulose,CMC)灌胃(1 mL/d),其余各组大鼠均给予来曲唑(每天1 mg/kg)-1wt% CMC 混悬液灌胃。同时,乳双歧杆菌组、丁酸梭菌组、植物乳杆菌组分别灌胃等量的相应活菌悬液(1 mL/d)。灌胃共持续28 d,其中乳双歧杆菌组、丁酸梭菌组、植物乳杆菌组每只大鼠益生菌灌胃总量为28×109CFU。整个实验期间,所有大鼠均自由摄食及饮水,并每3 天进行体质量监测。
1.5.2 大鼠动情周期检测
从实验干预的第10 天开始,对所有大鼠进行10 d的阴道涂片,以观察其动情周期规律。阴道涂片及巴氏染色法参考Cora 等的方法[18]。发情阶段的判断依据如下:动情前期以扁平上皮细胞为主;动情期以角质化细胞为主;动情期后期白细胞、角质化细胞、扁平上皮细胞3 种细胞比例相当;动情间期以白细胞为主。
1.5.3 血液及脏器的取材
干预结束后,各组大鼠禁食不禁水12 h。期间测量大鼠的体质量,以鼻尖至肛门的长度为体长,按公式(1)计算肥胖指标Lee’s 指数(记为E)[19];取尾静脉血检测空腹血糖(Fasting Plasma Glucose,FPG)。CO2麻醉处死大鼠后,腹主动脉取血,待血液凝固后迅速离心分离出血清,-80 ℃低温保存。大鼠置于冰上开腹,快速分离两侧卵巢以及内脏脂肪(包括肾周脂肪、腹部脂肪和子宫周脂肪),并对内脏脂肪进行称重。取一侧卵巢快速置于m=4%多聚甲醛固定,其余-80 ℃低温保存备用。

注:
m——大鼠体质量,g;
l——大鼠体长,cm。
1.5.4 卵巢组织病理学观察
将固定后的卵巢组织浸入石蜡包埋,连续切取4 μm 的石蜡切片进行Masson 染色,于显微镜下观察大鼠卵巢组织纤维化改变,其中细胞核、胶原纤维染色结果呈蓝色,胞浆、肌肉染色结果呈红色。另连续切取4 μm 的石蜡切片进行H&E 染色,于显微镜下观察大鼠卵巢组织病理改变,统计每张切片的囊性卵泡数、黄体数并拍照记录。
1.5.5 血清生化指标的检测
依照ELISA 试剂盒说明书要求检测大鼠血清中E2、T、LH、FSH 以及空腹胰岛素(Fasting Insulin,FINS)水平,并按公式(2)计算胰岛素抵抗指数(Homeostasis Model Assessment-Insulin Resistance,HOMA-IR)。

式中:
P——胰岛素抵抗指数HOMA-IR;
F1——空腹血糖FPG,mmol/L;
F2——空腹胰岛素水平FINS,mU/L。
1.5.6 血脂相关指标及血清LPS 水平的检测
依照ELISA 试剂盒说明书要求检测大鼠血清中TG、TC、LDL-C、HDL-C 及LPS 水平。
1.5.7 蛋白质印迹法检测卵巢组织中TGF-β/Smads 信号通路相关蛋白的表达水平
称取约30 mg 的卵巢组织,生理盐水清洗血污,按10:1 的比例加入蛋白质裂解液(含PMSF)提取卵巢总蛋白,于4 ℃,12 000 r/min 条件下离心10 min。收集上清液,采用BCA 法测定蛋白浓度。配制SDS-聚丙烯酰胺凝胶电泳胶(SDS-PAGE),加样进行电泳分离,待电泳完成后采用湿法转膜。转膜1 h 后,将NC 膜放入10wt%脱脂奶粉中封闭2 h,一抗孵育过夜。次日采用相应二抗孵育1 h 后,加入特超敏ECL 化学发光试剂,自动化学发光成像仪检测相关蛋白的表达情况。
1.6 数据处理与统计分析
采用SPSS 20.0 统计软件进行统计学分析,正态分布资料以均数±标准差(±s)显示,多组数据比较采用单因素方差分析,组间比较采用LSD 法,非正态分布资料采用秩和检验,检验水准α=0.05。
2 结果与讨论
2.1 不同益生菌干预对PCOS 大鼠动情周期的影响
如图1所示,正常组大鼠始终保持规律的动情周期,而PCOS 组大鼠的动情周期呈不规律变化。经乳双歧杆菌、丁酸梭菌和植物乳杆菌干预后,三组大鼠的动情周期逐渐恢复。上述结果提示,乳双歧杆菌、丁酸梭菌、植物乳杆菌均能纠正PCOS 大鼠不规律的动情周期,且植物乳杆菌的干预效果较好。

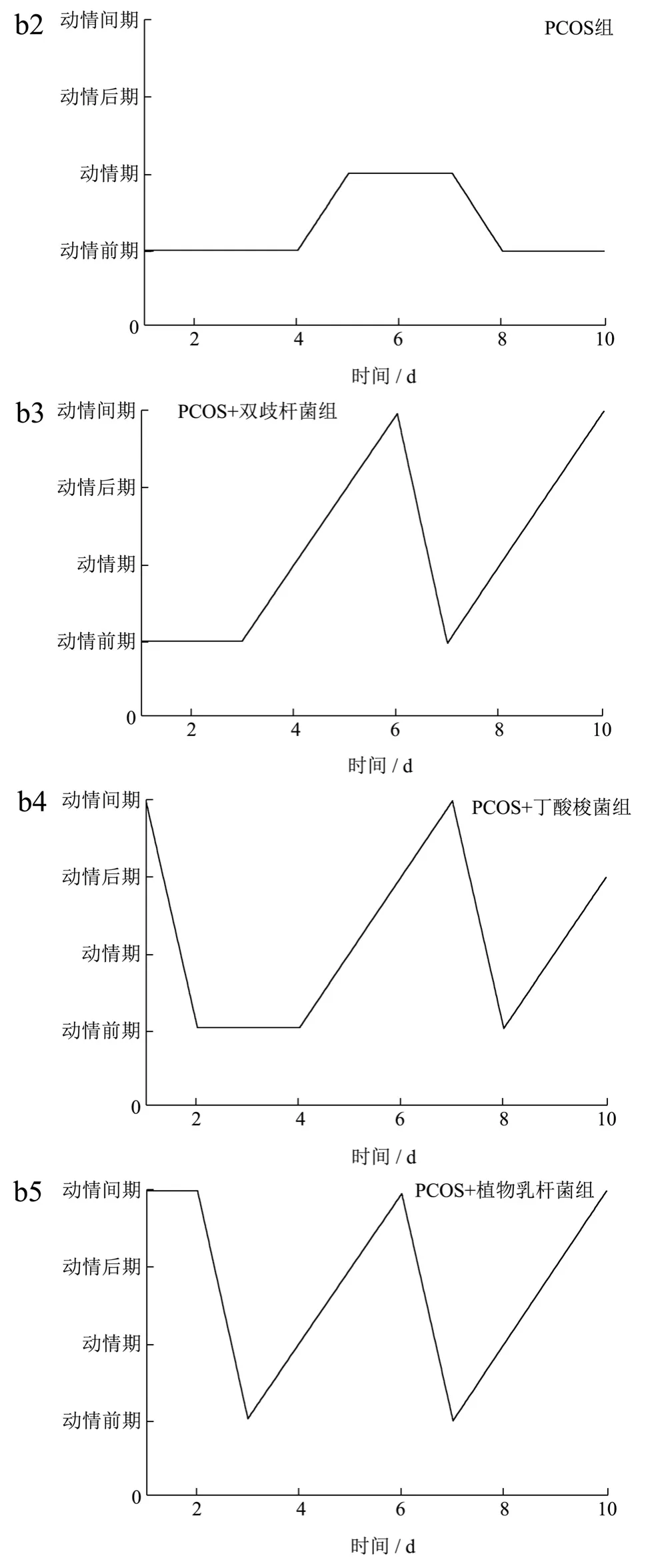
图1 大鼠动情周期中各阶段的阴道涂片(a)及不同益生菌干预对大鼠发情周期的影响(b)Fig.1 Vaginal smears at each stage of the rat estrus cycle (a) and the effect of different probiotics intervention on the rat estrus cycle (b)
2.2 不同益生菌干预对PCOS 大鼠体质量及Lee`s 指数的影响
如表1所示,造模前各组大鼠体质量之间无显著性差异(p>0.05)。干预结束后,PCOS 组大鼠体质量、内脏脂肪质量和Lee`s 指数均显著上升,与正常组相比差异具有统计学意义(p<0.05)。与PCOS 组相比,乳双歧杆菌组、丁酸梭菌组和植物乳杆菌组大鼠体质量显著下降7.91%、9.08%、9.91%(p<0.05);Lee`s 指数显著降低3.33%、2.81%、4.55%(p<0.05),内脏脂肪显著下降34.04%、23.76%、33.79%(p<0.05),各干预组之间差异无统计学意义(p>0.05)。以上结果提示,乳双歧杆菌、丁酸梭菌、植物乳杆菌可有效降低PCOS大鼠体质量,改善其肥胖程度。石刘婷等[20]对3 株植物乳杆菌进行豆乳发酵后发现植物乳杆菌LP5 的发酵豆乳能有效降低PCOS 大鼠的体质量,所得结论与本研究类似。
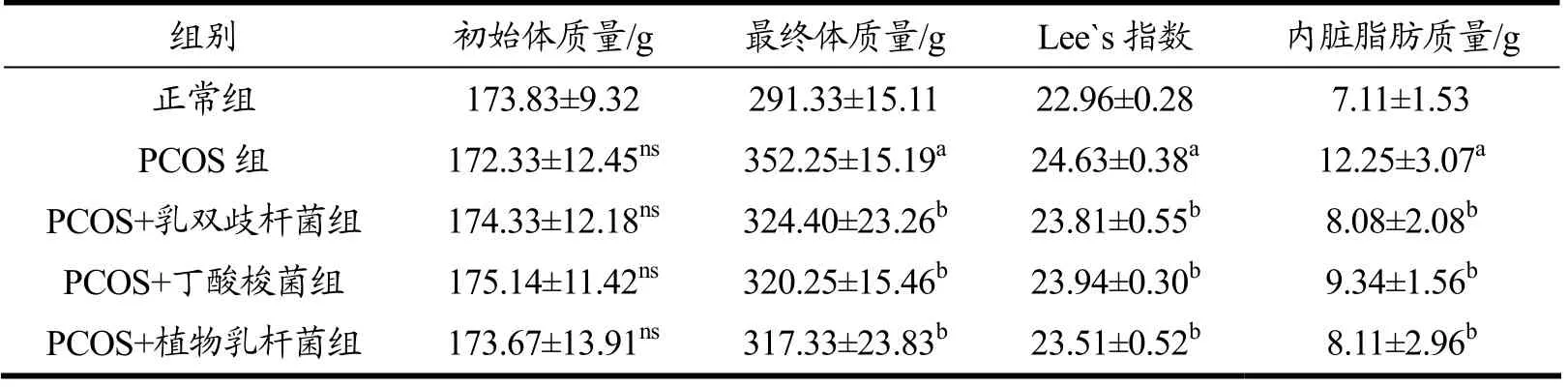
表1 不同益生菌干预对PCOS 大鼠体质量、Lee’s 指数以及内脏脂肪质量的影响Table 1 Effects of different probiotics intervention on body mass,Lee’s index and visceral fat mass in PCOS rats
2.3 不同益生菌干预对PCOS 大鼠卵巢组织学改变的影响
由图2a 所示,正常组大鼠卵巢表面较红润,而PCOS 组大鼠卵巢表面较苍白,体积明显增大。乳双歧杆菌组、丁酸梭菌组、植物乳杆菌组大鼠经干预后卵巢表面相比PCOS 组色泽偏红,体积减小。H&E 染色结果显示(图2b),与正常组相比,PCOS 组大鼠卵巢囊性卵泡数量增多,黄体数量明显减少。如表2所示,与PCOS 组相比,植物乳杆菌组大鼠卵巢黄体数量明显增多,且囊性扩张卵泡数量显著减少(p<0.05),而乳双歧杆菌组、丁酸梭菌组大鼠卵巢黄体数量并未有显著增加,但囊性卵泡数量明显减少(p<0.05)。以上结果表明,乳双歧杆菌、丁酸梭菌、植物乳杆菌均能有效改善PCOS 大鼠的卵巢组织损伤。
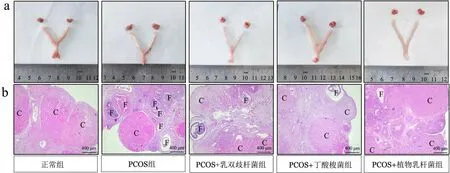
图2 不同益生菌干预对各组大鼠卵巢形态(a)及其组织变化(b)的影响Fig.2 Effect of different probiotics on ovarium morphological (a) and its histological observation (b) in PCOS rats

表2 不同益生菌干预对各组大鼠卵巢黄体数以及囊性卵泡数的影响Table 2 Effect of different probiotics on number of ovarian luteal bodies and cystic follicles in each group
2.4 不同益生菌干预对PCOS 大鼠卵巢纤维化的改善程度
卵巢组织的Masson 染色结果如图3所示。与正常组相比,PCOS 组大鼠卵泡膜周围呈高度纤维化,且胶原纤维由黄体膜颗粒渗入黄体颗粒细胞。与PCOS 组相比,乳双歧杆菌组、丁酸梭菌组、植物乳杆菌组大鼠卵巢纤维化程度均有明显改善。结果提示,乳双歧杆菌、丁酸梭菌、植物乳杆菌均能改善PCOS 大鼠的卵巢纤维化症状。

图3 不同益生菌干预对PCOS 大鼠卵巢纤维化程度的影响Fig.3 Effect of different probiotics on the degree of ovarian fibrosis in PCOS rats
2.5 不同益生菌干预后各组大鼠血清性激素水平的变化
高雄激素血症是PCOS 重要的病理特征之一,过高的雄激素水平可加剧性激素分泌紊乱,造成排卵障碍[1]。正常情况下,LH 与卵泡膜细胞上的LH 受体结合生成T,同时FSH 可激活颗粒细胞中芳香化酶的活性致使T 进一步转化为E2。而PCOS 的卵巢病变可导致下丘脑-垂体-卵巢轴(HPO)功能发生异常,刺激垂体生成更多的LH并抑制FSH 的分泌,造成T 和LH/FSH 比值升高[21]。此外,血清中异常升高的胰岛素也可与胰岛素样生长因子共同作用于卵泡膜细胞,造成体内T 的过度生成[22]。研究发现,脑肠介质如胃饥饿素(Ghrelin)、酪酪肽(Peptide Tyrosine Tyrosine,PYY)和生殖生理的内分泌调节之间存在相互作用[23]。Liu 等[24]发现,PCOS 患者Ghrelin 和PYY 水平显著降低,且与T 呈负相关。益生菌作为一种肠道微生态调节剂,可通过调节肠道菌群结构影响Ghrelin 和PYY 的分泌,并由此参与脑-肠互动,从而降低异常升高的LH 和T 水平[25-27]。如表3所示,PCOS 组大鼠血清T、LH 和LH/FSH 比值较正常组显著升高(p<0.05);E2 和FSH 水平显著降低(p<0.05),这与Kafili 等[28]的研究结果一致。与PCOS 组相比,乳双歧杆菌组、丁酸梭菌组、植物乳杆菌组大鼠血清T 水平分别下降25.87%、30.11%、38.29%且具有显著性差异(p<0.05);LH 水平分别下降25.26%、24.42%、31.08%(p<0.05);LH/FSH 比值分别下降25.45%、24.24%、23.64%且具有显著性差异(p<0.05),其中以植物乳杆菌的干预效果最好。此外,植物乳杆菌能显著升高PCOS 大鼠血清中的E2、FSH 水平分别至49.94 ng/L、18.73 IU/L,丁酸梭菌能显著升高FSH 水平至17.77 IU/L(p<0.05)。上述结果提示,乳双歧杆菌组、丁酸梭菌组、植物乳杆菌均能有效调节PCOS 大鼠血清性激素水平。He 等[17]的研究结果也提示,植物乳杆菌HL2 能显著下调PCOS 大鼠体内LH、FSH 和T 水平,这与本研究的结果相一致。

表3 不同益生菌干预对各组大鼠血清激素水平的影响Table 3 Effect of different probiotics on serum levels of sex hormone in PCOS rats
2.6 不同益生菌干预对各组大鼠空腹血糖、胰岛素及HOMA-IR 的变化
胰岛素抵抗(Insulin Resistance,IR)同样也是PCOS的主要病理生理事件之一[21],持续的IR 状态会加重PCOS 的病理进程,并引起糖耐量异常,进而发展为糖尿病和心血管疾病[29,30]。研究发现,肠道菌群失调可导致肠道内LPS 的大量生成,并通过破坏肠黏膜屏障升高体循环中的LPS,进而引发代谢内毒素血症,最终导致慢性炎症反应和IR 的发生[8,31]。由表4可知,相比正常组,PCOS 组大鼠血清INS、LPS 水平和HOMA-IR 指数显著上升23.82%、66.9%和22.18%(p<0.05),而血糖水平与正常组未有较大差异,其原因可能是PCOS 大鼠通过代偿性分泌胰岛素来维持血糖水平。与PCOS 组相比,乳双歧杆菌组、丁酸梭菌组、植物乳杆菌组大鼠血清INS 水平分别显著下降20.01%、26.22%、14.24%,LPS 水平分别下降72.03%、58.35%、62.78%且具有显著性差异,HOMA-IR 指数分别下降12.57%、24.58%、18.99%且具有显著性差异(p<0.05),其中INS、HOMA-IR 以丁酸梭菌的干预效果最好,LPS 水平以乳双歧杆菌干预效果最好。各干预组之间INS、LPS 和HOMA-IR 均无显著性差异。上述结果提示益生菌可能通过调节肠道菌群结构降低血清LPS 水平,进而缓解全身炎症反应,达到改善IR 的目的。Ahmadi 等[32]发现,服用12 周的益生菌补充剂可显著降低PCOS 患者血清FPG、INS 水平和HOMA-IR 指数,改善其代谢水平。同时,也有研究指出而给予婴儿乳双歧杆菌及酪酸梭菌则可有效降低肥胖小鼠体内LPS 水平[16]。陈烨等[33]的研究也发现,在给予PCOS 患者12 周的双歧杆菌三联活菌片(含乳双歧杆菌、嗜酸乳杆菌,粪肠球菌)治疗后,患者INS 水平和HOMA-IR 均得到改善,这与本研究的结果相一致。

表4 不同益生菌干预对各组大鼠空腹血糖、胰岛素及HOMA-IR 的变化Table 4 Effect of different probiotics on serum levels of FPG,INS and HOMA-IR in PCOS rats
2.7 益生菌干预对PCOS 大鼠血清脂代谢水平的影响
脂代谢异常作为PCOS 患者体内常见的代谢紊乱之一,主要以血清中TC、TG 及LDL-C 水平升高,HDL-C 水平降低为特征[34]。研究发现,肠道内厚壁菌门数量的增加和拟杆菌门数量的减少可增加饮食中能量的获取[35]。此外,肠道菌群失调可通过内毒素血症诱发慢性炎性反应,导致血脂紊乱进一步加重[36]。由表5可知,与正常组相比,PCOS 组大鼠血清TG、TC、LDL-C 水平显著升高(p<0.05),HDL-C 水平显著降低(p<0.05)。相比PCOS 组,乳双歧杆菌组、丁酸梭菌组、植物乳杆菌组大鼠血清TG 水平分别显著降低42.72%、33.01%、31.06%;TC 水平分别降低39.45%、38.54%、41.67%且具有显著性差异;LDL-C 水平分别降低53.67%、51.22%、49.24%且具有显著性差异(p<0.05),其中以乳双歧杆菌的干预效果最好。此外,乳双歧杆菌组HDL-C 水平较PCOS 组显著下降(p<0.05)。乳双歧杆菌组、丁酸梭菌组和植物乳杆菌组之间TG、TC、LDL-C、HDL-C 均无显著性差异(p>0.05)。方圆圆等[16]的研究提示,婴儿乳双歧杆菌及酪酸梭菌可有效降低肥胖小鼠体内TG、TC 和LDL-C 水平,同时升高HDL-C 水平,这与本研究的结果相一致。因此,可推测益生菌可能通过调节肠道菌群结构减少摄入能量并改善全身炎症状态,从而达到改善血脂紊乱的目的。

表5 不同益生菌干预对各组大鼠血脂水平的影响(mmol/L)Table 5 Effect of different probiotics on serum levels of lipid in PCOS rats (mmol/L)
2.8 不同益生菌对PCOS 大鼠卵巢纤维化相关因子蛋白表达影响
卵巢纤维化是卵巢功能障碍的重要病理因素之一,可导致机体排卵障碍,激素紊乱甚至功能衰竭,其特征主要为白膜增厚和间质结缔组织增厚[37]。TGF-β1/Smads 信号通路已被证实在PCOS 卵巢纤维化中具有重要作用[38]。TGF-β1 首先与TGF-βⅡ型受体(TGF-βR2)结合激活TGF-βR1,活化的TGF-βR1 在细胞内磷酸化Smad2 和Smad3,随后磷酸化的Smad2、Smad3 与未磷酸化的Smad4 形成复合物进入细胞核[39]。TGF-β1 过度表达时,Smad2-Smad3-Smad4 复合物于细胞核大量积累,并引起细胞外基质(Extracellular Matrix,ECM)的大量沉积,进而引发器官纤维化[40]。为进一步探究三种益生菌对PCOS 大鼠卵巢纤维化的影响机制,检测了Smad4、p-Smad3、p-Smad2 在卵巢中的表达。
由图4可知,与正常组相比,PCOS 组大鼠卵巢中Smad4、p-Smad3、p-Smad2 蛋白表达水平均有显著上升(p<0.05)。与PCOS 组相比,乳双歧杆菌组大鼠卵巢组织中Smad4、p-Smad3、p-Smad2 水平分别下降52.89%、65.31%、77.42%(p<0.05);丁酸梭菌组大鼠卵巢组织中Smad4、p-Smad3、p-Smad2 水平分别下降29.14%、65.82%、52.86%(p<0.05);植物乳杆组大鼠卵巢组织中Smad4、p-Smad3、p-Smad2 水平分别下降69.80%、78.57%、56.96%(p<0.05)。以上结果提示,乳双歧杆菌、丁酸梭菌、植物乳杆菌均能显著下调PCOS 大鼠卵巢组织中Smad4、p-Smad3、p-Smad2的表达水平。Zhang 等[41]的研究发现,干酪乳杆菌可通过降低肝纤维化小鼠肝脏组织中p-Smad3、Smad4 的表达水平改善肝纤维化,这提示益生菌可通过抑制TGF-β1/smads 信号通路阻止卵巢纤维化的发生。
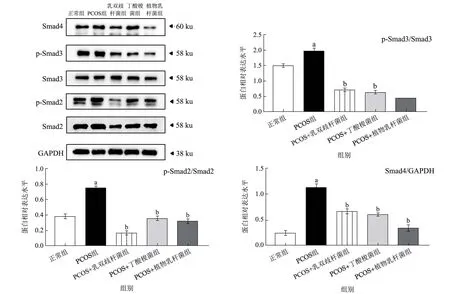
图4 不同益生菌对PCOS 大鼠卵巢纤维化相关因子蛋白表达影响Fig.4 Effects of different probiotics on the protein expression of ovarian fibrosis-related factors in PCOS rats
3 结论
综上所述,乳双歧杆菌、丁酸梭菌、植物乳杆菌均可一定程度上改善来曲唑诱导PCOS 大鼠的症状,且三种益生菌对于PCOS 大鼠各项指标的改善程度不一,其中乳双歧杆菌在调节脂代谢水平和方面具有优势,丁酸梭菌在改善IR 方面具有优势,植物乳杆菌在调节血清性激素水平方面具有优势。本研究为益生菌用于PCOS 的辅助治疗提供了一定研究基础。然而,益生菌改善PCOS 大鼠症状的具体机制尚未得到验证,后续有待完善相关实验进一步讨论。
