Marc-145细胞PKR基因遗传分析与表达
2022-12-07郭广君沈志强肖跃强
管 宇,杨 慧,于 雪,郭广君,唐 娜,魏 凤,沈志强,肖跃强*
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.山东绿都生物科技有限公司,山东滨州 256600)
蛋白激酶R(protein kinase R,PKR),又称为干扰素诱导的双链RNA激活的蛋白激酶(interferon-induced,double-stranded(ds)RNA-activated kinase)、真核翻译起始因子2α(alpha subunit of the eukaryotic initiation factore,eIF2α)激酶2(EIF2AK2),由EIF2AK2基因编码,是一种丝氨酸-苏氨酸激酶,能够被细胞、病毒的双链RNA(dsRNA)或合成类似物(如poly I:C)激活,在宿主抗病毒防御过程中发挥重要作用[1-3]。PKR在组织细胞中呈基础水平表达,并由Ⅰ型和Ⅲ型干扰素(interferon,IFN)诱导,正常情况下,PKR维持为非活性单体,其抗病毒活性主要通过单体PKR与病毒复制过程中产生的双链RNA(double-stranded RNA,dsRNA)结合,形成二聚体并发生自身磷酸化,之后催化其底物-eIF2α磷酸化[4-5],导致病毒蛋白的合成受到抑制,从而产生抗病毒作用。
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染引起以母猪繁殖障碍和各日龄猪呼吸疾病为特征的猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)[6],其感染的主要靶细胞是猪肺泡巨噬细胞(porcine alveolar macrophages,PAMs)[7]。作者前期开展PRRSV体外感染PAMs研究表明,PRRSV及其失活病毒粒子感染PAMs早期阶段均强烈抑制细胞PKR本底磷酸化,以及poly(I:C)诱导的磷酸化[8]。因此,在早期感染阶段PKR活化下调与PRRSV避免抗病毒反应启动复制相关。
Marc-145细胞是肾脏上皮样细胞,从MA-104细胞克隆而来[9],后者来源于非洲绿猴(Cercopithecusaethiops)。Marc-145细胞是目前支持PRRSV体外复制增殖的重要细胞系,但细胞PKR在病毒增殖过程中发挥的作用尚不清晰,因此,本研究克隆该细胞系的PKR基因,构建其融合表达载体,并进行瞬时表达研究,为进一步开展PRRSV与细胞抗病毒固有免疫互作机制研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞与载体 大肠埃希氏菌感受态细胞DH5α、Marc-145细胞、HEK293细胞、pEGFP-C1/N1载体,由山东省滨州畜牧兽医研究院重点实验室保存。
1.1.2 主要试剂 TRIzol试剂、Lipo2000、SuperScript Ⅲ反转录酶、RiboLock RNase Inhibitor、PageRulerTM预染蛋白Marker、GeneJET Plasmid小量制备试剂盒、GeneJET Gel Extraction试剂盒、GFP Tag mAb(GF28R)、HRP标记Goat anti-Mouse IgG等,Thermo Scientific公司产品;DNA标准DL15 000与DL2 000、pMD18-T载体,TaKaRa公司产品;各种限制性内切酶、T4 DNA Ligase、Q5超保真DNA聚合酶,NEB公司产品。
1.1.3 主要仪器 BB150 CO2培养箱,Thermo Scientific公司产品;DYY-8C电泳仪,北京六一生物科技有限公司产品;Trans-Blot®SD Cell半干转印槽,Bio-Rad公司产品;ChanmpChemin凝胶成像/化学发光仪,北京赛智创业科技有限公司产品;Airstream®AC2型二级生物安全柜,ESCO公司产品;CKX41倒置荧光显微镜,Olympus公司产品。
1.2 方法
1.2.1 引物设计与合成 Marc-145细胞克隆自MA-104细胞,后者系源于非洲绿猴(Cercopithecusaethiops)肾细胞,根据NCBI公布的非洲绿猴PKR基因序列(GenBank登录号:EU733254)设计引物,并添加酶切位点;设计引物送上海生工生物工程技术服务有限公司合成,具体序列见表1。
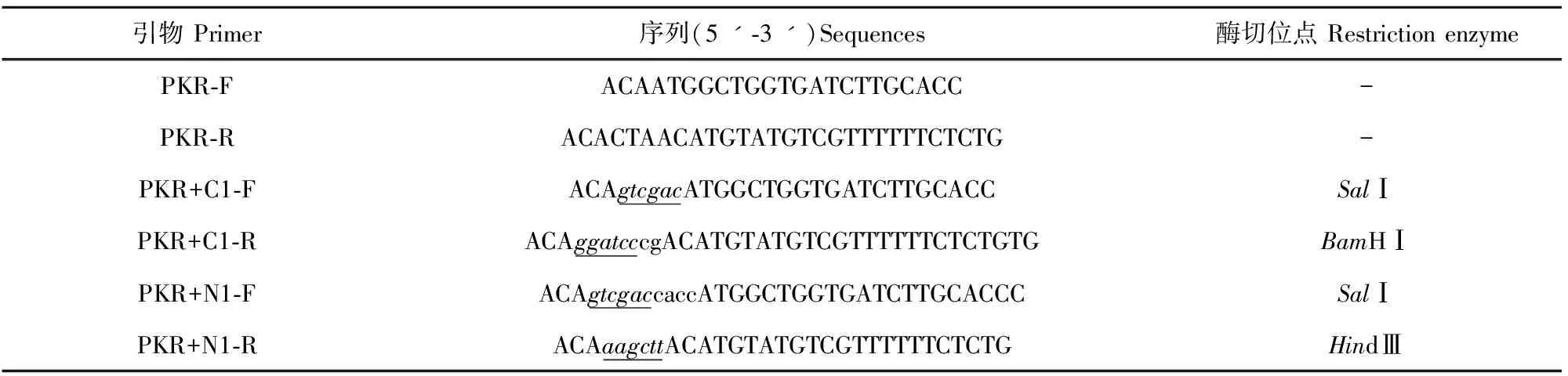
表1 PKR基因扩增引物
1.2.2 细胞总RNA提取与cDNA合成 培养Marc-145细胞,TRIzol试剂裂解细胞提取总RNA,DNA/RNAase Free水溶解后进行反转录,75 ℃水浴5 min,冰浴致冷,根据SuperScript Ⅲ反转录酶说明书合成cDNA,加入反转录酶buffer、dNTP、Oligo(dT)18、RiboLock RNase Inhibitor、SuperScript Ⅲ反转录酶,然后50 ℃作用60 min合成cDNA,95 ℃灭活5 min。
1.2.3 蛋白激酶R基因克隆与序列分析 使用Q5超保真聚合酶扩增PKR基因,PCR反应体系50 μL:5×Q5超保真DNA聚合酶buffer 10 μL、10 μmol/L浓度上游与下游引物各1 μL、2.5 mmol/L浓度dNTP 2 μL、cDNA 2 μL,Q5超保真DNA聚合酶0.5 μL(1 U),超纯水补足;扩增条件为:95 ℃ 5 min;94 ℃ 30 s,57 ℃ 40 s,72 ℃ 120 s,共30个循环;10 g/L琼脂糖凝胶电泳检测。回收PCR产物,3′端加“A”后与pMD18-T载体连接,转化大肠埃希氏菌感受态细胞DH5α,经氨苄青霉素抗性筛选、菌液PCR鉴定获得阳性克隆,提取质粒后送上海生工生物工程技术服务有限公司测序,并进行序列分析。
1.2.4 蛋白激酶R融合EGFP表达载体构与瞬时表达 用PKR+C1-F/R、PKR+N1-F/R引物对分别进行PCR扩增,按照DNA胶回收试剂盒回收PCR产物,SalⅠ+BamHⅠ分别双酶切引物PKR+C1-F/R扩增产物与载体pEGFP-C1,回收后进行连接;SalⅠ+HindⅢ双酶切引物PKR+N1-F/R扩增产物,XhoⅠ+HindⅢ双酶切载体pEGFP-N1,回收后进行连接;将连接混合物转化大肠埃希氏菌感受态细胞DH5α,卡那霉素抗性筛选阳性克隆并测序验证;将构建正确的质粒转染12孔板培养HEK293的细胞,剂量为1 μg/孔,具体转染方法根据Lipo 2 000转染试剂说明书进行,通过荧光显微镜观察、Western blot检测EGFP标签蛋白表达,从而筛选能够融合表达的重组质粒。
2 结果
2.1 Marc-145细胞蛋白激酶R基因扩增结果
取PCR产物进行电泳,结果表明,在约为1.6 kb位置有1条特异性PCR产物,对其进行加“A”回收,克隆至T载体,测序结果表明,特异性扩增产物为PKR目的基因,大小为1 653 bp,推导编码550个氨基酸残基。PCR扩增产物与菌液PCR产物电泳结果见图1。

M.DNA 标准DL 2 000;1.PKR基因;2.阴性对照;3~7.pMD18-T-PKR阳性克隆
2.2 蛋白激酶R基因编码核苷酸序列分析
将获得的Marc-145细胞PKR基因核苷酸序列与已公布豚鼠(Caviaporcellus)、家鼠(Musmusculus)、家兔(Oryctolaguscuniculus)、野猪(Susscrofa)、人(Homosapiens)、猕猴(Macacamulatta)、川金丝猴(Rhinopithecusroxellana)、绿猴(Chlorocebussabaeus)、非洲绿猴(Cercopithecusaethiops)等进行比对分析,遗传进化树与序列同源性分别见图2和图3。可见序列同源性在72.2%~99.8%之间,在5种灵长类物种中,与人同源性最低,为92.5%;与其供体动物物种非洲绿猴同源性均最高,与绿猴同源性高达99.6%,与其他4种哺乳动物同源性在72.2%~77.7%之间。

图2 PKR核苷酸序列遗传进化树

图3 PKR核苷酸序列同源性分析
2.3 蛋白激酶R基因编码氨基酸序列分析
将获得的Marc-145细胞PKR基因推导编码的氨基酸序列与已公布的上述各物种进行比对分析,遗传进化树与序列同源性分别见图4和图5。可见序列同源性在55.4%~99.5%之间,与豚鼠及其供体物种非洲绿猴同源性分别最低、最高,与人同源性为83.5%。同时,如图6箭头和方框区域所示,PKR △6除豚鼠、家兔各1个氨基酸位点差异,其他6种均为LFIQME基序,PKR 296K高度保守,△6删除或者296K突变为R均能导致PKR失活[10-12];446T与451T磷酸化是PKR激活发挥作用的重要标记[4-5],但灵长类动物与其他几种哺乳动物在二者附近基序均存在遗传差异。

图4 PKR氨基酸序列遗传进化树
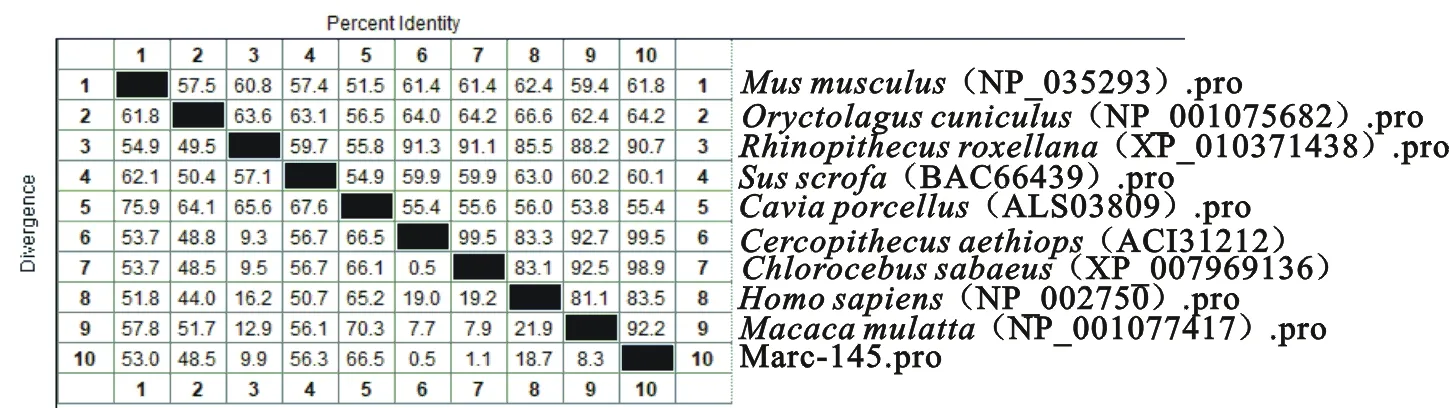
图5 PKR氨基酸序列同源性分析

图6 不同种属PKR氨基酸序列差异性比对
2.4 蛋白R重组融合EGFP瞬时表达荧光观察
将PCR鉴定正确的阳性克隆提取重组质粒,测序结果证明获得了EGFP-PKR融合表达的重组质粒pC1/N1-PKR,转染后24 h荧光显微镜观察EGFP表达与否,验证PKR能否融合表达,观察结果见图7。结果表明pC1-PKR转染后观察到绿色荧光蛋白,说明PKR成功获得融合表达,而pN1-PKR转染后未能观察到荧光蛋白表达。

A.pEGFP-C1对照;B.pC1-PKR转染;C.pN1-PKR转染
2.5 蛋白激酶R重组融合EGFP瞬时表达的Western blot检测
瞬时表达后收获样品,以GFP Tag mAb(GF28R)为一抗,HRP标记羊抗鼠IgG为二抗进行Western blot检测,结果见图8,检测结果与荧光显微镜观察结果一致,最终表明pC1-PKR成功获得表达,而pN1-PKR未能获得表达,因此选择pC1-PKR开展后续相关研究。

M.蛋白分子质量标准;1.细胞对照;2、3.pC1-PKR;4、5.pN1-PKR;6.pEGFP-C1
3 讨论
PKR被认为是IFN诱导的抗病毒作用主要的效应因子之一,可以抑制多种病毒在细胞内的复制,它在调节细胞增殖和分化、诱导细胞凋亡和信号转导等方面也发挥重要作用[13]。当病毒侵入感染细胞,在复制或转录过程中产生dsRNA,单体PKR与之结合后便形成二聚体,自我激活并催化自身磷酸化,磷酸化后的PKR催化其底物eIF2α的磷酸化,最终导致病毒蛋白合成受到抑制,从而产生抗病毒活性[14-15]。但有些病毒为了逃逸宿主细胞的抗病毒效应,采取多种策略避免PKR的抗病毒活性,而这些策略的发挥一般依赖于病毒基因组非编码区转录产物或者编码的蛋白。非编码区转录产物一般与PKR直接结合,阻碍PKR自身磷酸化[16-18];病毒编码蛋白发挥作用机制具有多样性[3],或是直接结合PKR,以阻断与dsRNA的结合,或是作为PKR的伪底物,竞争阻止eIF2α磷酸化,或是作为PKR的拮抗剂阻断eIF2α的磷酸化,或是使PKR下游效应分子eIF2α脱磷酸化,或是同时抑制PKR与eIF2α的磷酸化,甚至是降解PKR等。作者前期开展PRRSV体外感染PAMs研究表明,PRRSV可以强烈抑制PKR磷酸化,其底物eIF2α的磷酸化水平相应受到抑制,说明PRRSV可能通过这种途径达到促进自身增殖的目的。PAMs是PRRSV感染的天然宿主细胞,但Marc-145细胞是病毒体外增殖依赖的重要传代细胞系,由于细胞动物来源、原代细胞和传代细胞差异等,PRRSV在Marc-145细胞复制增殖时PKR所起的作用尚不得而知,对其开展相关研究非常必要。
因此,本研究克隆了Macr-145细胞PKR基因,进行了遗传进化分析,由于该细胞系来源于MA-104细胞,而后者来源于非洲绿猴(Cercopithecusaethiops),因此,与非洲绿猴PKR基因同源性最高,核苷酸、氨基酸同源性分别为99.8%和99.5%,氨基酸残基发生I23V、S178P、I409L共3个位点突变;与绿猴(Chlorocebussabaeus)核苷酸、氨基酸同源性分别高达99.6%和98.9%,与猕猴、川金丝猴同源性较高,但依次降低,与人核苷酸、氨基酸同源性进一步降低至92.5%和83.5%,与其他4种哺乳动物同源性较低,尤其是野猪,仅分别为76.1%和60.1%。PRRSV既可以在Marc-145细胞增殖,也可以在猪体内细胞如PAMs、单核细胞等增殖,而二者PKR序列差异较大,因此,推测PKR在病毒复制增殖过程发所发挥的作用不尽相同,但需要进一步验证。通过分析发现,PKR △6 LFIQME基序、PKR 296K以及446T与451T磷酸化位点均高度保守,这些保证了PKR作为抗重要病毒因子的特性。同时,通过氨基酸序列比较,发现与所参考物种相比,271K是Marc-145细胞与其供体物种非洲绿猴所特有的,其他物种除了豚鼠是V,均为E,这一氨基酸位点对于其功能是否产生影响?与PRRSV感染或者复制是否有关联?需要开展相关研究阐明。
综上所述,本研究成功克隆了Marc-145细胞PKR基因,对其遗传进化及同源性进行了分析与比较,并进行了融合表达,为进一步开展其与PRRSV互作机制研究奠定了基础。
