抗中性粒细胞胞浆抗体(ANCA)相关血管炎性中耳炎的诊治分析*
2022-11-18张志坚任杰曹永茂廖华杨希林徐勇汪雷王文静华清泉
张志坚 任杰 曹永茂 廖华 杨希林 徐勇 汪雷 王文静 华清泉
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies,ANCA)是一种以中性粒细胞和单核细胞胞浆成分为靶抗原的自身抗体。ANCA相关性血管炎(ANCA-associated vasculitis,AAV)是指主要累及小血管的一种以血管壁的炎症和纤维素样坏死为病理特征的自身免疫性疾病,可以损伤全身多系统,其中肾脏和肺脏最常见,还常累及耳、鼻和咽喉,该病病情凶险,甚至危及生命[1]。因该病临床表现复杂多样,早期诊断很困难,极易漏诊。日本耳科学会基于较大样本数的临床研究结果,最近将ANCA相关性血管炎导致的中耳疾病定义为ANCA相关血管炎性中耳炎[otitis media with antineutrophil cytoplasmic antibody (ANCA)-associated vasculitis,OMAAV],并提出了诊断标准[2]。武汉大学人民医院耳鼻咽喉头颈外科近年诊治一例以分泌性中耳炎为首发症状的AAV患者,效果良好,本文通过分析该例患者及近年国内文献报告的以分泌性中耳炎为首发症状的AAV病例的临床资料[3-7],提出OMAAV的诊断流程,便于临床及时诊断,以期减少该病的误诊漏诊,改善患者的预后。
1 资料与方法
1.1本文病例临床资料 本研究经治患者(简称“本例”),女,73岁,因“双耳听力下降6个月、右耳痛半月、右侧面瘫3天”于2020年11月17日入院。6个月前患者无明显诱因出现双耳听力下降,当地医院以“分泌性中耳炎”行双侧鼓膜切开置管术,术后听力较前稍提高,但双耳持续溢液。4个月前突发左耳痛并左侧周围性面瘫,在当地医院治疗8天后面瘫痊愈,耳痛好转。2个月前左耳疼痛加剧再发左侧周围性面瘫,至当地医院再次住院治疗后左面瘫痊愈耳痛稍好转。半月前出现右耳痛,3天前右侧周围性面瘫。入院专科查体:双侧外耳道通畅,双耳置入的中耳通气引流管通畅,可见清亮液体持续流出;右侧额纹变浅,右眼上睑下垂、闭合不全,右鼻唇沟变浅,嘴角向左歪斜,张嘴时明显,鼓腮时右嘴角闭合不全,右侧周围性面瘫(H-B评分四级)。
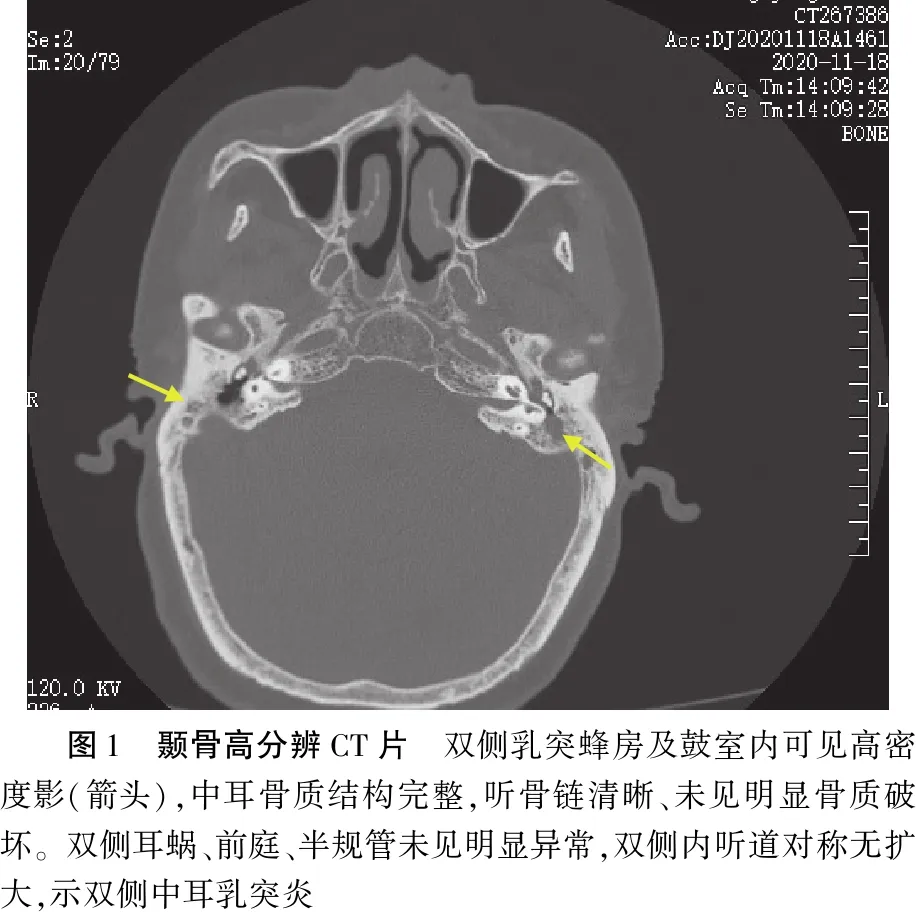
入院时听力学相关检查:双侧鼓室导抗图B型;0.5~4 kHz气导纯音平均听阈右耳60 dB HL,骨导为44 dB HL,气骨导差为16 dB;左耳气导平均值为55 dB HL,骨导39 dB HL,气骨导差为16 dB。颞骨薄层CT示外耳道通畅,双侧乳突蜂房及鼓室内可见高密度影,中耳骨质结构完整,听骨链清晰、未见明显骨质破坏。双侧耳蜗、前庭、半规管未见明显异常,双侧内听道对称无扩大,双侧中耳乳突炎(图1)。头颅及中耳MRI平扫加增强DWI检查示:双侧放射冠及额叶腔隙性脑梗,脑萎缩,双侧中耳乳突炎,DWI未见异常,增强未见脑实质及脑膜强化征象,未发现肿瘤性病变(图2)。胸部CT:双肺纹理增强,稍显紊乱,部分支气管壁增厚,肺门及纵膈未见明确增大淋巴结,胸膜腔未见积液,右侧胸膜增厚,肋骨未见明确异常。

常规生化检查无明显异常。免疫相关血清学结果示:抗核抗体1∶100(较正常升高),抗中性粒细胞胞浆抗体(ANCA)阳性,抗中性粒细胞胞浆抗体胞浆型(c-ANCA)阴性,抗中性粒细胞胞浆抗体核周型(p-ANCA)阳性,抗髓过氧化物酶(MPO-ANCA)抗体升高至32 U/m1(正常值<5 U/m1),抗蛋白酶-3(PR3-ANCA)抗体正常、为0.9 U/m1(正常值<5 U/m1)。免疫球蛋白G升高至20.9 g/L(正常范围8.6~17.4)、IgG1升高至13 g/L(正常范围4.04~10.11),IgG4无升高、为0.797 g/L(正常范围0.03~2.01)。C反应蛋白为57.2 mg/L(正常范围0~6),血沉为114 mm/h(正常值0~38 mm/h)。类风湿因子正常,为14 IU/ml(正常值0~15 IU/m1)。
1.2中文文献检索及分析 在中国知网、维普、万方等中文数据库中,检索以分泌性中耳炎为首发症状AAV的临床病例报告,中文检索词包括“中耳炎”、“首发”和“抗中性粒细胞胞浆抗体ANCA”,检索时间截止2021年12月。总结这些以分泌性中耳炎为首发症状AAV病例的临床表现和诊疗经过,以确诊方法、确诊时间和AAV预后等为观测指标进行比较分析。
1.3OMAAV的诊治标准 日本耳科学会OMAAV的诊断标准[2]诊断见表1。

表1 OMAAV的诊断标准
2 结果
2.1本例治疗及结果 本例患者有难治性分泌性中耳炎及复发性周围性面瘫的临床特点,结合免疫相关血清学检测结果,根据日本耳科学会提出的OMAAV诊断标准,诊断为OMAAV。经激素和硫唑嘌呤治疗3周后,患者右侧面瘫、双耳耳痛症状消失,双耳溢液停止,右耳气、骨导平均听阈分别降至39、29 dB HL,气管导差降至10 dB;左耳气导听阈降至46 dB HL,骨导听阈未变,气骨导差降至7 dB,听力明显改善。目前仍在治疗观察和随访中。
2.2中文文献检索结果 检索到中文文献13篇,其中以分泌性中耳炎为首发症状AAV的临床病例报告5篇7例患者,加上本例共8例患者,男2例,女6例,年龄17~73岁,平均43.1岁,临床资料详见表2。
8例患者中有3例继发耳痛,3例继发鼓膜紧张部穿孔,1例(本例)出现面瘫;此外,2例行改良乳突根治术,3例患者行2次以上鼓膜切开置管术。除本例患者外,其余7例均在出现发热、肺部结节等耳部以外表现后方确诊,确诊时间1月~3年,平均10.3月,其中5例确诊依据是耳部以外组织活检加ANCA血清学检查,2例是依据临床表现和ANCA血清学检查;2例死于ANCA相关血管炎引起的多器官功能衰竭,其余5例经治疗后病情缓解。本例患者根据日本耳科学会最近提出的OMAAV诊断标准,在出现耳部以外表现前即确诊并及时治疗,病情得到了良好控制。
3 讨论
AAV主要累及毛细血管、小静脉、微动脉和小动脉等小血管,是一种以寡或无免疫复合物沉积为特点的坏死性血管炎[1]。根据2012年新版Chapel Hill讨论表决会议(chapel hill consensus conference,CHCC)分类标准,AVV包括多发血管炎性肉芽肿(旧称韦格纳肉芽肿病)(granulomatosis with polyangiitis,GPA,or Wegener’s granulomatosis,WG)、显微镜下型多血管炎(microscopic polyangiitis,MPA)和变应性肉芽肿性血管炎(eosinophilic granulomatosis with polyangiitis,EGPA or churg-strauss syndrome,CSS)[8]。
AAV的临床表现复杂多样且有高度异质性,早期常缺乏典型表现,有患者是以全身非特异性症状为主或仅有眼、耳鼻咽喉等局部症状。耳部受累表现如中耳炎、耳聋、耳痛、面瘫等可是首发症状,甚至是唯一症状;可见于病程的早期,也可伴发于病程中的不同时期[9-11],因此极易误诊、漏诊及延迟诊断,有统计显示,首发鼻部症状者,误诊率在85%以上,首发耳部症状者则误诊率高达100%[12]。文中表2结果亦显示,以分泌性中耳炎为首发症状的AAV极易被误诊,除本例患者外,其余7例均在患者出现发热、肺部结节等耳部以外表现后方得以确诊。该病容易误诊的另一个主要原因是缺乏统一的AAV 诊断标准,现有的AAV分类和诊断方法都存在一定的不足,尤其难以满足以耳部表现为首发症状的AAV病例的诊断。为早期并及时诊断这类AVV,日本耳科学会对OMAAV的定义是:由AAV引起的中耳炎,与最初的发病部位无关,包括由GPA、MPA和EGPA引起的中耳炎,以及不符合系统性AAV普通诊断标准的中耳炎,并提出了具体诊断标准。
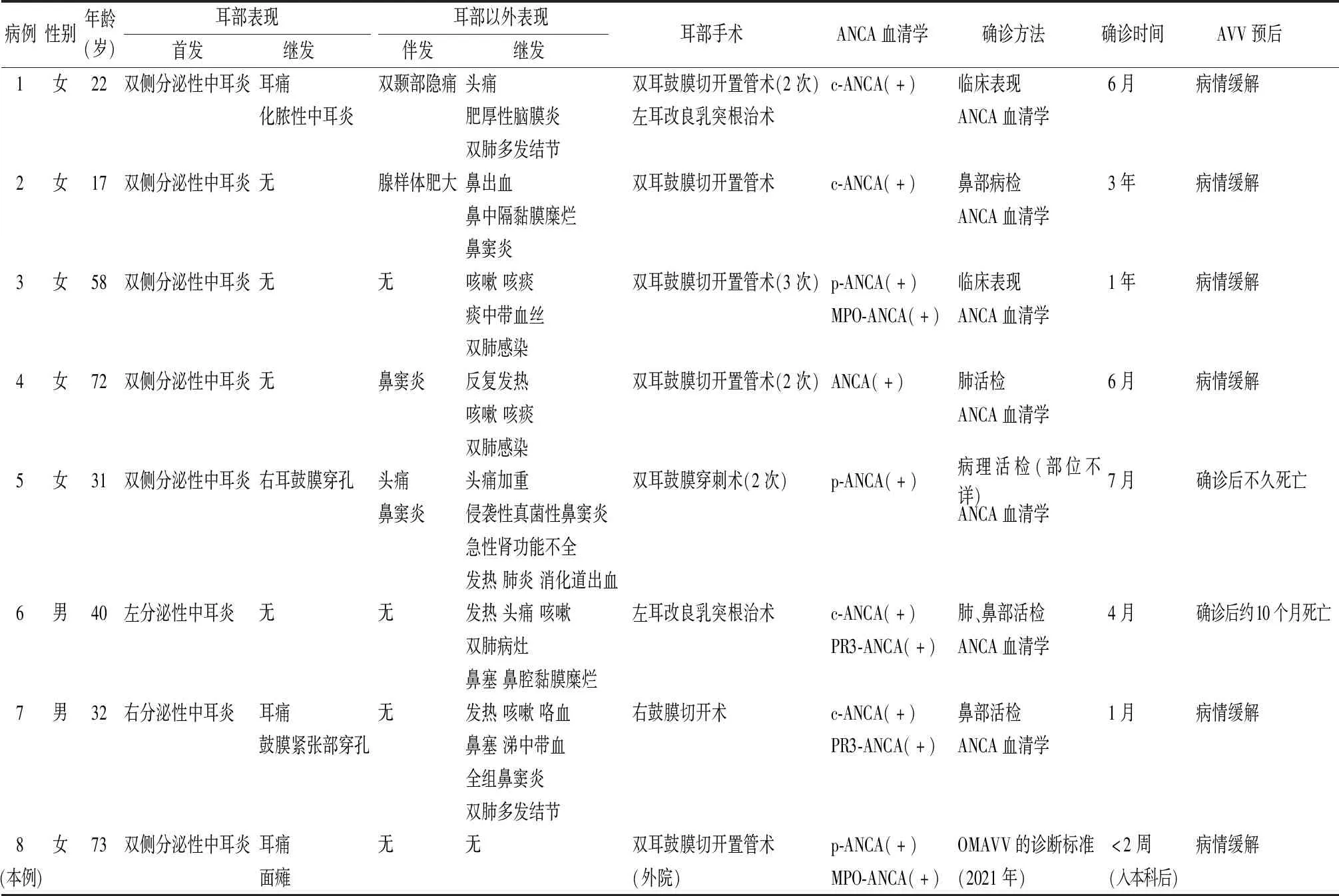
表2 以分泌性中耳炎为首发症状的ANCA相关血管炎病例的临床表现及诊断
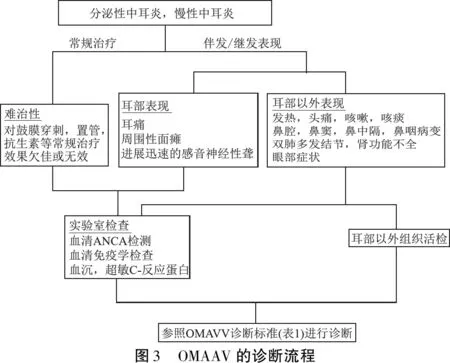
本例的临床特点为:①难治性中耳炎;②复发性周围性面瘫;③血清MPO-ANCA阳性;④可排除胆脂瘤、胆固醇肉芽肿、嗜酸性中耳炎、结核、恶性外耳道炎、颅底骨髓炎、肿瘤及由自身免疫性疾病如IgG4相关性疾病和AAV以外的血管炎引起的中耳炎的可能。这些临床特点符合表1中诊断标准的A-1、B-2、B-4-(2)和C,据此诊断为OMAAV并及时给予治疗,预后良好。因此,对于以耳部表现为首发症状的AAV病例,本文提出相关的诊断流程(图3),并推荐使用表1所示的OMAAV诊断标准。
OMAAV的诊断需要结合患者的临床表现和血清免疫学检查特别是ANCA检测结果。OMAAV的首发症状可表现为耳聋、耳漏、耳痛、耳鸣、眩晕或头晕及头痛,约99%的患者的首发症状为耳聋[2]。传导性聋、感音神经性聋和混合性聋可发生在OMAAV的不同临床阶段,进行性恶化的骨导听阈是OMAAV的一个主要临床特点。随着病情的发展,部分患者可发生周围性面瘫、肥厚性硬脑膜炎及耳部以外的上呼吸道、肺和/或肾脏受累情况。因此,临床表现对于OMAAV的诊断非常重要。本例OMAAV患者的诊断过程也说明对于难治性中耳炎患者,如果伴有周围性面瘫时,即使无全身性症状,仍应高度怀疑ANCA相关性血管炎等自身免疫性疾病的可能。
ANCA是ANCA相关性血管炎(含OMAAV)的特异性血清学标记物。应用间接免疫荧光法可检测胞浆型c-ANCA和核周型p-ANCA,通过ELISA可检测抗PR3-ANCA及抗MPO-ANCA。ANCA检测对诊断AAV的敏感度和特异度均很高,对OMAAV这种以局部表现为主的AAV的早期诊断十分有益。但是,血清ANCA的水平与检测方法、病情活动程度、免疫抑制剂治疗等相关,即使ANCA阴性也不能完全排除AAV(含OMAAV)可能。日本耳科学会的研究显示约17%的OMAAV患者血清MPO-ANCA和PR3-ANCA均阴性,且血清MPO-ANCA和PR3-ANCA全阴性是预后不良的因素之一。因此,OMAAV的诊断不能只依据血清ANCA水平,还应紧密结合临床表现,根据表1诊断标准进行诊断,以减少漏诊误诊。
根据AAV的组织病理学特点,OMAAV的组织病理学诊断标准被定为伴或不伴肉芽肿性血管外炎症的坏死性小血管炎(表1)。日本耳科学会对279例OMAAV患者的研究发现,虽然有179例患者在耳部以外的组织进行了活检,其中仅58例(32%)组织病理学表现为AVV;而且,取自中耳或乳突腔的绝大多数组织样本为非特异性炎症细胞浸润和坏死组织,缺乏血管炎的特征性证据,279例OMAAV患者中只有一例中耳组织病检显示为典型的坏死性小血管炎[2]。本文表2中8例无1例依据中耳组织活检确诊。表明中耳组织病理学诊断不能用于所有OMAAV病例,重复多次进行中耳组织活检将延误诊断。因此,对那些血清ANCA阴性、也没有AAV组织病理学证据的患者,如果已经被诊断为AAV,或出现AAV相关的特征性表现如面瘫或肥厚性硬脑膜炎,或者用激素进行诊断性治疗有效,则仍可以被诊断为OMAAV。
关于OMAAV的鉴别诊断,需特别注意区分嗜酸性中耳炎、恶性外耳道炎以及IgG4相关性疾病。嗜酸性中耳炎的主要临床特征是:中耳充满大量粘稠分泌物和/或息肉组织,中耳分泌物或者病理检查中有嗜酸性粒细胞浸润,可伴有支气管哮喘或鼻息肉;恶性外耳道炎患者多合并糖尿病,血清ANCA呈阴性,对抗生素治疗有效;而OMAAV患者多对糖皮质激素治疗有反应但对常规抗生素治疗无效。IgG4相关性疾病,其主要特征是血清IgG4水平升高,IgG4阳性浆细胞的大量浸润导致受累器官肿大。掌握上述疾病的特点有助于OMAAV的鉴别诊断。
现有的系统性AAV 的临床实践指南主要包括2014年英国风湿病学会(BSR)[13]、2016年欧洲抗风湿病联盟(EULAR)[14]和日本厚生劳动省[15,16]发布的有关AAV管理指南,对于伴有肺部和肾脏等系统器官病变的OMAAV患者,应根据严重程度,按照上述指南进行治疗。目前,针对局限于上呼吸道的AAV和OMAAV的治疗方案尚未标准化。日本耳科学会在其全国范围内OMAAV的调查研究中发现与单独使用糖皮质激素(glucocorticoids,GCs)治疗相比,联合使用GCs和免疫抑制剂治疗OMAAV可以更有效地预防疾病复发和进一步恶化,因此,建议GCs和免疫抑制剂联合应用作为OMAAV的诱导缓解治疗[2]。可使用泼尼松和环磷酰胺或口服硫唑嘌呤或甲氨蝶呤等免疫抑制剂作为诱导缓解治疗药物[16,17]。诱导缓解治疗一般需维持至少3个月,之后开始缓解维持治疗。由于在治疗开始后12个月内停用GCs会显著增加复发的风险,故GCs的使用不应少于1年。环磷酰胺(CTX)或硫唑嘌呤(AZA)以及甲氨蝶呤(MTX)可用于维持缓解治疗[15,16]。根据2016年欧洲抗风湿病联盟(EULAR)提出的治疗方案,系统性AAV患者维持持续缓解的治疗时间应不少于2年[14]。对于OMAAV患者,可在平衡维持缓解与免疫抑制治疗安全性的基础上制定个性化的维持缓解方案。本例患者在明确诊断为OMAAV后,根据以上方法,给予强的松片和硫唑嘌呤联合用药治疗,取得了良好的疗效。
手术不是治疗OMAAV的最佳方法,多数学者不主张手术治疗。特别是以减轻炎症和改善听力为目的的乳突根治术和鼓室成形术不仅无效,而且可能会在OMAAV活动期造成术后伤口不愈合、加重病情,应当避免。此外,因为通过中耳组织活检获得OMAAV组织病理学证据的机率极低,反复的中耳组织活检将影响对患者的及时诊断和治疗,亦应避免。
