咽喉反流性疾病中SP、NK-1R、IL-8、PGP9.5的表达及意义*
2022-11-18王刚林春兰刘蔓林陈函王茂鑫陈贤明
王刚 林春兰△ 刘蔓林 陈函 王茂鑫 陈贤明
长期有害刺激会引起组织损伤,并产生自发疼痛,伤害性刺激导致与刺激强度不成比例的疼痛使得组织痛觉过敏。痛觉信息的放大不仅由炎症部位释放的物质产生,而且还通过邻近的激活或致敏神经纤维的募集产生,特别是通过轴突反射,这种现象被称为神经源性炎症[1]。P物质(substance P,SP)是常见的神经源性炎症因子之一,SP与神经肽受体1(neuropeptide receptor-1,NK-1R)结合具有强大的致炎作用,通过诱导炎症介质的释放损伤组织、促进白细胞进一步浸润扩大炎症反应。SP特异性受体属7次跨膜的G蛋白耦联受体,包括NK-1R、NK-2R、NK-3R 3种受体,其中NK-1R受体亲和力最强[2]。NK-1R受体又分为全长型与截短型两种不同构型,SP与全长型受体结合后会激活细胞向下游继续传递信号,而截短型受体则表达相反。Lai等[3]观察到,SP刺激单纯表达全长型NK-1R受体的HEK293细胞后,白细胞介素8(IL-8)表达增多,SP刺激单纯表达截短型NK-1R受体的HEK293细胞则结果相反,提示检测IL-8表达水平可能提示NK-1R受体的表达分型。蛋白基因产物9.5(protein gene product 9.5,PGP9.5)是神经元和神经纤维的特异性标记物,广泛表达于中枢与周围神经元、神经纤维、多种神经内分泌细胞内[4]。
咽喉反流性疾病(laryngopharyngeal reflux disease,LPRD)是指胃内容物反流至食管上括约肌以上部位,引起一系列症状和体征的总称[5]。抑酸治疗是主要治疗方法,但是在使用质子泵抑制剂后仍有些症状缓解率与安慰剂无差异[6],因此,推测这类人群的咽喉部长期受到胃内容物的有害刺激而产生不适,而神经源性炎症的作用使得这种不适放大,因而形成咽喉部高敏感性。目前针对LPRD发病机制的研究有很多,但是对于神经源性炎症与咽喉反流性病的关系尚未见报道,故本研究通过检测LPRD豚鼠咽喉部粘膜SP、NK-1R、PGP9.5、IL8基因的表达,初步探讨神经源性炎症与LPRD的相关性,为咽喉反流性疾病机制研究提供新的思路。
1 材料与方法
1.1实验动物及分组 健康白化雄性豚鼠20只,体重250 g~300 g,在标准动物饲养室内饲养,随机分为实验组和对照组,每组10只。本实验动物由联勤保障部队第九〇〇医院实验动物中心提供,合格证号SYXK(闽)2018-0005。本实验通过联勤保障部队第九〇〇医院实验动物福利伦理委员会审查,伦理审查受理号2021-012。
1.2实验试剂及仪器 MD SpectraMax190(美谷分子仪器上海有限公司),美国ABI荧光定量PCR仪7900,兔抗豚鼠PGP9.5多克隆抗体(ABclonal武汉爱博泰克生物有限公司),兔抗豚鼠NK-1多克隆抗体(美国赛默飞世尔),兔抗豚鼠beta Actin Polyclonal Antibody(美国赛默飞世尔),TranZol Up Plus Kit(北京全式金),RNase-free Water(北京全式金),SDS-PAGE凝胶配置试剂盒(碧云天),One-Step gDNA Removal and cDNA Synthesis SuperMix(北京全式金),TB Green Premix Ex Taq(日本TaKaRa),Mammalian Total Extraction Kit(北京全式金),Easy II Protein Quantitative Kit(BCA)(北京全式金),Blue Plus Protein Marker(北京全式金),豚鼠Actin内参引物、SP、NK-1R、IL-8、PGP9.5目的引物由生工生物(上海)有限公司提供。
1.3实验方法
1.3.1制备LPRD豚鼠动物模型 轻度麻醉豚鼠(1%戊巴比妥钠30 mg/kg,腹腔注射),取头低脚高位, 四肢和门牙固定,将硬膜外麻醉管经口插入至食管中上段(距口角约5~6 cm),管外端连接静脉输液泵,以8滴/分速率灌注,实验组豚鼠灌注模拟胃液即含0.5%胃蛋白酶及数滴亚甲蓝的0.01 mol/L盐酸混合溶(pH=2),对照组豚鼠灌注含亚甲蓝的生理盐水,20 min/d,连续灌注2周;灌注时观察咽喉部颜色,若咽喉部呈蓝色证明反流成功。灌注实验开始后,密切观察豚鼠的排便、饮食、毛色、精神、活动及有无呼吸急促等呼吸道症状并每日称重记录。最后一次灌注结束后,过量麻药腹腔注射处死豚鼠,快速取下声门后联合区黏膜组织备用。
1.3.2咽喉部黏膜石蜡切片HE染色 取咽喉部黏膜组织标本置于10%甲醛溶液中固定24 h,经脱水、透明、石蜡包埋,制成4 μm切片,行常规HE染色。采用白细胞浸润程度为指标,具体分级如下:在400高倍显微镜下随机取5个视野计数后取平均值;0级(20个白细胞);1级(21~50个白细胞);2级(51~80个白细胞);3级(81~120个白细胞);4级(>120个白细胞)。统计数据后对比各组间差异是否具有统计学意义。
1.3.3蛋白印迹(Western blot)法检测咽喉部黏膜NK-1R、PGP9.5、内参等蛋白的表达 取100 mg咽喉部组织用TPEB组织裂解液提取组织蛋白,使用BCA法蛋白含量检测(酶标仪检测),绘制标准曲线,计算待测蛋白样品浓度。配制12%的分离胶5 ml和5%的浓缩胶2 ml,待胶凝固后,电泳孔中加入待测样品,浓缩胶、分离胶电泳时电压分别为80 V、120 V,进行转膜。将膜放入5%的脱脂奶粉中(现用现配),室温封闭2 h;封闭结束时,TBST溶液洗膜5次,每次5 min。将一抗稀释(1∶1 000),4℃孵育过夜,洗膜5次,每次5 min。将PVDF膜平铺到一次性手套上,将膜浸入新鲜配制的发光工作液中,曝光拍照。数据用Image J软件分析。
1.3.4实时荧光定量PCR检测咽喉黏膜SP、NK-1R、IL-8、PGP9.5 mRNA表达 取50 mg咽喉部黏膜组织使用TransZol法提取总RNA。使用RNase-free Water调零后使用分光光度计测量待测样品RNA浓度并检测其纯度,并保存备用。取组织RNA反转录,按试剂盒说明和注意事项以10 μl体系混匀后离心,进行反转录37℃ 15 min,85℃ 5 s。使用SYBR-Green法根据试剂盒说明书配置10 μl的反应体系。反应条件如下:95℃ 1 min,60℃ 30 s,95℃ 5 s,60℃,扩增40个循环,得到各组样品的Ct值,以2-ΔΔCt值表示各组基因的相对含量。引物序列见表1。

表1 引物序列、扩增产物长度
2 结果
2.1实验动物一般情况 对照组豚鼠分别在第1、3天各死亡1只,实验组豚鼠在第1天死亡1只。死亡豚鼠在食管灌注后发生误吸、呼吸困难,次日死亡后解剖发现肺部均有淤血,推测可能因灌注速度过快引起严重误吸导致窒息死亡。实验前后两组间豚鼠体重差异均无统计学意义(P>0.05)(表2)。
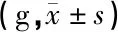
表2 实验前后两组豚鼠体重
2.2白细胞浸润程度 HE染色示实验组声带后联合黏膜下白细胞浸润程度(29.78±4.27个)较对照组(7.25±2.82个)增多,差异有统计学意义(P<0.05)(图1)。
2.3Western blot检测结果 实验组PGP9.5的相对灰度值为(1.88±0.22),明显高于对照组(1.26±0.28),差异具有统计学意义(F=26.13,P<0.05);实验组NK1R的相对灰度值为0.29±0.05,明显高于对照组(0.21±0.06),差异具有统计学意义(F=8.46,P<0.05)(图2)。
2.4实时荧光定量PCR结果 实验组与对照组SP mRNA表达差异无统计学(P>0.05),实验组NK-1R、IL-8、PGP9.5 mRNA表达较对照组上调,差异有统计学意义(表3)。


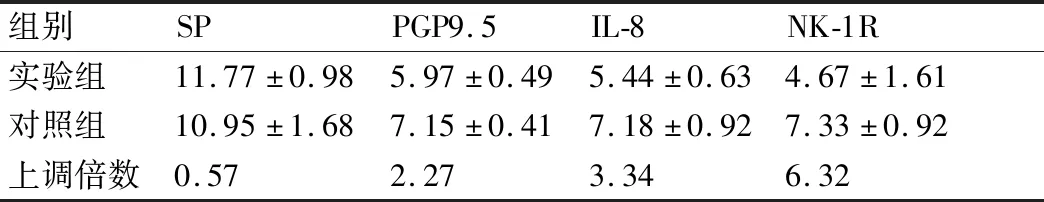
表3 两组SP、PGP9.5、IL-8、NK-1R mRNA表达(2-ΔΔCt)
3 讨论
无髓鞘的C纤维上存在接受伤害性信息的伤害性感受器,神经电生理研究表明豚鼠以及人咽喉部迷走神经传入纤维与肺部支气管相似,均为无髓鞘的C纤维,这为本实验的动物选择提供了理论依据[7]。本实验动物造模方法根据刘春丽等[8]的方法稍加改进,使用比普通胃管管径细数倍的硬膜外麻醉管插入食管中上端,直接灌注含胃蛋白酶的盐酸溶液;极细的直径能够尽量减少插管本身对实验动物食管及咽喉部的刺激,且实验组豚鼠声带后联合黏膜下白细胞浸润程度较对照组增多,证实该方法所造成的LPRD的动物咽喉部存在明显炎症,因此该方法是较为理想的LPRD动物造模方法。
SP与炎症、免疫和生殖密切相关,且SP在神经系统、消化系统、循环系统、泌尿系统中具有重要调节作用,其调控机制与浓度相关[9]。SP发挥相应生理作用的途径是通过NK-1R受体介导的[10],初级感觉神经纤维释放SP与NK-1R结合可致血浆外渗、血管扩张[11]。SP/NK-1R特异性结合诱导炎症介质释放,包括细胞因子、氧自由基、花生四烯酸衍生物和组胺等,增强了组织损伤,促进了白细胞的进一步吸收,并由此放大炎症反应。Gross等[12]证实SP的释放是气道炎症性疾病的重要一环,且主要由无髓鞘感觉神经C纤维末梢释放,并同时指出SP可能在其他炎症性疾病的发病中扮演着不可或缺的角色,如:炎症性肠病(IBD)、哮喘、结节病、慢性支气管炎、抑郁症等。Sonea等[13]研究发现使用SP受体拮抗剂可有效阻断炎症性肠病的炎症级联反应,证实SP可能是炎症性肠病发病机制中的关键一环。本研究中实验组动物咽喉部NK-1R基因、蛋白表达较对照组均明显上调,说明神经源性炎症有可能参与咽喉反流的发生发展,但两组间SP表达差异无统计学意义;有动物实验证实作用于NK-1R受体的SP通过激活抑制性NK-1R受体对其自身的释放产生负反馈[14],考虑反复咽喉反流致咽喉部炎症,激活咽喉部的感觉神经C纤维释放神经肽SP,参与伤害性信息的放大,从而使得患者易产生咽喉部不适;但是由于SP过量释放导致NK-1R受体合成增加,过量的NK-1R受体负反馈抑制了SP的合成,故组间SP表达差异无统计学意义。
NK-1R受体分为全长型和截短型两种构型,上游mRNA中外显子是否翻译决定了NK-1R受体的表达类型。全长型受体与SP的亲和力是截短型的10倍,两种构型细胞外受体结构一致均可与SP特异性结合发挥生物学效应,截短型较全长型细胞内C段末尾少了96个氨基酸,因此,称为截短型NK-1R受体。全长型NK-1R受体胞内C段含有蛋白激酶C,当SP与NK-1R特异性结合时蛋白激酶C可磷酸化蛋白质残基,并向下游传递信号,通常表现为信号通路;截短型受体因C段缺乏蛋白激酶而表现为沉默作用[15]。本研究特异性检测IL-8发现,实验组IL-8表达明显高于对照组,提示实验组中NK-1R受体表达增强可能以全长型NK-1R受体为主。
蛋白基因产物9.5(PGP9.5)是一种特异性神经纤维标记物,研究发现神经纤维密度具有可变性[16],气道高敏感性患者支气管黏膜神经纤维密度较正常人明显增高[17]。本研究实验组咽喉部PGP9.5较对照组明显上调,提示LPRD患者黏膜下的神经纤维密度增大,有可能进一步放大了神经源性炎症的作用,使得患者的咽喉部处于高敏感状态。
咽喉反流病患者咽喉部高敏感性产生的机理复杂,部分患者服用抗酸抗反流药物治疗后症状不能立即缓解,神经源性炎症可能是其原因之一。进一步研究神经源性炎症在咽喉反流性疾病病因和发病机理中的作用,将为下一步研究其有效的治疗方法提供理论依据。
