养肺保元汤调节Samd表达改善大鼠慢性阻塞性肺疾病合并肺间质纤维化
2022-10-09吴俣刘良丽朱晓龙
吴俣 刘良丽 朱晓龙
(贵州中医药大学第一附属医院呼吸内科,贵州 贵阳 550000)
慢性阻塞性肺疾病(COPD)是一种以持续气流受限为特征的疾病,世界卫生组织预测2030年,COPD将成为全球第三位的致死原因,COPD给全世界所带来的经济负担将列为所有单病种排位的第五位〔1,2〕。肺间质纤维化(PIF)是以肺泡壁为主,包括肺泡周围组织及其相邻支气管结构发生病变的一组疾病群,临床表现为进行性呼吸困难或刺激性干咳〔3,4〕。研究发现肺间质和肺泡纤维化是COPD病变向肺组织深处发展的结果,PIF是COPD发展的必然趋势和病理结局〔5〕。COPD合并PIF后,患者会出现更加严重的缺氧和肺部高压症状,预期的生存年限中位数也会降低至6年〔6,7〕。因此抑制COPD向合并纤维化发展有重要意义。转化生长因子(TGF)-β1/Smad通路是调节组织稳态的关键通路,TGF-β1/Smad通路上调会促进成纤维细胞分化和迁移,在肾脏、肝脏和PIF的研究中都发现了TGF-β1/Smad通路异常激活的情况〔8~10〕。本研究以COPD合并PIF大鼠模型为研究对象,检测养肺保元汤(YFBY)对PIF的抑制作用,探讨YFBY对TGF-β1/Smad通路的调控作用。
1 材料与方法
1.1实验材料 SD大鼠,雄性,重250~300 g,15只〔SCXK(湘)2016-0002,湖南斯莱克景达实验动物有限公司〕、香烟、YFBY(黄芪30 g、党参 15 g、生地黄15 g、熟地黄15 g、太子参15 g、麦冬15 g、当归15 g、淮山药15 g、川芎10 g、茯苓15 g、炒白术15 g、甘草3 g等,由贵阳中医学院第一附属医院药剂科提供,用上述组方500 g加水1 000 ml煎煮 2遍,合并煎液为100 ml)。
1.2主要试剂 苏木素染液、伊红染色液(BOSTER);TUNEL检测试剂盒(碧云天);大鼠TGF-β1试剂盒〔酶联免疫吸附试验(ELISA)〕;Mouse Monoclonal Anti-GAPDH、辣根酶标记山羊抗鼠IgG(H+L)、辣根酶标记山羊抗兔IgG(H+L)(中杉金桥);Rabbit Anti-Smad2、Rabbit Anti-Smad3、Rabbit Anti-Smad7(Abcam)。
1.3COPD合并 PIF造模 12只大鼠于自制60 cm×50 cm×40 cm的有机玻璃吸烟箱吸烟,吸烟量为5支/次,每天1次,每次吸烟时间为1 h,共计42 d。
1.4实验分组和给药 15只SD雄性大鼠,适应性饲养1 w后,随机分成正常对照组(Normal组)3只、COPD合并PIF模型对照组(Model组)4只、COPD合并PIF+YFBY(YFBY组)4只。除Normal组外进行COPD合并PIF造模,造模结束后开始给药,为期1个月。YFBY组每天灌胃养肺保元汤,3次/d,每次3 ml;而Model组每天灌胃生理盐水,3次/d,每次3 ml。
1.5苏木素-伊红(HE)染色 样本用甲醛固定完毕后,石蜡包埋,连续4 μm厚度切片。将石蜡切片进行烤片,然后脱蜡,水化。将已入蒸馏水后的切片放入苏木素水溶液中染色3 min,盐酸乙醇分化液分化15 s,水洗,返蓝液返蓝15 s,流水冲洗,伊红染色3 min,流水冲洗,脱水,透明,中性树脂封片,镜检。
1.6TUNEL染色 将石蜡切片进行烤片,然后脱蜡,水化。将切片移入湿盒中,每个样本上滴加 50 μg/ml Proteinase K工作液,37℃反应30 min。磷酸盐缓冲液(PBS)洗涤3次。每个样本上滴加足够量的TUNEL检测液,45℃避光孵育2 h。PBS洗涤3次。封片,镜检。
1.7ELISA检测 血浆样品直接进行检测。根据大鼠TGF-β1试剂盒说明书进行加样、加酶、温育、配液、洗涤、显色、终止、测定等操作。用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品实际浓度。
1.8Western印迹检测 取组织液氮研磨成粉末,加入裂解液后再次研磨,将组织匀浆吸入一EP管中,冰上裂解30 min后,4℃,10 000 r/min离心10 min,小心吸取上清,即可获得总蛋白。根据二喹啉甲酸(BCA)试剂盒测定蛋白浓度,蛋白变性,上样,进行十二烷基硫酸钠凝胶电泳1~2 h后湿法转膜2 h。一抗溶液孵育,4℃过夜;二抗溶液中室温孵育1~2 h。在膜上滴加电化学发光(ECL)曝光液,在凝胶成像系统中曝光。用Quantity one软件分析各抗体条带灰度值。
1.9统计学方法 采用SPSS19.0软件进行t检验。
2 结 果
2.1YFBY对TGF-β1/Smad 通路的影响 与Normal组比较,Model组Smad2、Smad3、Smad7水平显著升高(P<0.05);与Model组比较,YFBY组Smad2、Smad3水平显著降低(P<0.05)。见图1、表1。Normal组、Model组、YFBY组TGF-β1水平〔(16.80±1.286,17.01±0.864,16.62±1.640)ng/ml〕无显著差异(P>0.05)。
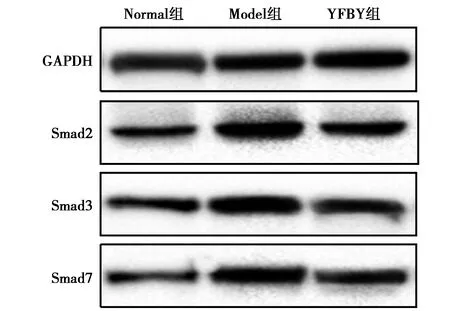
图1 各组肺组织中Smad2、Smad3和Smad7蛋白表达
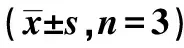
表1 肺组织中Smad2、Smad3和Smad7与内参 GAPDH相比的蛋白相对表达量
2.2YFBY对大鼠COPD合并PIF的治疗效果 相比于Normal组〔(11.00±1.00)个〕,Model组肺泡变小,肺泡间质增厚有炎性细胞浸润,组织中有更多细胞凋亡。YFBY组肺泡间质增生程度〔每个视野的TUNEL阳性细胞数(19.67±3.51)个〕显著低于Model组〔(51.33±14.01)个,P<0.05〕,细胞凋亡也低于Model组。见图2。
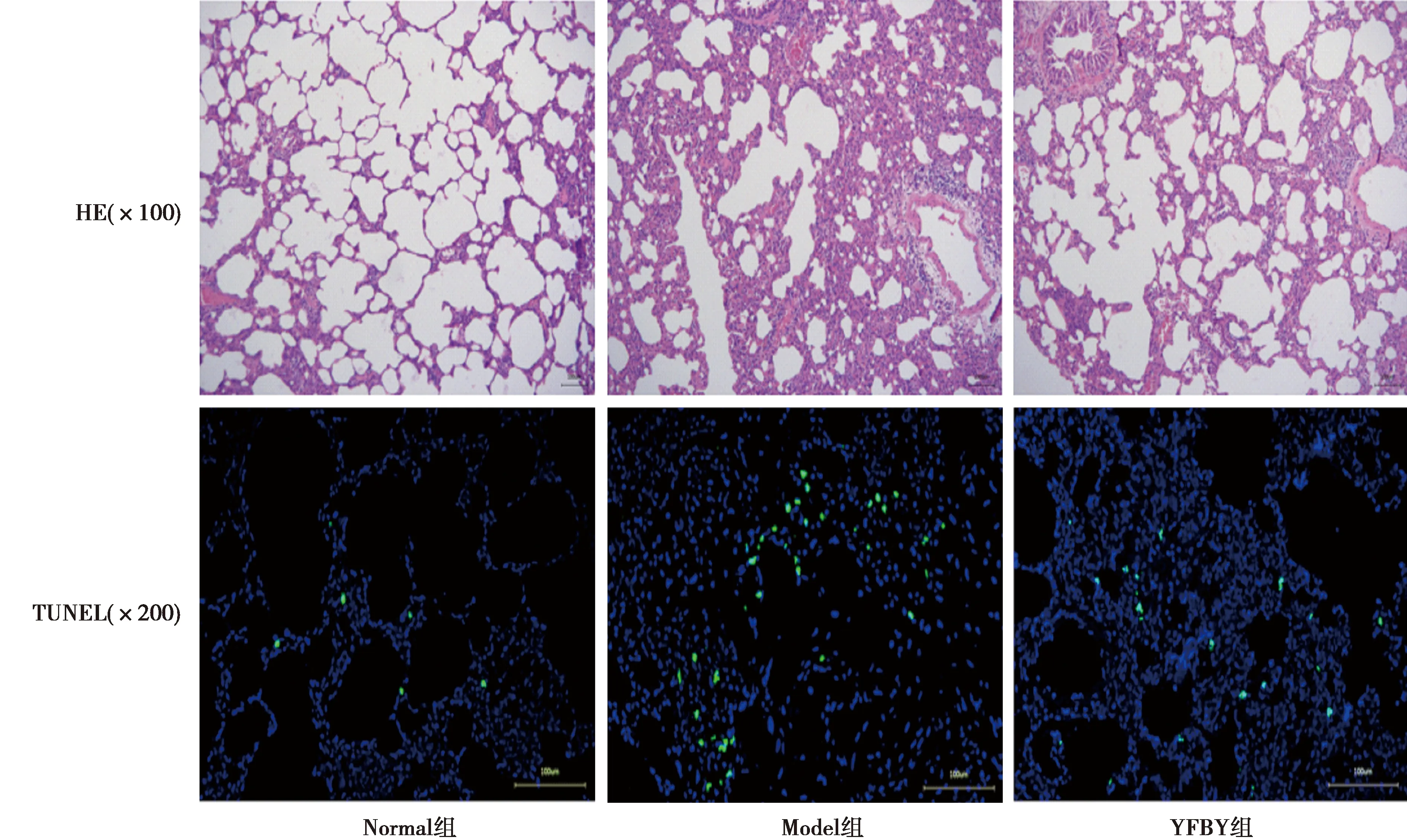
蓝色为细胞核,绿色为凋亡细胞图2 各组肺部组织
3 讨 论
吸烟是COPD的首要诱因〔11〕。TGF-β1/Smad通路上调会促进细胞增殖抑制细胞凋亡,尤其对成纤维细胞上皮间质转化(EMT)有显著诱导作用,最终导致相应区域的组织纤维化,特发性PIF就是一种典型病症〔9,12〕。TGF-β1/Smad 通路中TGF-β1是激活通路的细胞因子,而Smad则是一类受TGF-β受体激活的信号蛋白〔13〕。Smad2和Smad3被激活后会从TGF-β受体转移至细胞核,引发促纤维化基因过表达〔14〕。Smad7的表达同样受Smad2和Smad3诱导,但是Smad7主要起着抑制TGF-β受体活性的功能,从而达到抑制TGF-β1/Smad通路的效果〔15〕。本研究结果说明COPD合并PIF造模会上调肺组织中TGF-β1/Smad通路,而HE染色结果中PIF水平和TGF-β1/Smad通路激活水平相应,可以推测YFBY抑制PIF的疗效与TGF-β1/Smad通路激活水平相关。
