猪源多杀性巴氏杆菌的分离鉴定及耐药性分析
2022-09-29邹本革张瑞华
邹本革 , 张 伟 , 张瑞华 , 刘 伟 , 田 伟
(1.青岛农业大学海都学院 , 山东 莱阳 265200 ; 2.青岛农业大学动物医学院 , 山东 青岛 266109)
多杀性巴氏杆菌(Pasteurellamutocida,Pm) 是巴氏杆菌属中最重要的畜禽致病菌之一,能够感染人和多种动物的呼吸系统而导致疾病[1],如牛和羊的支气管肺炎、家禽的霍乱、猪肺疫、猪萎缩性鼻炎、牛出血性败血症、兔鼻漏等,给全球养殖业带来了巨大的经济损失,同时也威胁着人类健康[2]。猪多杀性巴氏杆菌病又称“猪肺疫”或“锁喉风”,是一种急性、热性传染病,此病分布广,常常与猪瘟、猪喘气病等混合或者继发感染,对猪危害很大[3]。
Pm血清型较为复杂,按照荚膜抗原可分为 A、B、D、E和F共5个血清型,在猪群中以A、B型和D型为主,且其血清型与致病性之间有一定的相关性[4-5]。如:A型主要引起猪的肺炎,是最常见的血清型;B型主要引起猪的出血性败血症;D 型主要引起猪的萎缩性鼻炎[4-6]。目前该病主要通过临床和实验室诊断确诊,最终通过PCR扩增细菌的16S rRNA和Pm特异性基因KMT1确定分离菌种属和荚膜血清型[7-8]。彭忠等[3,6]和席晓剑等[9]发现我国猪源Pm主要以荚膜A型和D型为主。
山东省某规模化养猪场年出栏量4 000头,其中约40头猪出现体温升高,咳出带血丝的脓黏液,呼吸高度困难,食欲废绝,身体无力,不愿行走,坐姿呈犬样,不断咳嗽,排泄物呈水样,精神焦躁不安,最后虚脱死亡。剖检病猪可见心包肿大,有大量积液;心肌出血,表面和纵切后都有明显出血点;胸腔和肺部有粘连,且胸腔积液明显,肺脏充血、淤血肿大,部分坏死,其他器官眼观无明显病变。根据大体病变观察初步怀疑为猪Pm感染,为查明病原,本试验对患病猪肺脏进行细菌分离鉴定,并对分离菌进行药敏试验,旨在为Pm引起的猪源疾病防治提供参考。
1 材料与方法
1.1 主要试剂 胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)、血平皿、脑心浸液肉汤、细菌生化鉴定条和药敏纸片,均购自青岛高科技工业园海博生物技术有限公司;革兰染色试剂,购自北京索莱宝科技有限公司;TaKaRaExTaq®DNA Polymerase(含dNTP Mixture)、DL2 000 DNA Marker,均购自宝日医生物技术(北京)有限公司;其他试剂均为国产分析纯。
1.2 主要仪器 台式恒温振荡培养箱、恒温恒湿培养箱和超净工作台,均购自济南创日新仪器设备有限公司;基因扩增仪,购自伯乐生命医学产品(上海)有限公司;电泳仪,购自北京六一生物科技有限公司;伯乐凝胶成像系统,购自北京君意东方电泳设备有限公司。
1.3 病料和实验动物 山东省某规模化养猪场3月龄发病猪3头,体重约35 kg;SPF级昆明小鼠20只,体重约20 g,购自山东省药物研究所。
1.4 试验方法
1.4.1 细菌的分离培养 将无菌采集的病死猪肺脏内容物划线接种于血平皿上,置37 ℃恒温培养箱内培养,随时观察并记录菌落形态;挑取单个菌落在TSB无菌肉汤中进行振荡培养,纯化培养后菌株进行革兰染色镜检,观察菌体染色特性及形态。
1.4.2 生化鉴定 参考细菌生化鉴定条说明书,将所分离的培养物接种于生化鉴定管中,37 ℃恒温培养24~48 h,观察并记录生化反应特性,根据对照手册判定反应结果。
1.4.3 细菌16S rRNA基因序列分析 按照参考文献[7]合成细菌16S rRNA基因通用引物27F和1492R进行菌液PCR扩增,引物的序列信息见表1,由北京睿博兴科生物技术有限公司合成。PCR反应体系:ExTaq0.25 μL,10×ExTaqBuffer 5 μL,dNTP Mixture 4 μL,上下游引物各2 μL,菌液1 μL,最后加ddH2O补齐至50 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火45 s,72 ℃延伸1 min,共30 个循环。将含有预期目标条带的PCR产物送至北京睿博兴科生物技术有限公司测序。对测序结果利用NCBI/BLAST在线分析,利用DNAMAN软件与NCBI中已发表的基因序列进行同源性比对,并绘制系统进化树。
1.4.4 细菌种特异性鉴定和荚膜血清型鉴定 参照参考文献[7]和[10]合成鉴定Pm及其血清型引物,引物的序列信息见表1,引物均由北京睿博兴科生物技术有限公司合成。应用细菌种鉴定特异性引物和荚膜分型鉴定引物对目的基因进行菌液PCR扩增。PCR反应体系和程序同1.4.3。
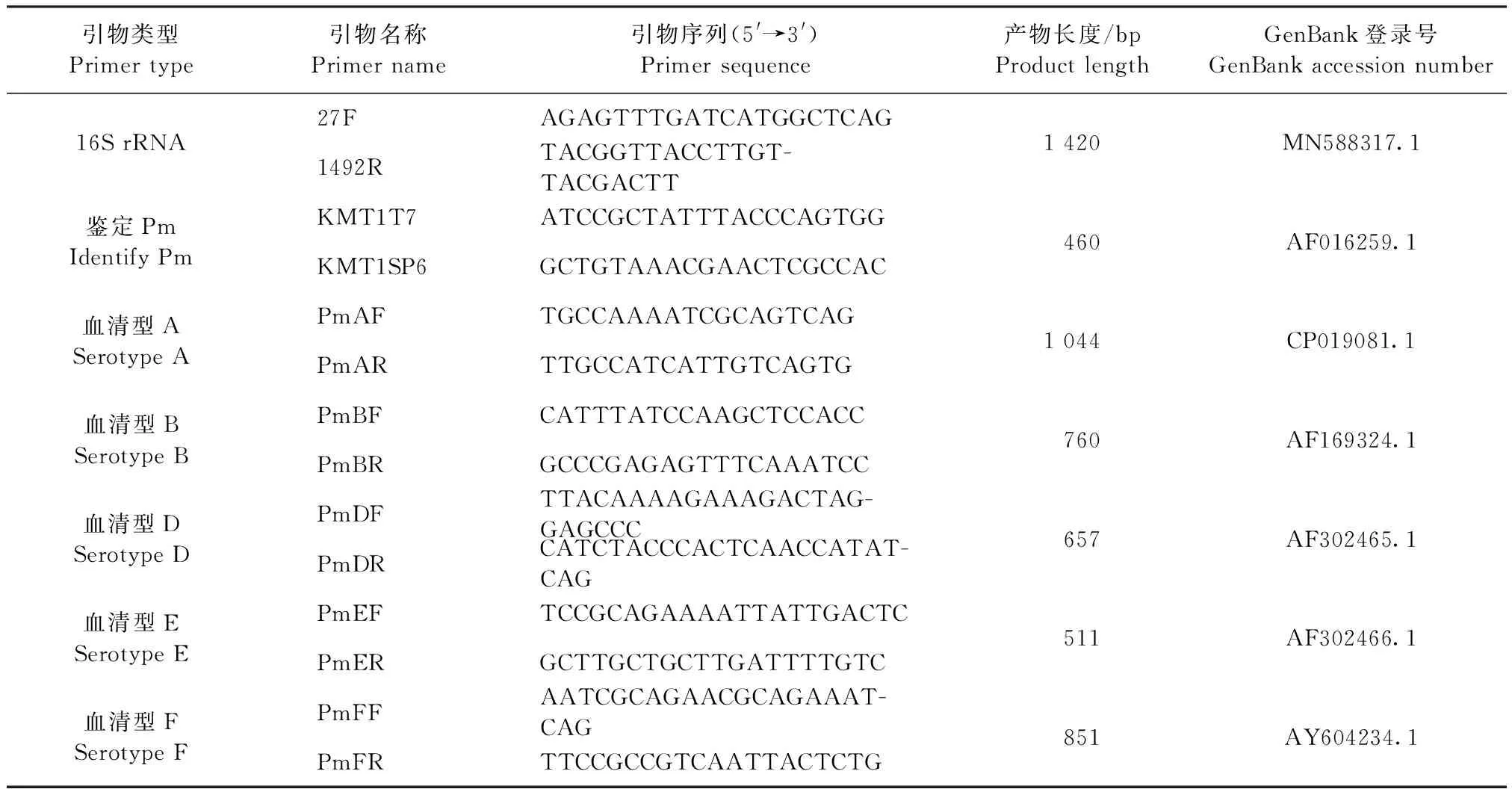
表1 引物信息Table 1 Primer details
1.4.5 动物回归试验 挑取单个菌落接于TSB液体培养基,37 ℃、200 r/min培养12 h。取20只健康的SPF级小鼠,随机分为3个试验组和1个对照组,每组5只。参照曹瑞勇等[11]的方法,对3个试验组小鼠分别腹腔注射0.2 mL含有1×107、1×108和1×109个细菌的菌液,对照组小鼠注射等体积的TSB液体培养基,逐日观察小鼠发病死亡情况。并对死亡小鼠进行剖检,观察病变并进行病原菌的分离鉴定。
1.4.6 药物敏感试验 按陈国权等[7]的K-B纸片扩散法进行药敏试验。挑取单菌落接种于TSB液体培养基,37 ℃、200 r/min培养12 h,取100 μL TSB菌液涂布于TSA血清培养基上,将常用抗菌药物的药敏纸片放在TSA平板上,37 ℃培养24 h,观察抑菌圈是否出现并测定其直径。
2 结果
2.1 细菌的分离培养 将接种过细菌的血平皿置于37 ℃恒温培养箱中培养48 h,细菌在血平皿上生长出灰白色菌落,表面光滑且较为湿润、边缘整齐且没有溶血现象(图1)。将菌落进行革兰染色,在油镜下观察该菌呈红色、短杆状、两端钝圆,为革兰阴性菌(图2)。

图1 分离菌落形态观察Fig.1 Morphological observation of isolated colonies
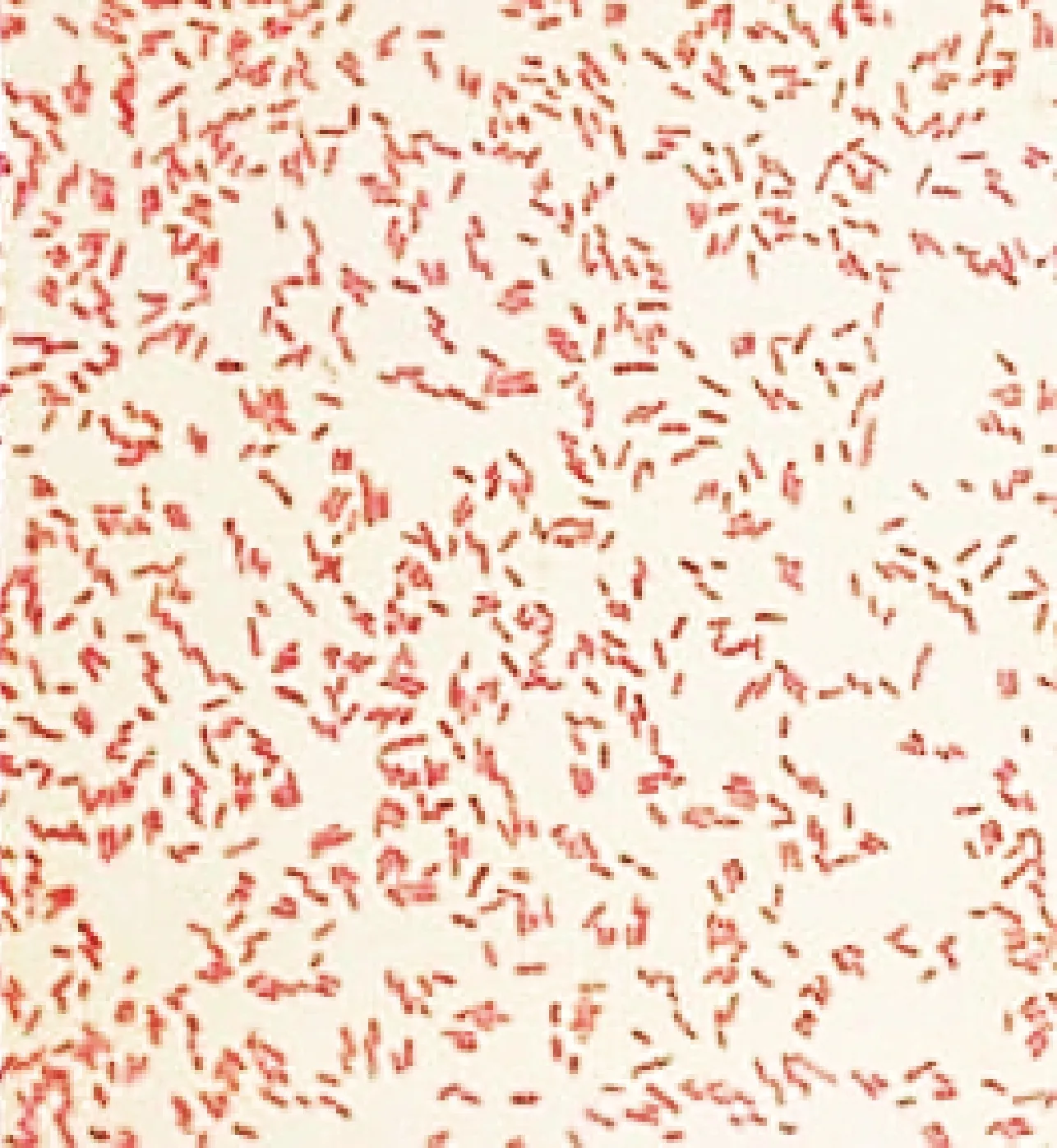
图2 分离菌革兰染色 (1 000×)Fig.2 Gram staining of isolated strain (1 000×)
2.2 生化鉴定 生化鉴定结果显示,该分离菌能发酵葡萄糖、蔗糖产酸;不发酵乳糖和麦芽糖;山梨醇、吲哚、氧化酶、肌醇、甘露醇反应结果呈阳性;枸橼酸盐、赖氨酸、精氨酸等结果均为阴性(表2),与Pm的生化特征相似程度最高。
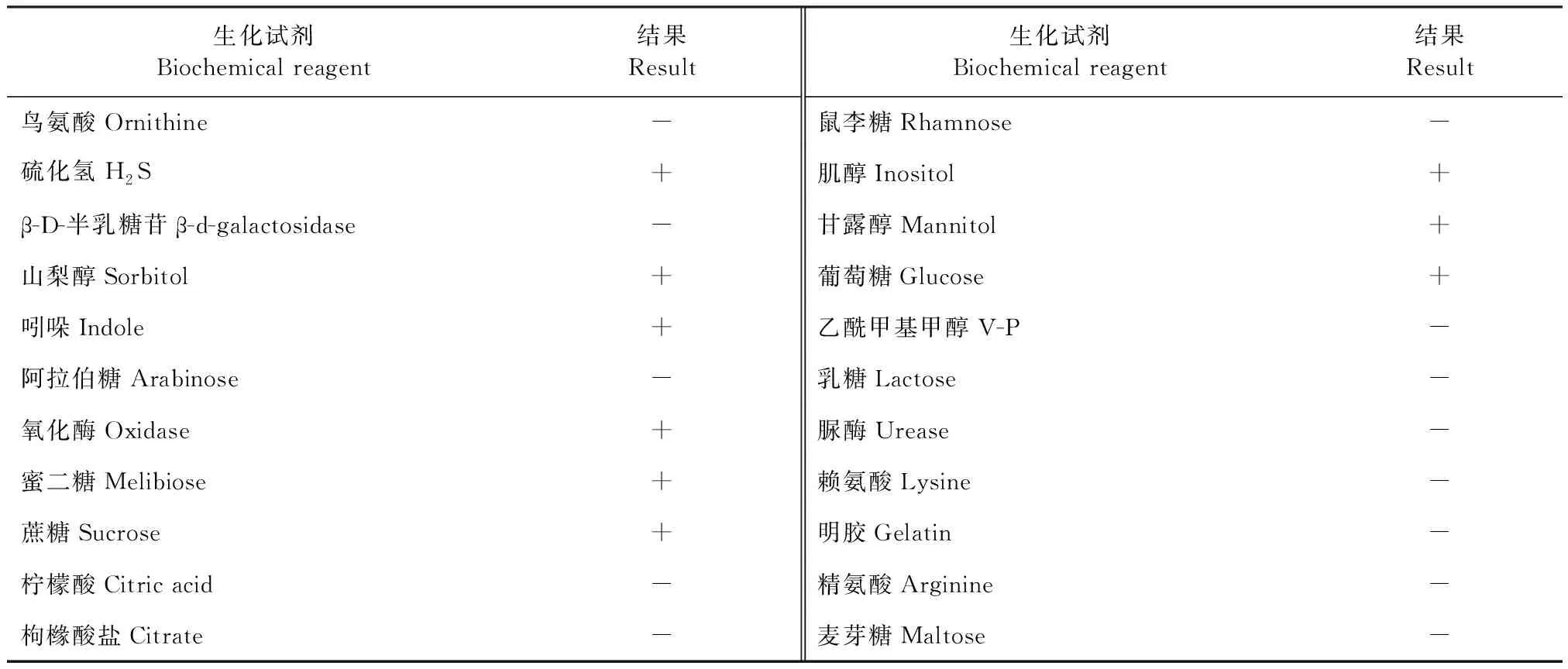
表2 分离菌的生化鉴定Table 2 Biochemical identification of isolated strain
2.3 细菌16S rRNA基因序列分析 利用细菌通用引物进行分离菌株16S rRNA基因的菌液PCR,扩增出预期1 420 bp的单一条带(图3)。将目标片段测序后,通过BLAST工具将其结果进行在线比对,结果显示,该序列与GenBank中Pm登录号分别为MN588317.1、MG597111.1、MN588319.1、MF417604.1、MG859656.1和MG745918.1的核苷酸序列相似程度最高,同源性大于99.9%;系统进化树构建结果也表明该菌株为Pm(图4)。且从3头病猪分离的细菌的16S rRNA基因扩增序列经比对后完全一致,说明为同一株菌,即均为多杀性巴氏杆菌。
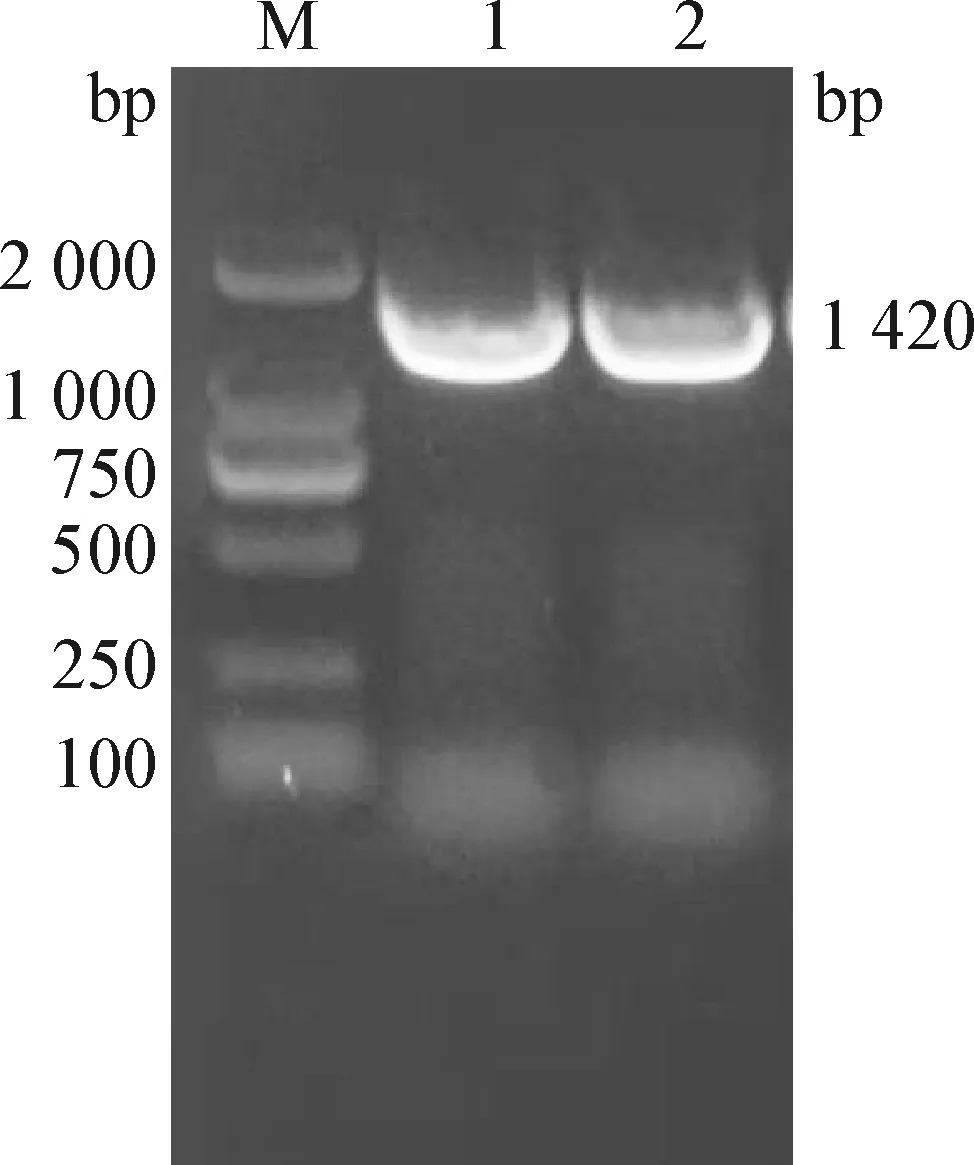
图3 分离菌16S rRNA的PCR扩增Fig.3 PCR amplification of 16S rRNA gene from isolated strainM: DL2 000 DNA Marker;1~2: PCR产物M: DL2 000 DNA Marker;1-2: PCR products
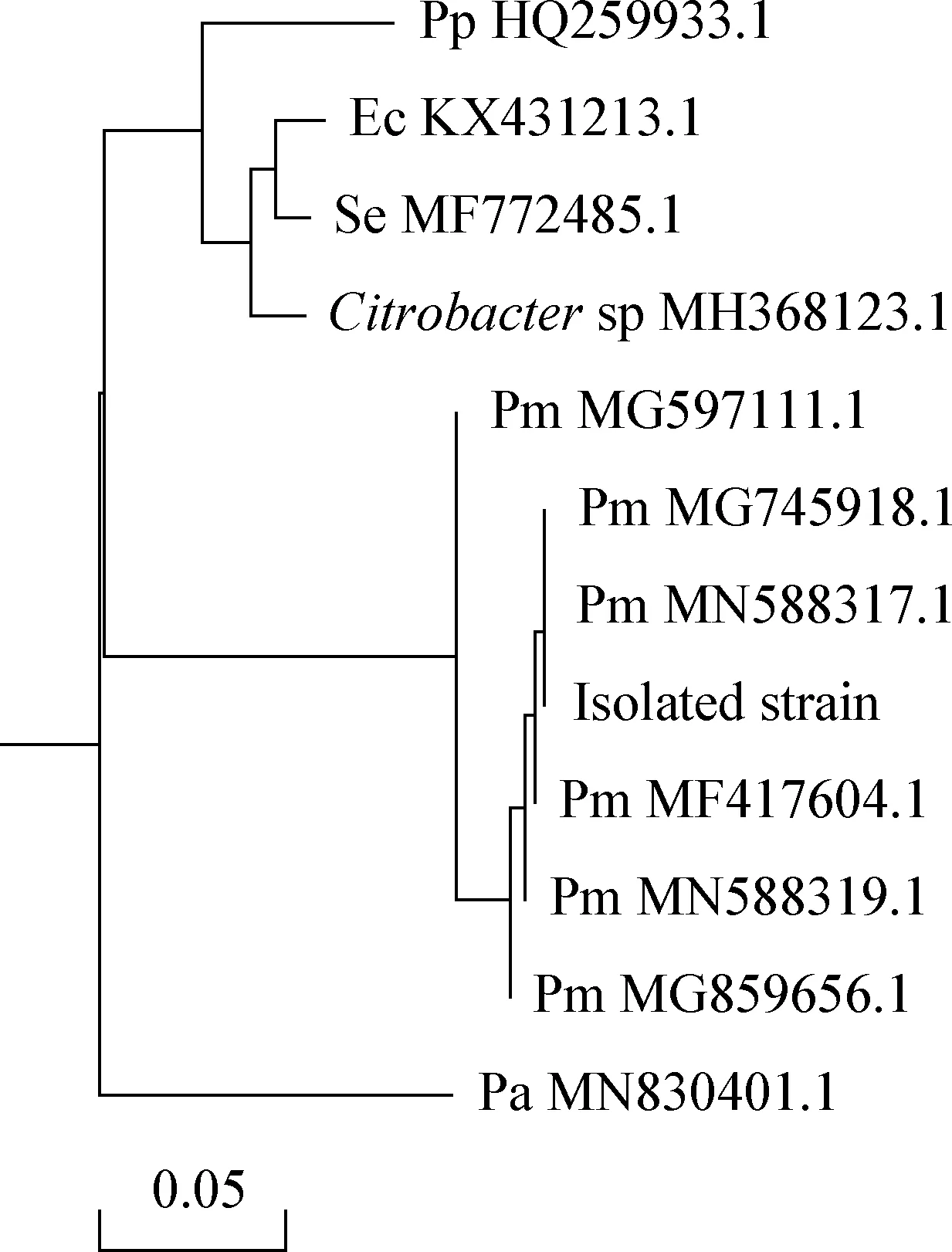
图4 分离菌株与参考菌株16S rRNA基因系统进化树Fig.4 Phylogenetic tree of 16S rRNA gene from isolated and reference strainsPp:变形杆菌; Ec:阴沟肠杆菌; Se:沙门菌; Pm:多杀性巴氏杆菌; Pa:绿脓杆菌Pp:Proteus penneri; Ec:Enterobacter cloacae; Se:Salmonella enteric;Pm:Pasteurella multocida; Pa:Pseudomonas aeruginosa
2.4 细菌种特异性鉴定和荚膜血清型鉴定 利用鉴定Pm特异引物KMT1T7和KMT1SP6对分离菌进行菌液PCR,获得大小为460 bp的DNA片段(图5),与预期大小相符合。
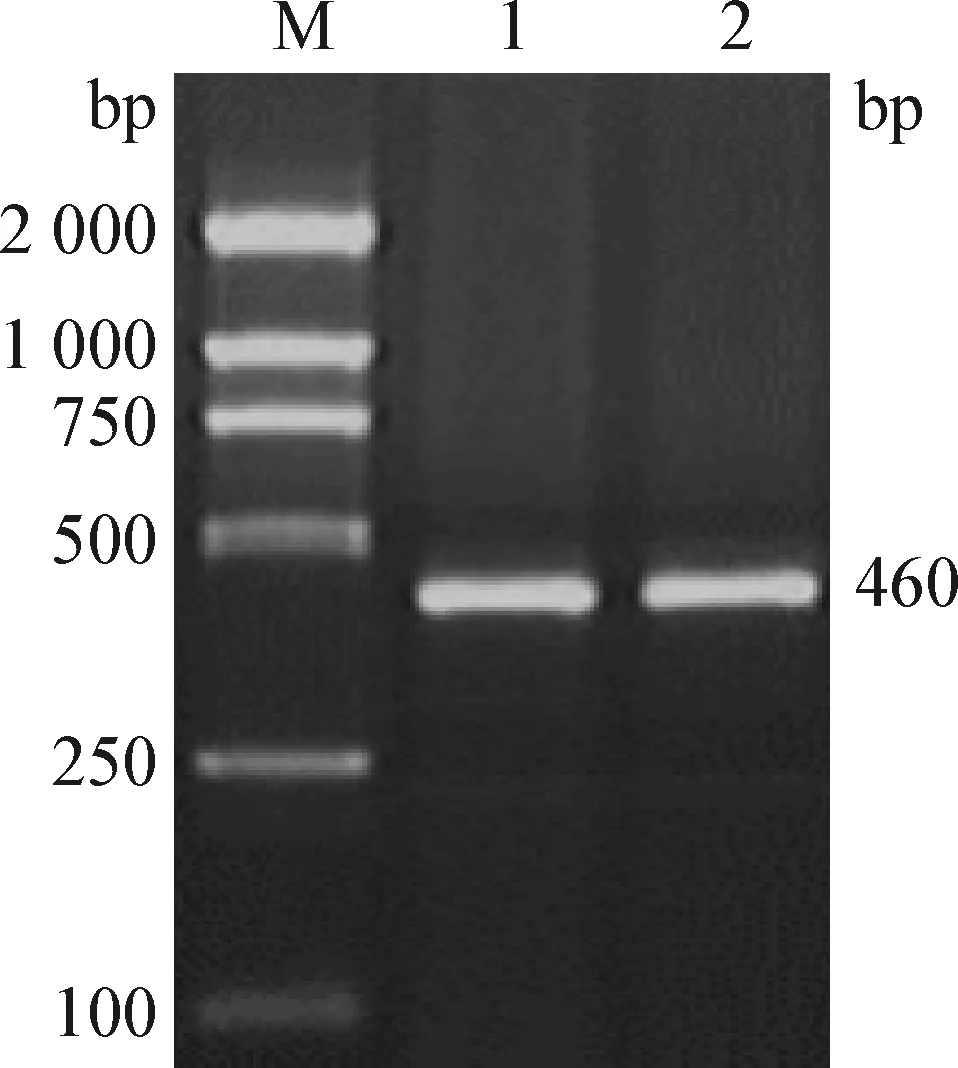
图5 分离菌KMT1基因的PCR扩增Fig.5 PCR amplification of KMT1 gene from isolated strainM:DL2 000 Marker; 1~2:PCR产物M: DL2 000 DNA Marker; 1-2: PCR products
利用荚膜血清型A、B、D、E型和F型共5对分型引物进行菌液PCR,结果显示,只有荚膜D型引物获得预期650 bp的单一条带(图6),测序后经BLAST搜索比对,符合荚膜D型Pm基因序列。
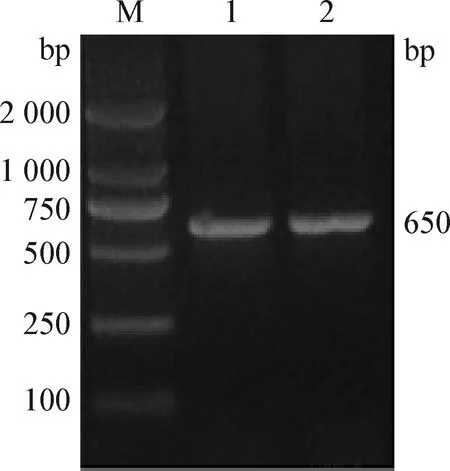
图6 分离菌荚膜血清型鉴定Fig.6 Capsule serotype identification of isolated strainM:DL2 000 Marker; 1~2:PCR产物M: DL2 000 DNA Marker; 1-2: PCR products
2.5 动物回归试验 分离菌菌液接种小鼠6 h后,试验组小鼠出现运动迟缓、食欲不振、呼吸急促、体温升高、皮肤血斑等症状,24 h后全部死亡,对照组小鼠全部正常。无菌采集小鼠肺脏液体接种于TSA血清培养基,37 ℃培养24 h,镜检及菌液KMT1 基因PCR结果都显示,试验组小鼠肺脏液体分离菌为Pm,且PCR产物经测序鉴定为猪源Pm荚膜D型(图7),而在对照组小鼠肺脏内未分离出Pm。
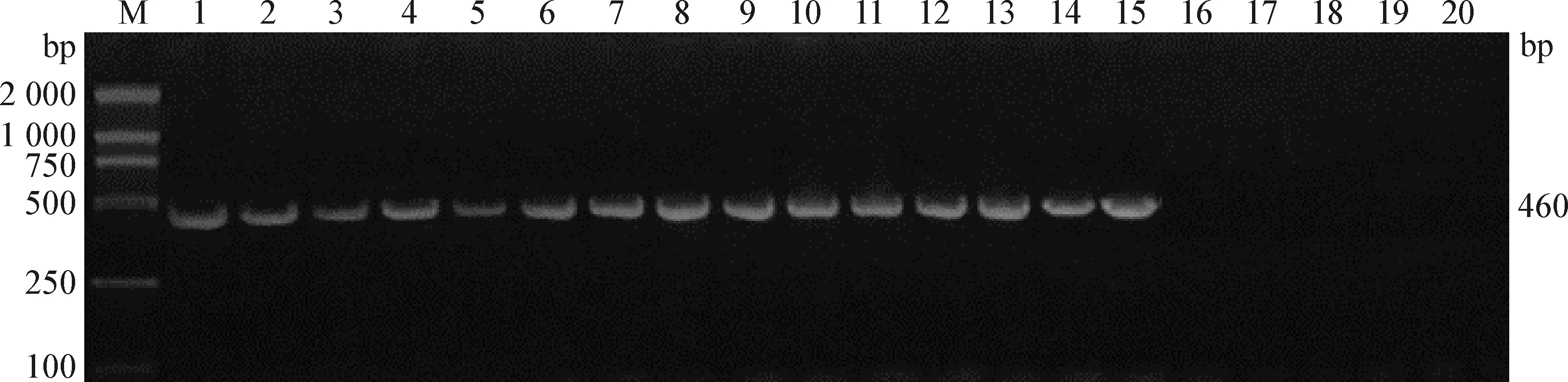
图7 小鼠肺液分离菌KMT1基因的PCR扩增Fig.7 PCR amplification of KMT1 gene from isolated strain in mouse lung fluidM.DL2 000 Marker; 1~15:试验组; 16~20:对照组M:DL2 000 DNA Marker; 1-15:Experimental group; 16-20:Control group
2.6 药敏试验 药敏试验结果显示,该分离菌对头孢噻吩、头孢唑啉、多西环素、安普霉素、庆大霉素、诺氟沙星和环丙沙星等14种药物敏感,对丁胺卡那霉素中度敏感,对氟苯尼考、头孢唑肟、恩诺沙星、链霉素、红霉素和青霉素等9种药物耐药(表3)。
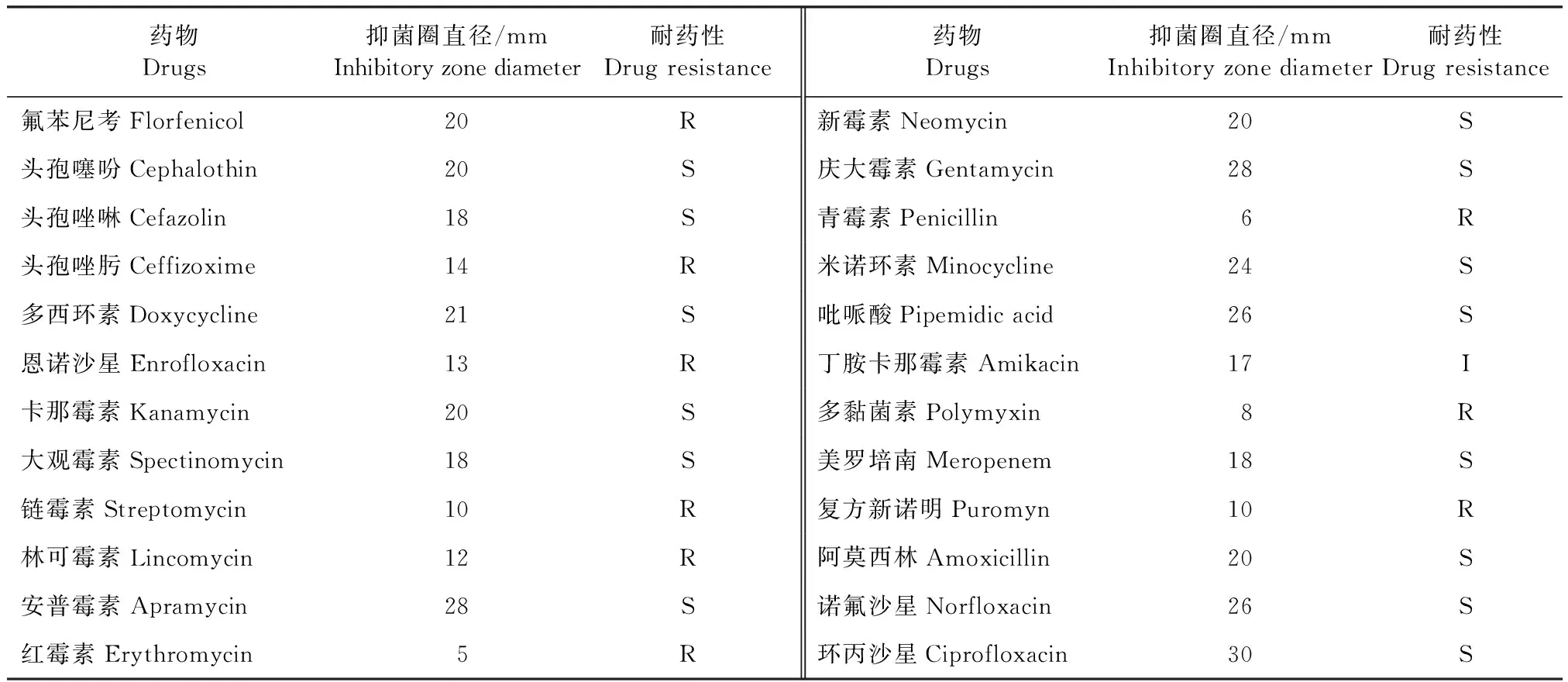
表3 分离菌药敏试验Table 3 Drug sensitivity test of isolated strain
3 讨论
本试验利用细菌分离法从养猪场3头病死猪的肺脏中分离出Pm,根据16S rRNA序列比对证明3头猪中分离出的Pm为同一株菌;同时分子鉴定中采用菌液作为模板直接进行PCR扩增,省去了细菌DNA提取的步骤,节约了试验成本,将鉴定时间缩短至少1 h。目前,虽然Pm的致病机制尚未完全研究清楚,但荚膜、脂多糖、外膜蛋白及毒素等在该菌致病过程中的作用已逐渐被证实[4-6]。宁慧波等[12]调查发现,由A型和D型Pm引起的猪萎缩性鼻炎严重影响了养猪业的发展。Ujvari等[13]报道了从患禽霍乱的鸡体内分离出D型和F型Pm。禽类中通常存在荚膜F型Pm,猪中却很少见,但有学者从我国猪的临床样本中首次分离出F型Pm,并确定其完整基因组序列,同时利用分离菌株分别对鸡和猪进行回归试验,结果显示分离菌株对鸡致病性弱,而对猪致病性很强[14],这说明同一荚膜血清型Pm对不同宿主的致病性存在很大差异。彭忠等[6]从国内不同地区规模化猪场患有疑似呼吸系统疾病的猪病料中分离出Pm,并对其进行血清型分析,结果显示,我国猪群中流行的Pm的荚膜血清型为A型占48.85%、D型占42.75%、F型占2.67%。席晓剑等[9]从有肺炎等症状猪的肺脏中分离鉴定出142株Pm,其中A型占48.6%;D型占49.3%。而本试验从病死猪的肺脏中仅分离出D型Pm,并且在不同批次和猪舍中同样检测到D型Pm,未分离出A型Pm,这与贡嘎等[4]从藏猪病料中分离的Pm血清型一致。动物致病性试验结果显示,该分离菌引起小鼠发病症状与送检病猪相同,且鼠体分离菌株和病猪分离菌株都可以扩增出PmKTM1基因特异片段,测序后证实为相同菌株,最终确诊发病猪肺脏中分离到的D型Pm是强致病株,同时也是送检病猪的主要病原菌。彭忠等[6]报道显示,Pm血清A型菌株毒力普遍较强,而D型毒力普遍较弱,但是A型菌株中也有毒力较弱的菌株。Pm的致病性与其宿主和菌株的毒力密切相关,是宿主与菌株相互作用的结果[15],这可能与猪的生存环境,或者Pm的脂多糖分型有关,也有可能与Pm自身是否携带exbD、hgbA、hgbB和ompA等毒力基因有关[3]。
目前,使用抗菌药物是治疗Pm最有效的方法之一,但不同地区Pm的耐药性具有一定的地域差异性。贡嘎等[4]对藏猪Pm的药敏试验表明,该菌对四环素、多西环素、阿莫西林和氨苄西林4种药物均产生耐药性,对恩诺沙星和环丙沙星敏感。曹瑞勇等[11]从黑山羊体内分离出的D型Pm对氟苯尼考耐药。刘海燕等[10]从山羊体内分离的6株Pm都对林可霉素和青霉素表现为耐药,对复方新诺明和氟苯尼考的敏感性最高。本试验分离到的Pm菌株对氟苯尼考、头孢唑肟、恩诺沙星耐药,对安普霉素、庆大霉素、诺氟沙星和环丙沙星敏感性强,与贡嘎等[4]发现的对恩诺沙星的敏感性有较大差异,而刘杰等[16]研究发现鸭源A型Pm对恩诺沙星敏感性强,这可能与菌株的分离地区及动物来源不同等有关,这说明不同荚膜型的Pm的耐药敏感性不同,不能交叉用药。但本试验临床情况是采用环丙沙星等敏感性强的药物进行治疗,养殖场疫情没有很好的被控制,笔者认为一方面可能是与Pm荚膜血清型不同有关,另一方面也可能是本试验仅从3头病猪中分离出相同的Pm,其他病猪是否含有该类型Pm,或者是否含有其他毒株,也可能使治疗效果出现差异。刘杰等[16]指出革兰阴性菌在死亡后会产生大量的内毒素,对动物内脏器官会产生严重的毒害作用,因此在使用环丙沙星、庆大霉素的过程中可加入黄芪多糖以增强机体免疫功能,后续跟踪发现该养殖场的疫情有所缓解,死亡率降低。
本试验中筛选的Pm对小鼠的致病力比较强,且与临床发病猪的症状比较急吻合,表明分离菌株为强毒株,同时丰富了我国猪源Pm的生物学特征,为其感染的防控提供了有用的信息。随着我国对抗菌药物使用的逐步限制,细菌病的预防需要养殖场对致病毒株进行了解,难点是不同血清型的毒株基本没有交叉保护性,同时对药物的耐药性和敏感性差异很大,因此养殖场需要建立完善的监控体系,及时更新疫苗毒株。本试验的分离菌株能否作为疫苗研制还需要对其毒力基因和耐药基因进行分析,生产弱毒疫苗是否能够降低其致毒性还需要进一步研究。
