猪肌肉多发性脓肿病原菌的分离鉴定及药敏试验
2022-09-29李康健赵贤杰郭敏仪马春全
李康健 , 赵贤杰 , 郭敏仪 , 付 强,3 , 马春全,3
(1. 佛山科学技术学院生命科学与工程学院 , 广东 佛山 528225 ; 2. 佛山科学技术学院大学科技园 ,广东 佛山 528225 ; 3. 佛山佛科院动物医院有限公司 , 广东 佛山 528225)
猪脓肿是猪场中常见的多发病,多见单一肿块脓包。哺乳仔猪的脓肿多发于脐部,中大猪和种猪的脓肿多发于颈部,该现象主要是由药物、疫苗等不规范注射引起的。猪多发性脓肿在临床上比较少见,主要是因皮肤或黏膜损伤,化脓性病原菌直接侵入体内并大量繁殖造成的,也可由原发性病灶经血液或淋巴循环转移至新的组织器官而产生[1-2]。其特征是在猪肌肉形成外有脓肿膜包囊,内有浓汁潴留的局限性脓腔。脓肿膜包囊内的致病菌容易扩散,常可形成局部溃疡、组织坏死等并发症[3]。猪肉脓肿的常见病原菌有葡萄球菌、链球菌、伯克氏菌、气单胞菌以及化脓性棒状杆菌等[4-6]。其中多数致病菌可感染人,引起食物中毒等严重后果,威胁我国的食品卫生安全[7]。本试验发现的猪肌肉多发性脓肿分布于全身肌肉,但眼观体征无异常,屠宰过程中才被发现。因此,本试验对该病例进行了病原菌分离鉴定、药敏试验和组织病理学观察,为类似的猪多发性脓肿的诊治和鉴别提供科学依据。
1 材料与方法
1.1 病料样品 猪肌肉多发性脓肿病料采集自广东某大型养殖场。该猪肌肉多发性脓肿分布于全身肌肉,屠宰前体征无异常,屠宰过程中才被发现,同批次屠宰猪发病率为3%。
1.2 主要试剂 细菌基因组DNA提取试剂盒、2×ExTaqDNA聚合酶、DL-2 000 DNA Marker、载体pMD19-T、感受态细胞DH5α,均购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒,购自Axygen公司;异丙醇、无水乙醇、氯仿等试剂均为分析纯,购自广州鼎国生物技术有限公司;革兰染色试剂盒,购自北京索莱宝科技有限公司;大豆酪蛋白琼脂培养基(TSA培养基)、胰酪大豆胨液体培养基(TSB培养基)、药敏纸片,均购自杭州微生物试剂有限公司;微生物微量生化鉴定管,购自广东环凯微生物科技有限公司。
1.3 试验方法
1.3.1 病原菌的分离鉴定 无菌条件下,切开脓肿囊膜,使用无菌、洁净的接种环蘸取脓汁,并重复划线于TSA琼脂平板,37 ℃恒温培养12 h,待平板上长出菌落后,挑取单菌落进行革兰染色。
1.3.2 病原菌16S rDNA扩增 首先使用细菌基因组DNA提取试剂盒提取病原菌全基因组,并以其为模板,使用16S rDNA通用引物对进行PCR扩增[16S-F:5′-AGAGTTTGATCCTGGCTCAG-3′和16S-R:5′-TACGGCTACCTTGTTACGACTT-3′,引物由生工生物工程(上海)股份有限公司合成]。扩增体系为50 μL,PCR反应条件:95 ℃预变性,5 min后进入循环;94 ℃ 40 s、55 ℃ 35 s、72 ℃ 1 min,共30个循环;72 ℃ 延伸10 min。将扩增产物用1%琼脂糖凝胶电泳检测。
1.3.3 16S rDNA的克隆与序列分析 PCR产物经DNA凝胶回收试剂盒回收后克隆至载体pMD19-T中,再转化至感受态细胞DH5α中,经培养,挑取单个菌落进行鉴定,获得的重组阳性质粒由生工生物工程(上海)股份有限公司测序。将测序获得的16S rDNA基因序列在NCBI上进行序列比对,并用MEGA 7.0软件进行系统进化树分析。
1.3.4 生化试验 将获得的菌株进行生化试验,包括葡萄糖、蔗糖、鼠李糖等糖发酵试验,V-P试验,硝酸盐还原试验,试验步骤按说明书进行。
1.3.5 药敏试验 试验选取临床上较为常用的14种抗菌药物,运用纸片扩散法,在固体培养基上涂满获得的分离菌株并将药物纸片置于上面,放置在37 ℃恒温培养箱培养12~48 h。根据抑菌圈的大小将细菌分为敏感(S)、中度敏感(I)和耐药(R),结果判读参照美国临床和实验室标准协会(CLSI)2015年[8]中规定进行。
1.3.6 组织病理学石蜡切片制作 参照参考文献[9]方法对病灶进行病理切片制作,取脓肿病料通过固定、流水冲洗、脱水、包埋、切片、染色、镜检等过程制备组织切片,用以观察病料的病理组织变化。
2 结果
2.1 病原菌的分离与鉴定 采集猪肌肉多发性脓肿病料(图1),将脓汁划线接种于TSA琼脂平板上,经37 ℃恒温培养12 h,在琼脂平板上形成白色隆起、湿润、光滑、不透明的直径2~3 mm圆形菌落(图2)。涂片进行革兰染色,镜检可见大量革兰阳性、短链状或葡萄串状的球菌(图3)。
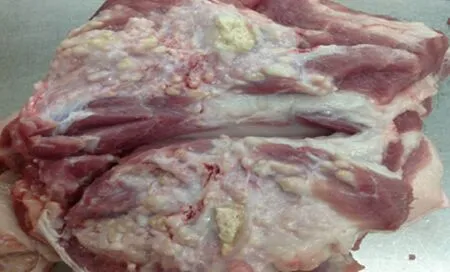
图1 猪肌肉多发性脓肿病灶Fig.1 Multiple abscess foci between the pig muscles
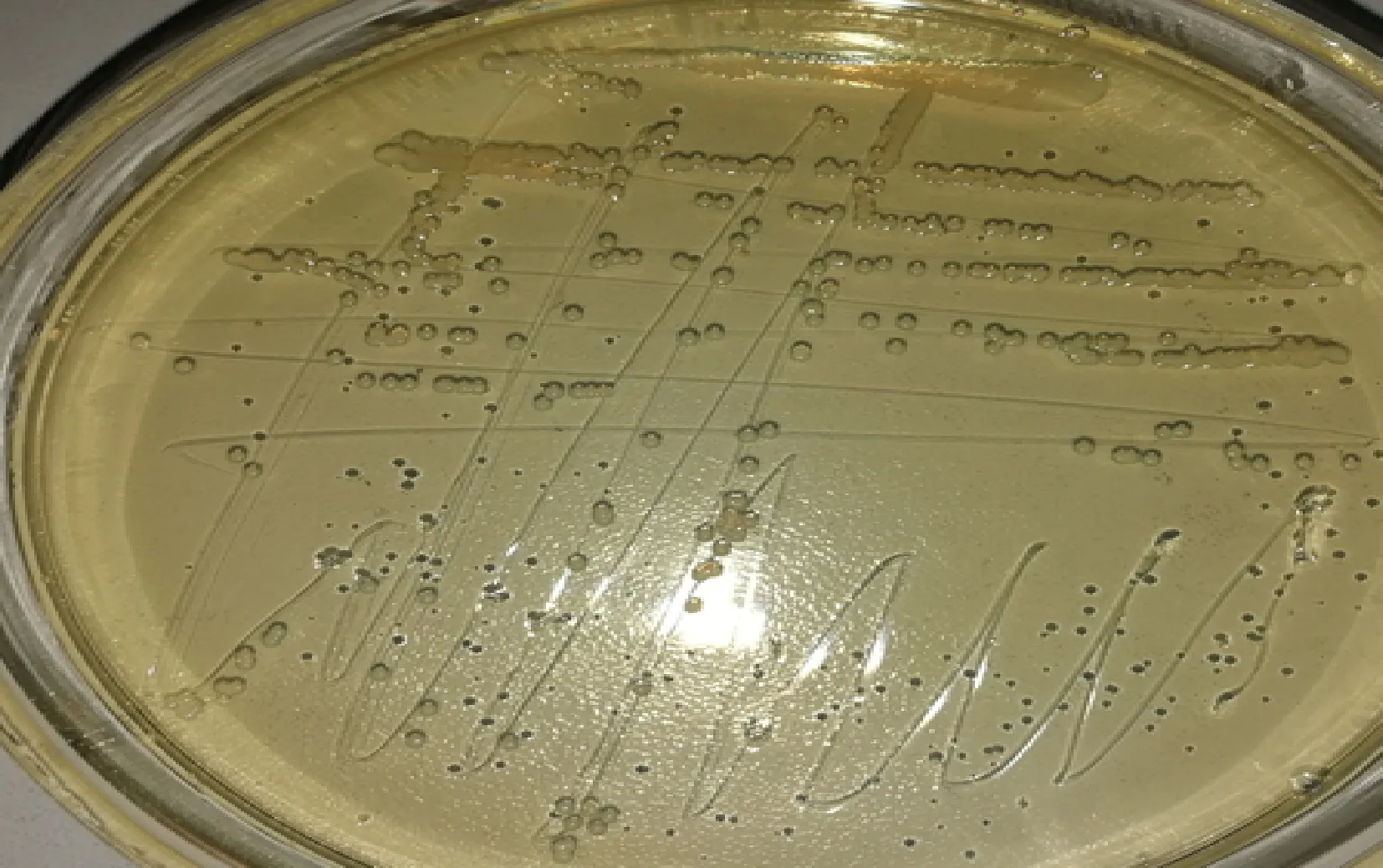
图2 分离菌在普通琼脂培养基上生长Fig.2 Bacterial isolate grown on agar medium

图3 病原菌革兰染色结果 (1 000×)Fig.3 Gram staining results of pathogenic bacteria (1 000×)
2.2 16S rDNA基因的序列分析 应用MEGA 7.0软件,将获得的分离菌株16S rDNA基因序列与8株葡萄球菌参考株的16S rDNA基因序列进行比对,并构建系统进化树(图4)。结果显示,本试验分离得到的葡萄球菌(Staphylococcussp. SG00263)与巴氏葡萄球菌(Staphylococcuspasteuris)处于同一进化分支上,亲缘关系最为接近。

图4 基于16S rDNA的葡萄球菌系统进化树Fig.4 Phylogenetic tree of staphylococci based on 16S rDNA▲:本试验分离菌株▲:The strain isolated in this test
2.3 生化试验 将分离菌株进行生化试验,结果如表1所示,该分离菌株可发酵麦芽糖、蔗糖、葡萄糖和松二糖,不能发酵木糖、乳糖和阿拉伯糖等;同时,分离菌株还能够还原硝酸盐,V-P试验测定为阳性。

表1 生化试验结果Table 1 Results of biochemical test
2.4 药敏试验 使用14种猪场常用抗菌药物对该分离菌株进行药敏试验,结果如表2所示,该菌株主要对β-内酰胺类药物耐药,如青霉素、氨苄西林、阿莫西林、头孢氨苄等;对部分氨基糖苷类药物耐药,如万古霉素;对部分氨基糖苷类药物敏感,如大观霉素;对链霉素中度敏感;对磺胺类药物耐药;对四环素类、喹诺酮类药物等敏感。

表2 药敏试验结果Table 2 Results of drug sensitive test
2.5 组织病理石蜡切片观察 取猪肌肉脓肿病料,制作病理石蜡切片。切片观察发现,猪肌肉脓肿病灶中有大量淋巴细胞、中性粒细胞及其他炎症细胞浸润,病灶与正常组织界限不明显,见图5。
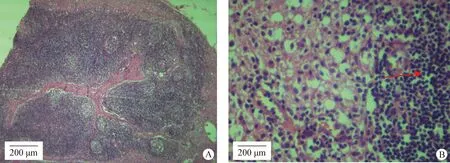
图5 猪脓肿病灶病理切片(H.E.染色,A:40×;B:400×)Fig.5 Pathological section of pig abscess (H.E. staining,A:40×;B:400×)红色箭头:淋巴细胞浸润 Red arrow:Lymphocyte infiltrations
3 讨论
猪脓肿是大型猪场中常见的一种外科疾病,但关于该病的报道在我国相对较少。近期仅有张天天等[10]在贵州某猪场的猪体表脓肿中分离出金黄色葡萄球菌、化脓隐秘杆菌等病原菌的报道。而本试验发现一病猪肌肉间多发性脓肿病例,国内尚未见报道。肌肉间多发性脓肿可以通过2种途径实现——直接通过创口和注射部位感染和血源性感染[11]。本试验通过组织病理学分析发现,病灶处的肌肉既有较大的脓肿灶,也有很小的病灶,且病灶与正常组织间界限不明显,具有一定的蜂窝织炎特点,与常见的普通脓肿有很大差异。而除肌肉外的其他内脏器官未见化脓灶,表明该病原菌主要通过肌膜扩散,提示该病例的出现可能与疫苗注射过程操作不规范有关。
巴氏葡萄球菌是一种人兽共患的病原菌,可引起多种局部或全身性的感染疾病[12-13],但其引起的猪的疾病却未见报道。本试验使用病例脓汁进行了病原菌分离鉴定,经系统进化树分析其是1株巴氏葡萄球菌。葡萄球菌具有产透明质酸酶特性,该酶能溶解肌膜,使化脓性病灶沿着肌膜鞘扩散。本试验发现的猪肌肉多发性脓肿分布于全身肌肉的病理特点,可能与该菌株的产透明质酸酶特性有关。另外,药敏试验结果表明该菌株耐药性强,对多数临床常用抗生素均耐药,也是该批次猪肉发病比例较高的重要原因之一。
本试验从一猪肌肉多发性脓肿病例中分离出1株巴氏葡萄球菌,并对该菌进行了药敏试验、生化试验和组织病理学分析。肌肉多发性脓肿及其病原菌的鉴定在国内尚未见报道,因此,本试验对肌肉多发性脓肿的检测及诊断具有临床指导意义,有助于提高我国的食品卫生安全水平。
