辅酶Q10对NEFA致肝细胞氧化应激损伤的保护作用
2022-09-29胡学远王天琦刘志鹏刘焕奇
胡学远 , 迟 良 , 姜 帆 , 王天琦 , 刘志鹏 , 刘焕奇
(1.青岛农业大学动物医学院 , 山东 青岛 266109 ; 2.青岛海关技术中心 , 山东 青岛 266002)
脂质是人体内最主要的能量储备物质之一,其代谢与动物和人类健康息息相关。研究显示,脂肪酸代谢紊乱与多种疾病有关,如2型糖尿病、肥胖症、高酮血症和心血管疾病等[1]。在能量摄取充足的情况下,哺乳动物主要依靠燃烧碳水化合物来产生能量,供给生命活动。而在葡萄糖不足以供给机体能量时,存储在脂肪组织中的甘油三酯则会被动员水解为脂肪酸,通过血液循环转运至肝脏,并主要通过肝细胞线粒体进行β氧化。脂肪酸完全氧化会生成α-酮戊二酸进入三羧酸循环,直接提供能量或进入生糖途径,但是当β氧化途径饱和时则会进行不完全氧化产生丙酮等。非酯化脂肪酸(Non-esterified fatty acid,NEFA)又称为游离脂肪酸,是体内中性脂肪分解的物质,主要在肝脏内通过β氧化代谢。生理条件下,NEFA在血液中的含量较低,但在某些应激或病理因素刺激下导致甘油三酯升高时,往往伴随NEFA升高。过多的NFEA进入肝脏会导致其不能被完全氧化,而是通过不完全氧化酯化成丙酮,导致人类或动物的高酮血症。NEFA还可以抑制葡萄糖的氧化和转运,引起胰岛素抵抗[2]。NEFA也是导致氧化应激的主要物质之一,NEFA经过线粒体氧化,产生大量的自由基,可以通过多条途径产生大量活性氧(Reactive oxygen species,ROS),进而导致组织细胞氧化应激损伤,最终引起细胞凋亡。NEFA还可以减少细胞内谷胱甘肽含量,损伤内源性的抗氧化防御系统[3-4]。
辅酶Q(CoQ)是NADH氧化酶(复合物I)和琥珀酸氧化酶(复合物II)的重要辅酶,对维持线粒体功能稳定具有重要作用,如心力衰竭和心肌炎等病人在饮食摄取CoQ10后,可以维持细胞氧化磷酸化和线粒体ATP生成能力[5]。CoQ具有强大的抗氧化和清除自由基功能,当细胞膜暴露于氧化条件下时,CoQ是首先被消耗的抗氧化剂,充当细胞抗氧化的先锋部队起到抗氧化功能[6]。动物试验证实,补充CoQ可以减轻因缺氧或紫外线照射等外部刺激引起的氧化应激和ROS增加[7]。临床试验也显示,CoQ10作为一种抗氧化剂,在治疗慢性疾病,如心血管疾病、肾脏疾病和非酒精性脂肪肝等疾病方面具有临床意义[8]。然而,CoQ10在NEFA诱发的肝脏氧化应激损伤中的作用尚不明确。因此,本试验利用NEFA诱导小鼠肝细胞AML12损伤模型,探究CoQ10是否对NEFA诱导的氧化应激损伤具有保护作用,为将来治疗NEFA诱导的脂质代谢紊乱提供新的思路和数据支持。
1 材料与方法
1.1 主要试剂 DMEM/F12培养基,购自美国Cytiva公司;胎牛血清(FBS),购自美国Gibco公司;CoQ10粉末,购自美国Sigma公司;氧化应激试剂盒:活性氧(ROS)测定试剂盒(化学荧光法)、总超氧化物歧化酶(SOD)测定试剂盒(WST-1法)和丙二醛(MDA)测定试剂盒(TBA法),均购自南京建成生物工程有限公司;MTT细胞增殖及细胞毒性检测试剂盒和增强型线粒体膜电位检测试剂盒(JC-1),均购自江苏碧云天生物有限公司。
NEFA贮存液(52.6 mmol/L)配方参考本课题组已发表的文章[9],主要包括硬脂酸、油酸、亚油酸、棕榈酸和棕榈油酸;CoQ10贮存液配方(20 mmol/L):取863.36 mg CoQ10粉末加入49 mL DMEM/F12培养基中,再加入1 mL DMSO助溶,完全溶解后于-20 ℃保存。
1.2 细胞株与细胞培养 小鼠肝细胞系AML12,来源于美国模式培养物集存库(ATCC)。细胞使用含10% FBS的DMEM/F12培养基,于5% CO2、37 ℃恒温箱中培养。
1.3 试验方法
1.3.1 细胞分组及处理 AML12细胞生长至对数期后,进行消化重悬,按5.0×105个/mL细胞接种于96孔板中,加入总体积为200 μL的培养液,培养至细胞密度达80%~90%后进行细胞毒性和细胞增殖检测。将细胞消化重悬后,按5.0×104个/mL接种于6孔板中,并分别用含终浓度为0.2 mmol/L(根据预试验和先前研究结果[10]得出)CoQ10(CoQ10组)、1.2 mmol/L(根据细胞毒性结果筛选得出)NEFA(NEFA组)和1.2 mmol/L NEFA+0.2 mmol/L CoQ10(CoQ10+NEFA组)的培养液培养细胞生长至密度为80%~90%,进行氧化应激相关指标检测和线粒体膜电位检测。对照组(Control组)加入等体积的DMEM/F12细胞培养液,其余处理步骤均与其他组一致。
1.3.2 细胞毒性与细胞增殖检测 细胞毒性测定:细胞经PBS清洗后,每孔分别重新添加含终浓度为0(对照组)、0.6、1.2、1.8 mmol/L和2.4 mmol/L NEFA的培养液200 μL,继续培养24 h;之后每孔加入10 μL MTT溶液,于37 ℃继续培养2 h。最后吸去孔中所有溶液终止培养,再加入150 μL MTT溶解液,于摇床低速振荡10 min,使孔底结晶充分溶解。溶解后将96孔板放入酶标仪中,在490 nm处测定每孔吸光度。细胞增殖测定:按照1.3.1将细胞分为Control组、CoQ10组、NEFA组和CoQ10+NEFA组,之后按照细胞毒性检测步骤使用酶标仪检测细胞增殖情况。细胞毒性和细胞增殖试验每孔均设立5个重复。
1.3.3 氧化应激相关指标测定 MDA含量和T-SOD活性检测:6孔板中细胞生长至密度为80%~90%时进行消化,于1 200 g离心10 min,弃上清收集细胞沉淀。在沉淀中加入0.5 mL PBS重悬,充分混匀,置于超声细胞破碎仪中充分破碎细胞,得到细胞匀浆,之后根据试剂盒说明书体系和步骤检测MDA含量和T-SOD活性。ROS含量检测:向生长至对数期的细胞中添加10 μmol/L二氯双氢荧光素二乙酸酯(DCFH-DA)荧光探针,充分混匀后,继续培养1 h。培养完成后按上述步骤将细胞重悬,转移至新的6孔板中,避光转移至荧光显微镜下进行检测。
1.3.4 线粒体膜电位测定 细胞长至密度达80%~90%时,用PBS清洗2次,随后加入含50%(v/v)JC-1工作液的培养基,孵育20 min。孵育完成后,弃全部培养液,并加入预冷的JC-1染色缓冲液2 mL充分洗涤3 min,重复2次。最后弃去全部JC-1染色缓冲液,并添加2 mL新鲜培养液,避光转移至荧光显微镜下,根据线粒体膜电位试剂盒说明书步骤及波长,在30 min内完成检测。
1.4 统计与分析 使用GraphPad Prism 8.04软件进行数据统计分析和作图,使用Image J软件对细胞荧光检测结果进行定量分析。各组间差异分析采用单因素方差分析配合Tukey事后检验,试验结果以平均值±标准差表示,以P<0.01表示有极显著性差异,以P<0.05表示有显著性差异,以P>0.05表示无显著性差异。
2 结果
2.1 CoQ10对NEFA诱导AML12细胞毒性的影响 细胞毒性检测结果如图1A所示,AML12细胞存活率随NEFA浓度升高而降低。与对照组(0 mmol/L)相比,当NEFA浓度在1.2、1.8 mmol/L和2.4 mmol/L时细胞活力均极显著下降(P<0.01),表明高浓度NEFA具有明显细胞毒性。因此,选取1.2 mmol/L NEFA进行后续试验。细胞增殖检测结果如图1B所示,单独添加CoQ10(CoQ10组)对细胞活力无显著影响(P>0.05),而CoQ10+NEFA组的细胞活力较NEFA组显著提高(P<0.05),表明CoQ10对NEFA诱导的细胞毒性有保护作用。

图1 CoQ10对NEFA诱导细胞毒性和细胞活力的影响Fig.1 Effects of CoQ10 on NEFA-induced cytotoxicity and cell viabilityA:不同浓度NEFA对AML12细胞毒性的影响; B:CoQ10对NEFA诱导AML12细胞毒性的影响与对照组比较,*:P<0.05,** :P<0.01; 与CoQ10组比较,#:P<0.05,##:P<0.01; 与NEFA组比较,†:P<0.05;下图同A:Effect of different concentrations of NEFA on AML12 cytotoxicity; B:Effect of CoQ10 on NEFA-induced AML12 cytotoxicity Compared with the control group,*:P<0.05,** :P<0.01; Compared with the CoQ10 group,#:P<0.05,##:P<0.01; Compared with the NEFA group,†:P<0.05. The same as below
2.2 CoQ10对NEFA诱导AML12细胞氧化应激损伤的影响 MDA检测结果如图2A所示,与对照组相比,CoQ10组肝细胞MDA含量无显著变化(P>0.05),而NEFA组MDA含量极显著升高(P<0.01);虽然CoQ10+NEFA组中MDA含量较对照组也显著升高(P<0.05),但较NEFA组显著下降(P<0.05)。T-SOD活性检测结果如图2B所示,与对照组相比,CoQ10组细胞T-SOD活性无显著变化(P>0.05),但NEFA组T-SOD活性极显著降低(P<0.01),而CoQ10+NEFA组细胞T-SOD活性显著高于NEFA组(P<0.05)。以上结果表明,NEFA可诱发AML12细胞氧化应激损伤,CoQ10对NEFA诱导的细胞氧化应激损伤具有保护作用。
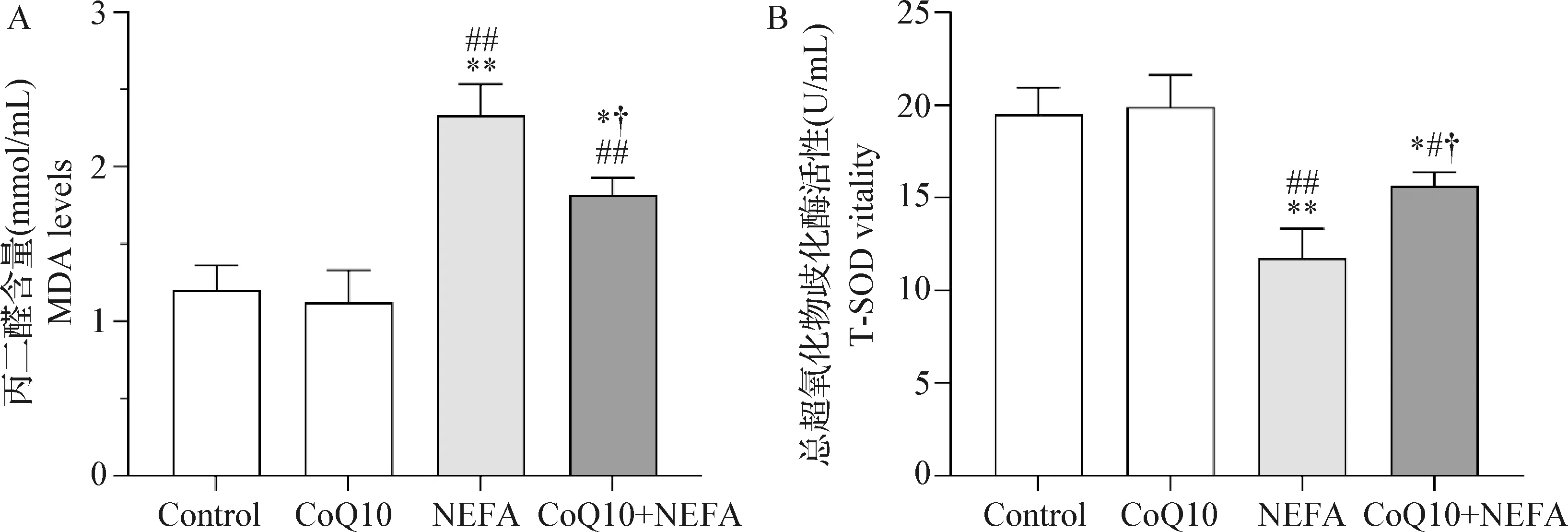
图2 CoQ10对NEFA诱导AML12细胞MDA含量(A)和T-SOD活性(B)的影响Fig.2 Effect of CoQ10 on NEFA-induced MDA level (A) and T-SOD vitality (B) in AML12 cells
为了进一步验证CoQ10对NEFA诱导AML12细胞氧化应激损伤的保护作用,本试验又对细胞ROS释放情况进行了检测。结果如图3所示,与对照组(图3A)相比,CoQ10组(图3B)细胞荧光强度无显著变化,而NEFA组(图3C)荧光强度显著升高,但CoQ10+NEFA组(图3D)荧光强度较NEFA组显著降低。定量分析结果如图4所示,CoQ10+NEFA组ROS水平显著低于NEFA组(P<0.05),但依然极显著高于对照组和CoQ10组(P<0.01)。表明NEFA可诱导细胞产生大量ROS,导致细胞氧化应激损伤,CoQ10可以通过下调ROS,减轻NEFA引起的细胞氧化应激损伤。

图3 CoQ10对NEFA诱导AML12细胞ROS含量的影响Fig.3 Effect of CoQ10 on NEFA-induced ROS levels in AML12 cellsA:Control组; B:CoQ10组; C:NEFA组; D:CoQ10+NEFA组A:Control group; B:CoQ10 group; C:NEFA group; D:CoQ10+NEFA group

图4 定量分析CoQ10对NEFA诱导AML12细胞ROS的影响Fig.4 Quantitative analysis the effect of CoQ10 on NEFA-induced ROS levels in AML12 cells
2.3 CoQ10对NEFA诱导AML12细胞线粒体膜电位变化的影响 线粒体是ROS生成的主要部位,因此有必要检测CoQ10对线粒体功能的影响。本试验对细胞膜电位的检测结果如图5所示,与对照组和CoQ10组相比,NEFA组中高线粒体膜电位(红色荧光)明显减少,而低线粒体膜电位(绿色荧光)明显增强,表明NEFA可导致线粒体膜电位下降。但与NEFA组比较,CoQ10+NEFA组高线粒体膜电位明显提高,且低线粒体膜电位明显减弱。
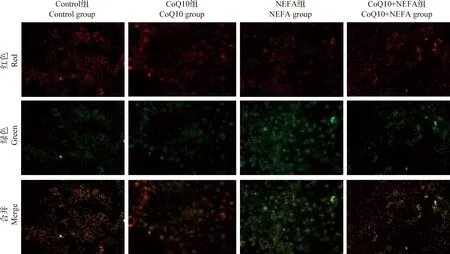
图5 CoQ10对NEFA诱导AML12细胞线粒体膜电位的影响 (100×)Fig.5 Effect of CoQ10 on NEFA-induced mitochondrial membrane potential changes in AML12 cells (100×)
将荧光图像进行相对定量分析,得到红色/绿色平均荧光强度比值,结果如图6所示,与对照组和CoQ10组相比,NEFA组红色/绿色平均荧光强度比率极显著降低(P<0.01),而CoQ10+NEFA组红色/绿色平均荧光强度比率显著高于NEFA组(P<0.05),表明CoQ10可以减轻NEFA诱导的线粒体膜电位降低。
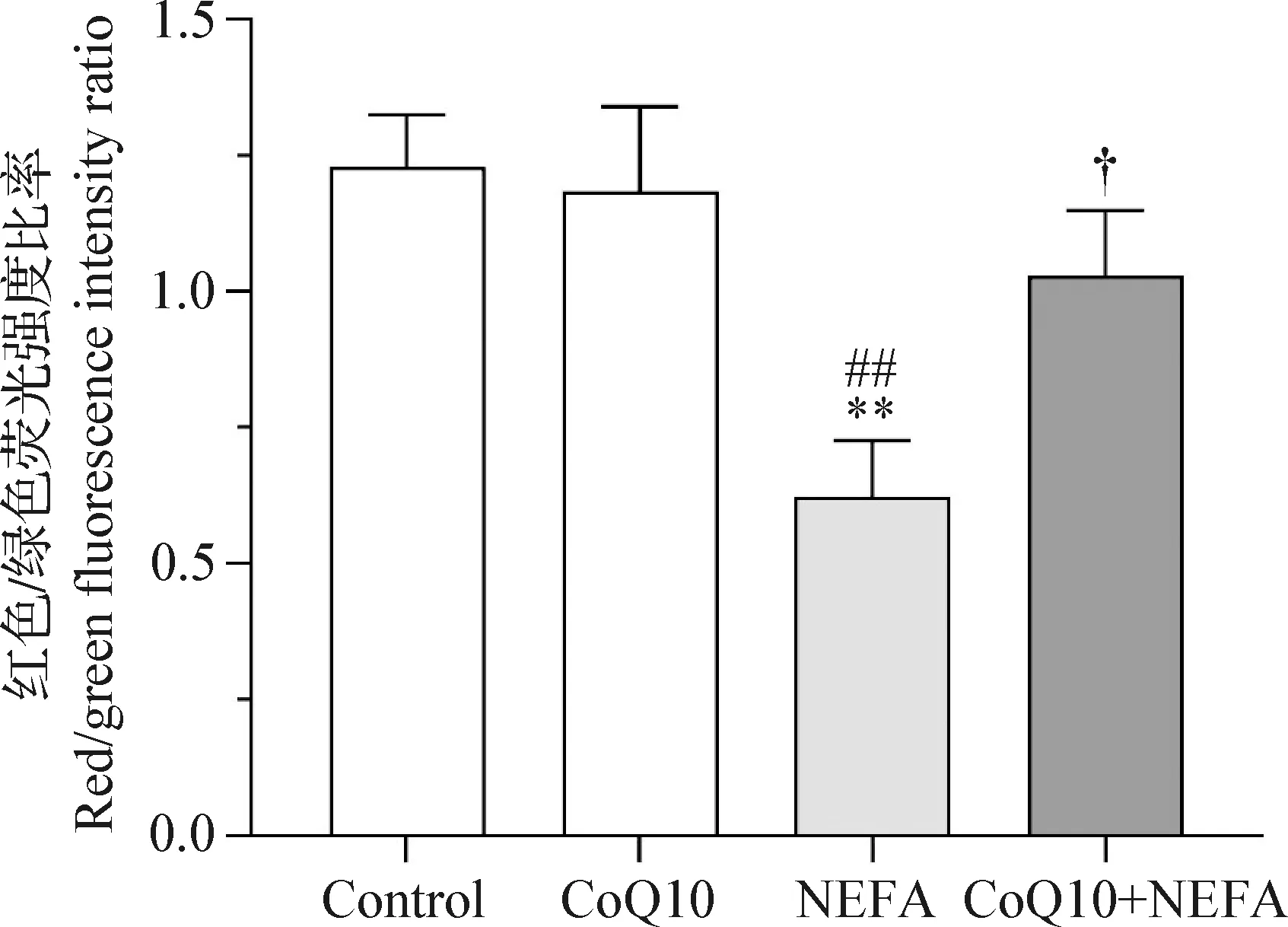
图6 定量分析CoQ10对NEFA诱导AML12细胞线粒体膜电位的影响Fig.6 Quantitative analysis the effect of CoQ10 on NEFA-induced mitochondrial membrane potential changes in AML12 cells
3 讨论
氧化应激可以诱导线粒体功能紊乱,启动细胞凋亡、炎症反应等信号传导。例如,游离脂肪酸(棕榈酸)可以通过增加ROS的产生来激活半胱天冬酶级联反应,诱导线粒体紊乱,从而诱导凋亡[11-12]。高脂饮食等原因引起的血清中NEFA升高可以诱发人类和动物胰腺、肝脏和骨关节等多种组织和细胞的氧应激损伤,并且与糖尿病、高酮血症等发病机制密切相关[13-16]。此外,NEFA也被作为诊断奶牛酮病的有效标志之一,在酮病的致病机理中发挥重要作用[17-18]。体外试验证实,高NEFA可诱发奶牛肝细胞氧化应激损伤,造成线粒体功能紊乱[19]。体内试验也证实,酮病奶牛体内NEFA浓度与过氧化氢(H2O2)和MDA等促氧化应激指标呈正相关,而与SOD和谷胱甘肽过氧化物酶等抗氧化酶(GSH-Px)活性呈负相关[20],由此可知,NEFA诱导的氧化应激损伤可能是导致人类和动物高酮血症和糖尿病的重要原因。CoQ是一种具有还原性质的重要辅酶,已被证实具有抗氧化和清除自由基的作用,但其对NEFA造成的氧化应激损伤是否有保护作用未见报道。因此,本试验通过复制小鼠肝细胞(AML12)NEFA暴露模型,探究CoQ10在NEFA诱导细胞氧化应激损伤中的作用。
本试验结果显示,AML12细胞经1.2 mmol/L NEFA刺激后细胞活力显著下降,说明此浓度NEFA可引起明显的细胞毒性。史晓霞等[21]在评估NEFA对体外培养犊牛原代肝细胞炎性因子表达的影响时也发现,1.2 mmol/L NEFA能显著提高牛肝细胞肿瘤坏死因子α和白介素1β的表达,但对白介素6影响较小。雷林[22]使用1.8 mmol/L NEFA刺激体外培养犊牛肝细胞,证实NEFA可以显著激活内质网应激信号通路。董记红等[19]的研究显示,用1.2 mmol/L NEFA处理原代培养的犊牛肝细胞时,细胞中MDA水平显著升高,而抗氧化酶SOD活性显著下降,与本试验结果相似。综合以上文献基础与细胞毒性试验结果,本试验最终选取了1.2 mmol/L NEFA进行后续试验。氧化应激相关指标检测结果显示,NEFA能显著上调小鼠肝细胞MDA水平,而添加CoQ10后细胞MDA含量明显降低,推测CoQ10对NEFA诱导的细胞氧化损伤有一定的保护效果。细胞中抗氧化酶SOD活性是反映氧化应激状态的重要指标,通常会与细胞中MDA含量联合检测,更准确地反映细胞氧化应激状态。本试验发现,NEFA可以显著降低细胞SOD活力,表明NEFA导致了O·的产生,并超出了SOD的清除能力。而在加入CoQ10干预后,细胞SOD活力较NEFA单独处理显著升高,说明CoQ10能抑制细胞O·产生或激活细胞抗氧化酶活化的相关通路,起到减轻氧化应激的能力,但仍需进一步试验验证。
线粒体是能量产生的主要场所,细胞呼吸产能时会释放ROS,因此,线粒体是ROS产生的主要部位。研究发现,高浓度NEFA也可激活人单核细胞还原型辅酶II产生大量ROS,促使单核细胞发生氧化应激损伤,表明NEFA可通过诱导线粒体产生大量ROS,导致细胞氧化损伤。本试验对ROS的检测和定量分析结果显示,对照组和CoQ10组中仅有少量的绿色荧光,说明氧化还原处于较为平衡状态,但NEFA组中ROS的平均荧光强度较对照组显著增加,表示NEFA诱导产生大量的ROS,而CoQ10+NEFA组细胞ROS荧光强度较NEFA组明显降低,提示CoQ10可以通过减少ROS产生,进而降低NEFA诱导的细胞氧化损伤。综合ROS、SOD活性和MDA含量的变化,说明CoQ10对NEFA诱导的细胞氧化应激损伤有一定保护作用。线粒体跨膜孔通透性和线粒体膜电位与线粒体超微结构密切相关[23]。线粒体的生理超微结构发生改变,会导致ROS、凋亡相关蛋白Cyt-C、Apaf-1、Caspase-3和Caspase-9等的释放,最终导致细胞凋亡。本试验从荧光强度及定量分析发现,NEFA处理肝细胞后,线粒体膜电位明显降低,说明NEFA造成线粒体功能紊乱,而添加CoQ10能稳定线粒体膜电位,减少NEFA导致的线粒体功能紊乱。
综上所述,本试验采用小鼠肝细胞系AML12作为研究对象,通过检测氧化应激指标、ROS活性和线粒体膜电位,证实CoQ10能通过稳定线粒体膜电位、减少ROS释放、提高细胞SOD活性来减弱NEFA诱导的肝细胞氧化应激损伤。本试验为进一步阐述CoQ10对NEFA诱导的氧化应激损伤保护作用机理相关研究提供数据支持,为深入探究人类糖尿病、高酮血症和奶牛酮病等与NEFA相关疾病的治疗提供理论依据。
