组织GLUD1表达与乳腺癌分子分型及临床病理学特征的关系
2022-09-26刘昊灵吴玉丹李贝贝桂忆南
刘昊灵,吴玉丹,李贝贝,赵 玥,王 怡,桂忆南
(联勤保障部队第九八七医院 病理科,陕西 宝鸡721004)
代谢失调是肿瘤发生的一个重要步骤,而谷氨酰胺分解被证明是一种必不可少的代谢途径。肿瘤细胞通过代谢重编程,进而最有效地为自身增殖和生存提供所需的能量,这就使得它们高度依赖于谷氨酰胺的代谢过程[1]。乳腺癌属于高度异质性肿瘤,不同分子亚型的代谢失调水平可能存在很大的差异,因此,观察不同分子亚型乳腺癌的肿瘤代谢特征差异可以进一步指导或预测治疗结局,并为治疗方法提供新的靶点[2]。谷氨酸脱氢酶(GLUD)是谷氨酰胺分解过程中的关键酶,包括2种同工酶,即GLUD1和GLUD2,其中GLUD1不仅是维持三羧酸循环(TAC)的关键酶,而且还在雷帕霉素复合物靶蛋白1(mTORC1)的激活和氧化还原稳态的调节中发挥作用[3]。本研究旨在确定乳腺癌组织中GLUD1 mRNA和蛋白在不同分子亚型中的生物学和临床特征相关性。
1 资料与方法
1.1 临床资料
收集2014年3月—2017年10月期间在联勤保障部队第九八七医院接受乳腺癌手术的145例患者临床资料进行回顾性分析,入选患者年龄19.0-87.0岁,平均年龄为(51.34±15.44)岁。所有患者均根据世界卫生组织2012年病理诊断标准[4]确诊为原发型单侧乳腺癌且病例临床资料完整,入院前未接受过任何治疗。排除以下条件的患者:(1)男性乳腺癌患者;(2)妊娠或哺乳期患者;(3)合并其他部位原发性恶性肿瘤者。术中收集的新鲜组织标本即刻置于液氮中冻存24 h,随后保存在-70℃直至分析。另外部分组织用4%甲醛溶液固定,制备石蜡包埋蜡块,用作病理组织检查或免疫组织化学(IHC)染色。医疗记录和病理报告用来检索关于肿瘤直径、位置、腋窝淋巴结受累等信息,并进行全面的病理学评估,包括侵袭性、组织类型、分级、雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)、Ki67表达状态等。ER和PR核染色率>10%则视为阳性。HER2阳性结果定义为HER2/CEP17荧光原位杂交比≥2.0和(或)IHC得分3+。根据2013年St.Gallen会议[5]通过的标准进行分型,根据ER、PR、HER2状态和Ki-67阳性率,乳腺癌患者分为4种分子亚型:Luminal A型、Luminal B型、HER2过表达型、三阴性。本研究经由本院机构审查委员会批准,符合赫尔辛基宣言。所有参与者均签署书面的知情同意书。
1.2 生物信息学数据分析
使用R 2.15.3软件,利用Epicalc函数包从美国公共癌症基因数据库(TCGA)下载并处理乳腺癌基因组和转录组的数据,对1 085例乳腺癌样本中的GLUD1基因表达进行评估,并且进一步分析了GLUD1基因与ER、PR、HER2受体表达状态的关系。
1.3 实时荧光定量PCR(QPCR)法检测组织GLUD1 mRNA表达
将-80℃环境中的乳腺癌组织及癌旁组织样本根据制造商说明,使用TRIzol试剂(Invitrogen,美国)提取组织总RNA,通过纳米滴吸收光度法检测以确定RNA质量,后续反应仅使用A260/280>2.0的RNA片段。经miScript Ⅱ RT试剂盒(Qiagen公司,德国)逆转录后,使用ABI-prism 7700系统(PE Applied Biosystems,美国)进行RT-qPCR反应,所有样品50℃孵育2 min,95℃孵育10 min,扩增条件为95℃15 s,60℃退火延伸60 s,共40个循环。之后使用Sequence DetectorTM软件(PE Applied Biosystems,美国)根据阈值周期数(threshold cycle number,CT)检测荧光信号,以2-ΔΔCT法计算结果。线虫miR-39作为组织表达的内部标准化控制,所有反应均平行进行三次。GLUD1 mRNA引物序列:上游引物5’-GGG GTA GAG CTG CTT CAC TTT-3’,下游引物5’-AGC CCC GAG GTT GTT GTT TT-3’。
1.4 IHC染色法检测组织GLUD1蛋白表达
用福尔马林固定BC组织及邻近正常组织,石蜡包埋。切片用二甲苯脱蜡,不同浓度的乙醇和ddH2O进行再水化。然后用3%过氧化氢灭活内源性过氧化物酶,并将切片与GUD1一级抗体在4 ℃孵育过夜。在室温下加入二级抗体培养1 h,用链霉亲和素-过氧化物酶复合物检测组织标本。每例标本在光学显微镜下随机观察5个视野的着色情况。使用修正的组织化学评分法(H-score)对IHC染色结果进行判断,在染色强度方面,采用0、1、2、3分别对应于阴性、弱、中、强染色,并主观估计各分值的百分比,另外阳性染色比计分为:0分为无阳性肿瘤细胞;1分为<10%,2分为11%-30%,3分为31%-70%,4分为70%以上。最终计算强度和百分比得分的乘积,免疫反应评分(IRS)是两个参数的乘积。使用这种评估方法,通过测定IRS来评估GDH表达,评分为0、1、2、3、4、6、8、9或12。样本分为以下两组:低(IRS)组为0-4分,高(IRS)组为≥6分(免疫反应评分为0、1、2、3、4、6、8、9或12分,≥6分为高表达,1-4分为低表达,0分为阴性表达)。
1.5 统计学方法
2 结果
2.1 基于TCGA数据库挖掘GLUD1在乳腺癌组织中的表达情况乳腺癌组织中GLUD1 mRNA表达量显著低于正常乳腺组织中的表达量(P<0.05);在1 085例乳腺癌组织中,14例(1.29%)表现为复制数增加,但是有32例(2.95%)表现为复制数减少。另外,756例ER+组乳腺癌组织中,GLUD1 mRNA表达量显著高于228例ER-组组织中的表达量(P<0.05);656例PR+组乳腺癌组织中,GLUD1 mRNA表达量显著高于325例PR-组组织中的表达量(P<0.05),见图1。

图1 基于TCGA数据库分析GLUD1 mRNA在乳腺癌组织中的表达情况
2.2 乳腺癌患者不同组织中GLUD1 mRNA以及GLUD1蛋白表达比较经QPCR法检测,乳腺癌组织中GLUD1 mRNA表达量显著低于癌旁乳腺组织(1.00±0.17 vs.0.63±0.27,P<0.05)。同时经IHC染色法检测,GLUD1蛋白主要表达于肿瘤细胞的胞浆中,肿瘤组织中GLUD1蛋白高表达率显著低于癌旁乳腺组织[28.28%(41/145)vs.53.79%(78/145),P<0.05,图2]。另外GLUD1蛋白阳性表达组织中GLUD1 mRNA表达量高于阴性表达组织(P<0.05),经Pearson法分析,GLUD1蛋白表达与GLUD1 mRNA表达量呈显著正相关性(相关系数为0.735,P<0.001)。

图2 乳腺癌组织中GLUD1蛋白的表达
2.3 乳腺癌患者组织GLUD1蛋白表达与临床病理学特征的关系经单因素分析,乳腺癌组织GLUD1蛋白表达与临床T分期、N分期、肿瘤分级、ER和PR表达状态有关(P<0.05),见表1。

表1 乳腺癌患者组织GLUD1蛋白表达与临床病理特征的关系[n(%)]
2.4 不同分子分型患者组织GLUD1 mRNA和GLUD1蛋白表达比较比较不同分子亚型中GLUD1 mRNA和GLUD1蛋白表达水平时,发现在Luminal A型及Luminal B型中GLUD1 mRNA和蛋白表达较其他分子分型高,差异有统计学意义(P<0.05),见表2。
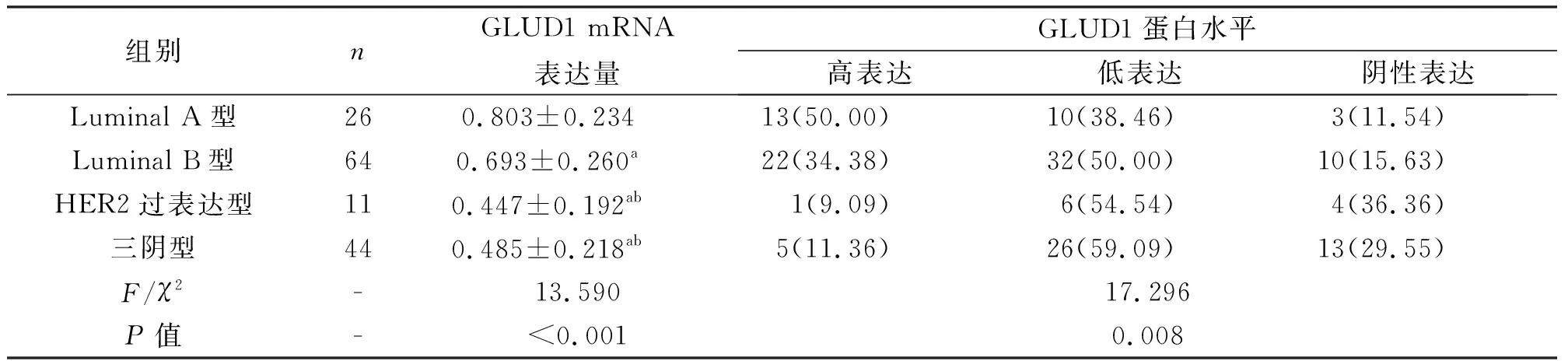
表2 不同分子分型患者组织GLUD1 mRNA和GLUD1蛋白表达分析
3 讨论
目前临床对乳腺癌异质性的研究逐渐深入,异质性与基因组学、转录组学、肿瘤微环境均密切相关,谷氨酰胺分解被证明是维持细胞增殖和存活的一种必需代谢途径[6]。在乳腺癌中,不同分子亚型之间存在一定的代谢差异性,本研究发现GLUD1在mRNA和蛋白水平上表达量均下调,尤其是在高分级(Ⅲ级)和三阴性或HER2过表达型乳腺癌的肿瘤组织中。
根据最新报告的癌症统计数据,2019年新增乳腺癌病例约占全部癌症病例的30%左右,根据受体(ER、PR、HER2)表达状态,高达70% 的乳腺癌被归类为ER阳性,这意味着雌激素在乳腺癌的发展中起着关键作用[7]。因此,ER信号传导通路成为大多数乳腺癌患者开发新疗法的潜在靶点。例如Wang等学者[8]通过整合TCGA和Metabric公共数据库中的信息确定了部分与ER+相关的氨基酸代谢限速酶,证实ER+乳腺癌的预后与氨基酸代谢的限速基因及其下游网络之间存在密切联系,例如氨基酸转运蛋白的活性增加、牛磺酸和次牛磺酸、丙氨酸、天冬氨酸、谷氨酸代谢途径失调等。因此氨基酸代谢谱的差异能够区分ER+和ER-性乳腺癌。关于GLUD1对谷氨酰胺代谢潜在影响的研究仍然有限。因此,本研究首先基于TCGA数据库信息,利用大量乳腺肿瘤的基因组、转录组和蛋白质组水平研究了GLUD1,以便更好地了解GLUD1在乳腺癌及其分子亚型中的潜在作用。结果显示乳腺癌组织中GLUD1 mRNA表达量显著低于正常乳腺组织;在1085例乳腺癌组织中,14例(1.29%)表现为复制数增加,但是有32例(2.95%)表现为复制数减少。另外,ER+组乳腺癌组织中GLUD1 mRNA表达量显著高于ER-组组织中的表达量,同样PR+组乳腺癌组织中GLUD1 mRNA表达量显著高于PR-组组织中的表达量(P<0.05),本研究结果与其基本一致。本研究中发现在Luminal A型及Luminal B型中GLUD1 mRNA和GLUD1蛋白表达量较其他分子分型较高,说明检测GLUD1表达可以有助于区分不同分子亚型的乳腺癌组织,但本研究中并未追踪患者的治疗效果,不能证明GLUD1表达是否与患者预后或治疗反应有关,这也是本研究的局限性之一。
肿瘤细胞具有无限分裂和持续生长的潜力。这个过程依赖于从饥饿和缺氧的微环境中获取必需的营养成分。肿瘤细胞的代谢修正能力取决于它们在肿瘤微环境中通过细胞内基因表达和细胞间相互作用改变合成和分解代谢途径的能力。氨基酸是蛋白质合成能量和代谢物的来源,氨基酸降解酶的过度表达已经在许多癌症中被检测到[9]。例如Spinelli等学者[10]认为GLUD催化的氨同化作用会刺激乳腺癌细胞的增殖与生长,同时癌细胞主要通过GLUD催化的还原胺化作用吸收氨,其次反应可以使其他氨基酸直接获取氮,为乳腺癌新陈代谢提供氮源。降解的氨基酸为细胞能量和合成代谢过程提供代谢产物,也是癌细胞免疫逃避的调节剂。在肿瘤微环境中,吲哚胺-2,3-双加氧酶和精氨酸酶的高表达分别导致色氨酸和精氨酸的缺失。降低色氨酸和精氨酸水平抑制肿瘤细胞毒性T细胞增殖[11]。乳腺癌细胞通过使用氨基酸降解酶作为免疫抑制因子来提高其生存能力。其中一些氨基酸相关基因编码与代谢病相关的限速酶。在本研究中,乳腺癌组织中GLUD1 mRNA表达量与GLUD1蛋白表达量呈正相关性,说明GLUD1蛋白的表达受到GLUD1 mRNA的调控。而GLUD1在蛋白水平上参与乳腺癌细胞的恶性化进展并不令人惊讶。GLUD1是谷氨酰胺分解第二脱氨基阶段的关键酶,它被亮氨酸激活,使谷氨酸脱氨到α-酮戊二酸,然后并入TCA循环,这是增殖细胞中的一个关键的过程[12]。亮氨酸可激活mTORC1,该蛋白在肿瘤细胞中具有多种功能,包括调节蛋白质转化、防止细胞凋亡和肿瘤细胞增殖[13]。一些研究也已经证实了谷氨酰胺分解在mTOR信号通路中的重要性,当mTORC1被过度激活时,它被认为在促进癌细胞生长和增殖方面有重要作用。mTORC1是两种多蛋白复合物之一,受多种上行信号调节,包括生长因子和营养物质,如氨基酸和葡萄糖。亮氨酸被认为是mTORC1的关键激活因子,它通过刺激 RagA/B复合体的GTP状态,进而将mTORC1吸收到蛋白质中,在蛋白质中被溶酶体结合蛋白Rheb激活[14]。谷氨酰胺也被认为是mTORC1信号传导的重要氨基酸,因为它可以通过增加亮氨酸的摄取间接刺激这一途径。例如Duran等[15]证明,谷氨酰胺与亮氨酸结合,增加了Ragb基因表达,促进了GLUD1的激活,增强了谷氨酰胺分解和α-酮戊二酸的合成。由于亮氨酸直接结合并调节谷氨酸转化为α-酮戊二酸,因此GLUD1可能是通过调节mTORC1信号转导通路影响肿瘤细胞的增殖,因此据上述实验结论推断,GLUD1有望成为乳腺癌治疗的新靶点。但是GLUD1影响肿瘤细胞生存的作用机制尚不明确,这就需要在将来的研究工作中对其进行更深入的分析,从而为临床转化提供更可靠的理论基础。
综上所述,乳腺癌患者肿瘤组织中GLUD1 mRNA表达量及GLUD1蛋白高表达率均较癌旁组织普遍降低,尤其是多见于恶性化程度更高或ER-/PR-乳腺癌组织中,这有望成为指导乳腺癌个性化治疗的新靶点。
