免疫检查点抑制剂相关自身免疫性脑炎2例并文献复习
2022-09-26王秀婷谷洁冰韩雪梅
汪 娣,王秀婷,于 乐,谷洁冰,韩雪梅
(吉林大学中日联谊医院 神经内科一病区,吉林 长春130033)
1 临床资料
病例1:患者女性,53岁,因“反应迟钝1个月,加重10天”就诊。家属代诉于入院前1个月出现反应迟钝,情绪改变,易怒,近记忆力差;病情进行性加重,出现头晕及走路不稳,伴嗜睡。既往右肺小细胞肺癌病史9个月,[HLX10(重组抗PD-1人源化单克隆抗体注射液)+依托泊苷+卡铂]方案联合4个周期,[HLX10]单药方案5个周期。入院查体:生命体征平稳,嗜睡,言语缓慢,反应迟钝,MOCA量表:11分,MMSE量表:12分,四肢肌力IV级,昂白氏征(+),双侧病理征(-),余神经系统查体不配合。辅助检查:头部核磁共振(MRI)平扫+增强:双侧丘脑、海马等或稍长T1、稍长T2、FLAIR高信号影,增强未见强化(见图1)。脑脊液检查:压力120 mmH2O,白细胞计数16×106/L,白细胞分类:单核97%、多核3%,细胞学检查未发现肿瘤细胞。血清副肿瘤综合征自身抗体谱:抗Hu抗体IgG(+);脑脊液自身免疫性脑炎自身抗体谱(-);血清、脑脊液中枢神经系统脱髓鞘抗体(-),寡克隆区带(-),脑脊液二代测序(-)。视频脑电图:可见大量不规则慢波,双侧额、颞区可见大量不规则的δ波活动。余实验室检查未见明显异常。临床诊断:免疫检查点抑制剂(ICI)相关自身免疫性脑炎,右肺小细胞肺癌IV期(广泛期)。治疗与转归:大剂量激素冲击治疗并逐渐递减;联合静脉注射人免疫球蛋白(0.4 g/kg,1/日)5天。出院前患者头晕、嗜睡及走路不稳症状较前改善;复查头颅核磁双侧丘脑、海马病灶范围较前缩小(见图2)。

图1 患者1头部MRI平扫+增强图像(双侧丘脑、海马等或稍长T1、稍长T2、FLAIR高信号影,增强未见强化)
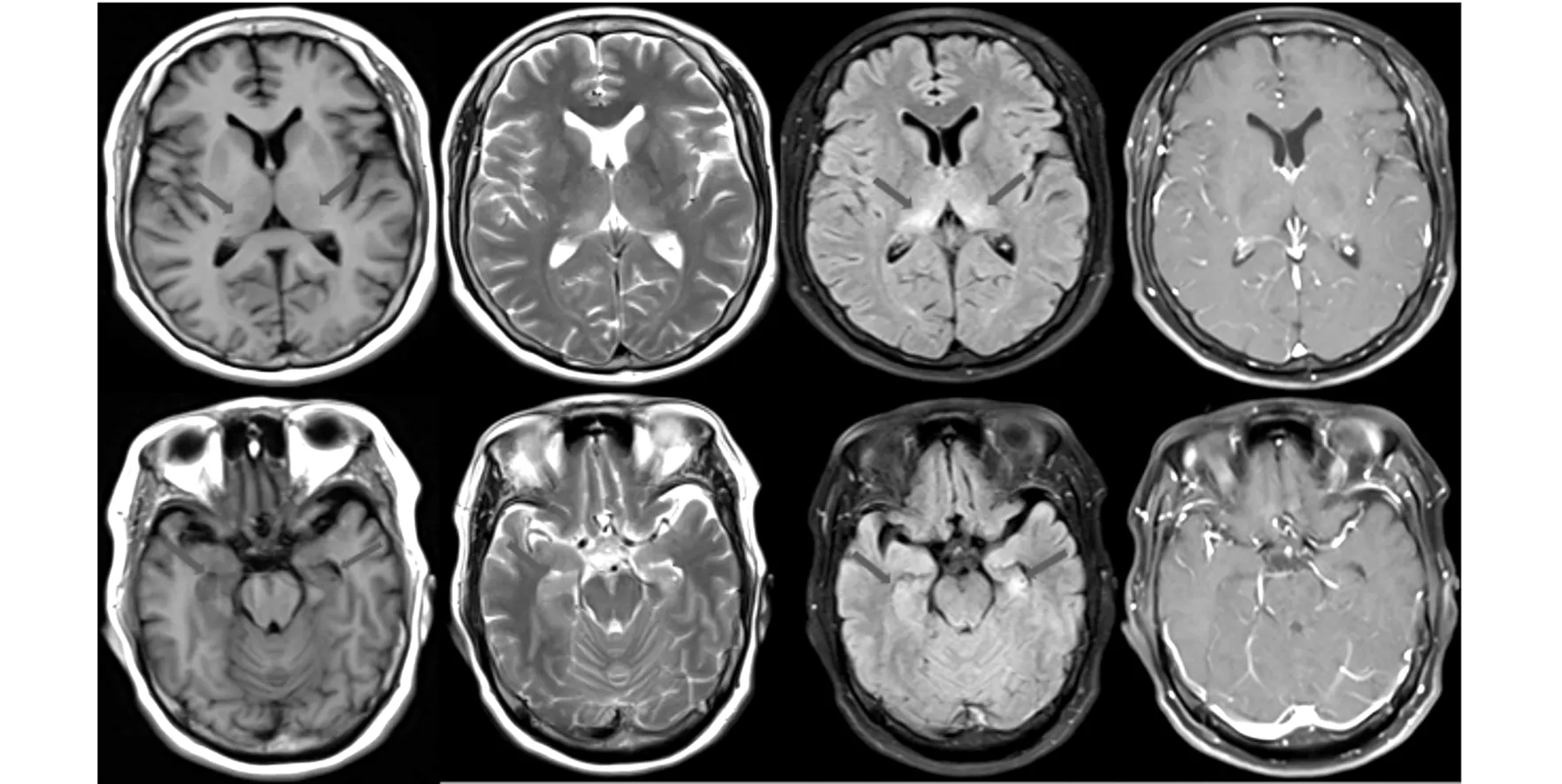
图2 患者1复查头颅MRI图像(双侧丘脑、海马病灶范围较前缩小)
病例2:患者女性,71岁,因“反应迟钝伴言语笨拙3个月,加重1天”就诊。家属代诉于入院前3个月出现反应迟钝,言语减少,1天前上述症状加重,出现答非所问,吐字不清,走路不稳,伴嗜睡。既往左肺腺癌病史3年,规律应用抗PD-1抗体治疗。入院查体:生命体征平稳,嗜睡,意识模糊,构音障碍,四肢肌力Ⅳ级,双侧病理征(+),余神经系统查体不配合。辅助检查:头部核磁共振(MRI)平扫+弥散成像(DWI)+增强示:脑桥、双侧枕叶、颞叶、海马、丘脑、基底节、放射冠、额顶叶等或稍长T1、长T2、FLAIR高信号影;DWI未见异常信号;增强未见强化(见图3)。脑脊液检查:压力115 mmH2O;潘氏试验(+),蛋白1.80 g/L,白细胞计数8×106/L;细胞学检查未发现肿瘤细胞。血清自身免疫性脑炎自身抗体谱:LGI1抗体IgG阳性1:100+;脑脊液自身免疫性脑炎自身抗体谱:LGI1抗体IgG阳性1:1+;血清副肿瘤综合征自身抗体谱:抗Yo抗体IgG灰区(5AU);脑脊液副肿瘤综合征自身抗体谱(-);血清、脑脊液中枢神经系统脱髓鞘抗体(-),寡克隆带(-),脑脊液二代测序(-)。视频脑电图:广泛性不规则低波幅的混合慢波活动,双侧颞区可见较多高波幅尖波、尖慢波发放。余实验室检查未见明显异常。临床诊断:免疫检查点抑制剂相关自身免疫性脑炎,左肺腺癌。治疗与转归:大剂量激素冲击治疗并逐渐递减;联合静脉注射人免疫球蛋白(0.4 g/kg,1/日)5天。出院前患者嗜睡及意识模糊较前改善。

图3 患者2头部MRI平扫+DWI+增强图像(脑桥、双侧枕叶、颞叶、海马、丘脑、基底节、放冠、额顶叶等或稍长T1、长T2、FLAIR高信号影;DWI未见异常信号;增强未见强化)
2 讨论
本文报道的2例规律应用免疫检查点抑制剂期间出现反应迟钝、记忆力下降等高级神经功能障碍的病例,均符合可能的自身免疫性脑炎诊断标准[1],完善相关检查后诊断为免疫检查点抑制剂相关自身免疫性脑炎。
ICI是一种新型的肿瘤治疗药物,对黑色素瘤、肾细胞癌、非小细胞肺癌等有显著的临床疗效;通过阻断细胞毒性T淋巴细胞抗原(CTLA-4)、程序性细胞死亡蛋白1(PD-1)、程序性细胞死亡配体1(PD-L1)免疫检查点通路,重新激活T细胞介导的抗肿瘤免疫,逆转免疫逃逸现象,从而促进肿瘤细胞死亡[2]。近来,ICI对小细胞肺癌治疗的相关研究成为了新的焦点,有可能为小细胞肺癌患者带来了新的希望[3]。
通常情况下,免疫检查点(IC)可防止免疫系统过度活化,而应用ICI后免疫系统过度活化,可引起免疫相关不良事件(irAE)[4]。irAE可以涉及各个器官或系统,其中神经系统n-irAE较罕见,约占1%,但仍应引起重视,如不尽早发现及治疗则是致残或致命的;在一项对428例患者中的系统评价中报告了n-irAE包括:脑炎(13%)、无菌性脑膜炎(3%)、中枢神经系统脱髓鞘疾病(2%)、颅脑神经病变(7%)、脊髓炎(2%)、吉兰-巴雷综合征(GBS)和其他周围神经病变(22%)、肌无力综合征(14%)、肌炎(32%)和其他综合征(中枢神经系统综合征未明确说明)(6%)[5]。
ICI相关自身免疫性脑炎的病理生理学机制有待进一步研究,目前认为有以下几种潜在的机制:①肿瘤和正常组织的交叉免疫反应:ICI增强T细胞对抗原的活性,而T细胞可识别在肿瘤细胞和健康组织上共同表达的抗原,这与典型的副肿瘤综合征机制相似;②免疫细胞的变化:ICI可导致体内预先存在的自身抗体滴度升高,随后识别和靶向正常组织上表达的抗原;促炎因子水平的升高也发挥重要作用;③神经系统副肿瘤综合征加重为n-irAE;④ICI通过补体依赖性或细胞依赖性的细胞毒作用直接诱导局部损伤;⑤特定肠道微生物与免疫系统的相互作用;⑥遗传因素[6-8]。
ICI相关自身免疫性脑炎的临床表现多样化、无特异性,接受ICI治疗的患者出现癫痫发作、精神行为异常,认知功能障碍、言语功能障碍、意识水平下降等均应考虑ICI相关自身免疫性脑炎的可能[7]。神经影像学可无异常表现,神经影像学异常多表现为:头部MRI单侧或双侧T2或FLAIR异常征象(除外非特异性白质改变和卒中)或PET上的边缘系统、皮质和(或)基底节的高代谢[1]。本文中2例患者神经影像学表现符合上述神经影像学表现。也可有脑电图异常:局灶性癫痫或者癫痫样放电,或者弥漫性、多灶性分布的慢波节律。本文中2例患者视频脑电图结果符合上述脑电图异常表现。脑脊液可提示白细胞增多(>5×106/L);或细胞学表现为淋巴细胞性炎症;或脑脊液寡克隆区带阳性;或抗神经元抗体阳性[7];本文中2例患者脑脊液结果符合自身免疫性脑炎的脑脊液特点。本文中两个案例都在接受ICI治疗后出现相应症状,结合影像学、脑脊液等相关检查考虑ICI相关自身免疫性脑炎;患者有副肿瘤综合征自身抗体阳性,认为副肿瘤综合征自身抗体可能是ICI引起患者自身免疫激活而诱发或者患者早期存在相关抗体,而在应用ICI后出现自身免疫激活,进而加速了自身免疫疾病的进程,出现了相应症状;神经系统副肿瘤综合征与ICI相关自身免疫性脑炎的关系尚不清晰,有报道发现存在自身抗体(Hu抗体等)的患者接受ICI治疗后可增加出现自身免疫性脑炎的几率[9-11];也有实验研究表明 ICI可以诱发神经系统副肿瘤综合征[12]。副肿瘤综合征的神经系统症状通常发生于肿瘤发现之前,而本文中2例患者均在应用ICI后发生,临床诊断更倾向于免疫检查点抑制剂相关自身免疫性脑炎。
接受ICI治疗后出现非特异性神经精神症状的患者,应尽快排除中枢转移、感染、脑血管病等因素,及早给予免疫治疗。目前皮质类固醇为n-irAE的一线治疗,也可单独或与皮质类固醇联合使用静脉注射免疫球蛋白、血浆置换;二线治疗:利妥昔单抗、静脉用环磷酰胺;长程治疗:吗替麦考酚酯、硫唑嘌呤等[1,8,13]。本文中2例患者均通过影像学、脑脊液等方法排除相关因素后及早给予了大剂量激素冲击治疗并逐渐递减;联合静脉注射人免疫球蛋白(0.4 g/kg,1/日)5天;2例患者症状均明显好转。
患者出现irAE通常需要暂时停用ICI,仅对最严重的irAE永久停用ICI,患者首次出现irAE后是否继续应用ICI治疗及再次应用ICI后是否会引起irAE复发成为了新的讨论方向,有研究发现首次出现irAE 后停止 ICI治疗的患者中,约有四分之一至三分之一的患者在再次使用相同 ICI后出现相同的 irAE,4.4% 的患者发生了不同的 irAE[14]。随机研究表明,患有 irAE 的患者在 ICI 停药后可能会有良好的治疗效果[15-16]。因此,患有久治不愈的irAE的患者可能不建议再次使用 ICI 作为维持治疗,但仍需要更多的前瞻性研究来验证。因出现 irAE 而停用 ICI 后,肿瘤病情进展的患者发现再次启用ICI 可能是有益的。目前再次启用ICI的利弊缺乏相关研究,因此在临床工作中应根据患者病情提出个性化方案。
ICI作为新型热门肿瘤治疗药物,因其效果显著,越来越多的患者接受ICI治疗,要注意监测患者在应用ICI期间出现的不良反应,如出现相应症状,应尽早完善相关检查并及时治疗,预防n-irAE所带来的严重后果。
