谷氨酰胺对骨肽药物促UMR106细胞增殖试验的影响
2022-09-17张媛纳涛吴彦霖杨泽岸高华
张媛,纳涛,吴彦霖,杨泽岸,高华
中国食品药品检定研究院,北京 102629
骨肽是从新鲜或冷冻的猪、鹿等哺乳动物骨中提取,加工制成的具有活性的多组分生化药[1-2],内含骨形成蛋白等多种骨代谢活性因子,以及骨修复所需的无机元素、微量元素等[3-4]。骨肽具有调节骨代谢、刺激成骨细胞增殖、促进新骨形成等药理作用[5-6]。骨肽类药物相关品种的质量标准主要收载于国家标准地升部十六册,未包含生物活性测定项目,仅采用双缩脲法或福林酚法检测含量[7-8],而这两种方法对动植物中含有肽键的多肽均可产生反应,专属性差。为了进一步完善骨肽药物的质量可控性,使现有质量标准的评价更全面、合理,本实验室建立了骨肽生物活性测定的UMR106细胞增殖试验[9]。该方法可简便、高效、稳定地测定骨肽类药物的生物活性。但由于UMR106细胞增殖试验使用的培养基为不含谷氨酰胺的DMEM高糖培养基[9],而谷氨酰胺是培养细胞的重要能量来源,参与细胞蛋白质的合成及核酸代谢。因此,本研究针对谷氨酰胺是否影响UMR106细胞增殖试验进行探讨,以期对本方法进行完善。
1 材料与方法
1.1 骨肽及细胞13个生产厂家(厂家A~M)的骨肽原液各1批,骨肽含量分别为60、62、68.6、26.7、87.4、31.0、90.0、14.0、25.8、19.1、21.4、49.3、7.4 mg/mL;大鼠骨肉瘤细胞株(UMR106)购自美国ATCC(American TypeCulture Collection)。
1.2 主要试剂及仪器CCK-8试剂盒购自东仁化学科技(上海)有限公司;谷氨酰胺、胎牛血清、DMEM高糖培养基、胰酶购自美国GIBCO公司;磷酸盐缓冲液购自美国Hyclone公司;乙腈(质谱级)购自美国Fisher Chemical公司;甲酸(质谱级)购自美国Sigma-Aldrich公司;Nexera UHPLC LC-30A型超高效液相色谱仪购自日本岛津(SHIMADZU);WATERS ACQUITY UPLC Column色谱柱,型号:ACQ-UITY UPLC BEH HILIC Column(1.7 μm,2.1 mm×100 mm)购自美国WATERS公司;Triple TOF 5600+型质谱仪购自美国AB SCIEX公司;Z2型细胞计数仪购自美国Beckman Coulter;SYNERGY HT型酶标仪购自美国BioTek公司。
1.3 超高效液相色谱条件 色谱柱:WATERS ACQUITY UPLC Column,型号:ACQUITY UPLC BEH HILIC Column(1.7 μm,2.1 mm×100 mm);柱温35℃;流动相:A为100%乙腈,B为0.1%甲酸水溶液。采用梯度洗脱,洗脱程序见表1[10-12]。

表1 超高效液相色谱梯度洗脱程序(%)Tab.1 Elution program in ultra performance liquid chromatography(%)
1.4 质谱条件 质谱扫描采用positive模式。ESI源条件如下:离子源气流1(ion source gas 1):50;离子源气流2(ion source gas 2):50;气帘气(curtain gas):25;温度(source tempreture):500℃;电压(ion sapary voltage floating):5 500 V(正离子);一级扫描范围(TOF MS scan range):50~200 Da;二级扫描范围(product ion scan range):50~200 Da;二级质谱采用IDA(information dependent acquisition)获得,并采用high sensitivity模式;去簇电压(declustering potential):±60 V;碎裂能量(collision energy):(35±15)eV[10-12]。
1.5 骨肽原液中谷氨酰胺含量的检测 以不同浓度的谷氨酰胺(13.1、26.2、65.5、105.0、131.0 ng/mL)为横坐标,对应的峰面积为纵坐标,绘制标准曲线。采用液质联用,按照1.3和1.4项条件,检测骨肽原液中谷氨酰胺含量。
1.6 谷氨酰胺对UMR106细胞增殖影响的检测采用UMR106细胞增殖试验。取对数生长期的UMR106细胞,0.25% Trypsin消化后,用含2.5%FBS的DMEM培养基稀释成细胞悬液,浓度为5×104cells/mL。每孔加入100 μL,即5 000 cells/孔,置37℃,5% CO2培养24 h;弃孔内培养基,加入含不同浓度(3.9、7.8、15.6、31.2、62.4、125、250、500、1 000、2 000、4 000和8 000 μmol/L)谷氨酰胺的DMEM培养基,阴性对照为不含谷氨酰胺的培养基,均100 μL/孔,继续培养72 h;CCK-8法进行检测[9,13]。
1.7 骨肽原液生物活性检测 采用UMR106细胞增殖试验,方法同1.6项。细胞铺板培养24 h后,弃孔内培养基,加入含1.0 mg/mL骨肽原液的的DMEM培养基,100 μL/孔,继续培养72 h;CCK-8法进行检测。
1.8 统计学分析 应用Graphpad统计软件进行相关性分析,以P<0.05为差异有统计学意义,具有显著相关性。
2 结果
2.1 骨肽原液中谷氨酰胺含量 获得的标准曲线为y=1 948.83 x-7 658.22,r=0.996 38,见图1。13个生产厂家骨肽原液中谷氨酰胺含量差距较大,B厂家含量最低,为2.17 μmol/L,L厂家最高,为135.48 μmol/L。见表2。其中13个厂家骨肽原液中谷氨酰胺试验应用浓度为骨肽原液浓度1 mg/mL所对应的谷氨酰胺浓度,即骨肽原液中谷氨酰胺浓度/骨肽原液浓度。

表2 13个生产厂家骨肽原液中谷氨酰胺含量Tab.3 Glutamine contents of bulks of osteopeptide from 13 manufacturers
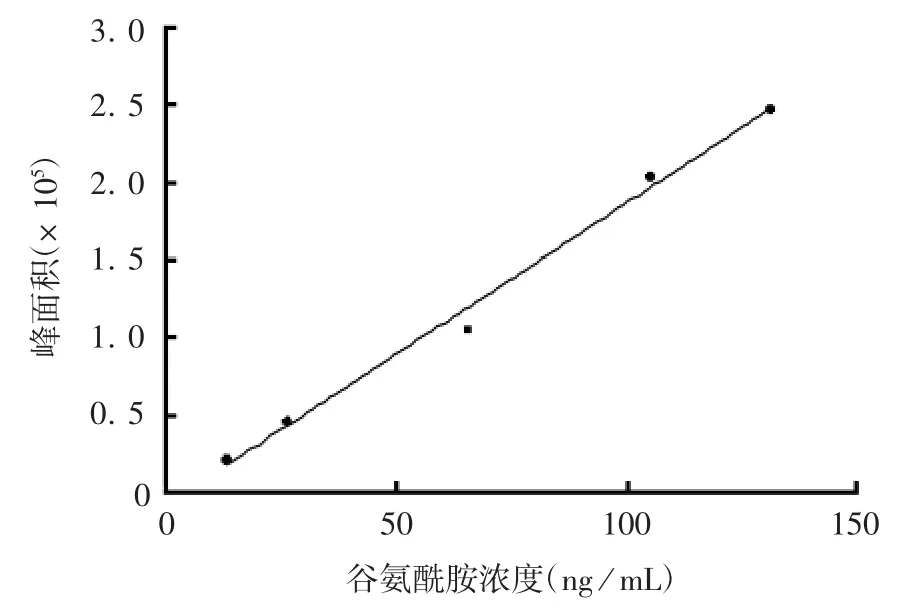
图1 谷氨酰胺标准曲线Fig.1 Standard curve for determination of glutamine by LCMS
2.2 骨肽原液浓度与相应谷氨酰胺浓度的相关性 结果显示,二者间无显著相关性(r=0.146 3,P>0.05)。见图2。
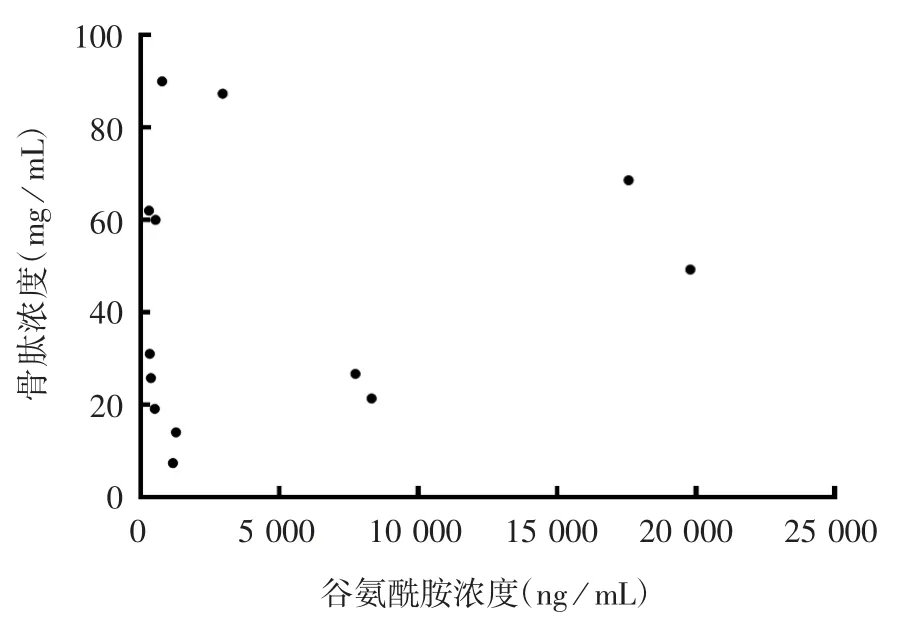
图2 骨肽原液浓度及其相应谷氨酰胺浓度的相关性分析Fig.2 Correlation between osteopeptide concentration and the corresponding glutamine concentration
2.3 谷氨酰胺对UMR106细胞增殖的影响 结果显示,UMR106细胞对谷氨酰胺较为敏感,3.9、7.8、15.6、31.2、62.4、125、250、500、1 000、2 000、4 000和8 000 μmol/L谷氨酰胺对UMR106细胞的增殖率分别为105%、10%、113%、126%、152%、198%、225%、283%、336%、433%、445%和455%,即至谷氨酰胺浓度降至约4 μmol/L时,才未显示出明显的促增殖作用。而13个生产厂家的骨肽原液中谷氨酰胺试验应用浓度,即折合成骨肽原液浓度1 mg/mL所对应的谷氨酰胺浓度,均低于4 μmol/L,其中以L厂家最高,浓度为2.75 μmol/L。
2.4 骨肽原液生物活性 结果显示,不同厂家骨肽原液促UMR106细胞增殖率具有明显差异。13个厂家骨肽原液中谷氨酰胺试验应用浓度与相应细胞增殖率无显著相关性(r=0.547 1,P>0.05)。见图3。

图3 骨肽原液谷氨酰胺试验应用浓度与相应细胞增殖率相关性分析Fig.3 Correlation between working concentration of glutamine in bulk of osteopeptide and the corresponding cell proliferation rate
3 讨论
UMR106细胞增殖试验作为骨肽类药物生物活性测定的方法,可真实反应骨肽类药物的生物活性[14-15]。但该方法使用不含谷氨酰胺的培养基进行细胞培养,而谷氨酰胺是动物细胞培养中的一种必需氨基酸[16-17],可作为细胞生长的主要能源和氮源,并参与合成嘌呤、嘧啶、蛋白质和多肽[18-20]。因此,有必要考察谷氨酰胺对UMR106细胞增殖试验的影响。本研究结果表明,13个生产厂家的骨肽原液中均含有不同浓度的谷氨酰胺,且差异较大,但与骨肽浓度无显著相关性。而UMR106细胞增殖对谷氨酰胺较为敏感,谷氨酰胺浓度降低至约4 μmol/L时,对UMR106细胞才未显示出明显的促增殖作用。13个生产厂家的骨肽原液中谷氨酰胺试验应用浓度,即折合成骨肽原液浓度1 mg/mL所对应的谷氨酰胺浓度,均低于4 μmol/L,最高浓度仅为2.75 μmol/L,且与相应的细胞增殖结果无显著相关性。综上所述,骨肽原液中自带的谷氨酰胺并不会对骨肽生物活性测定方法——UMR106细胞增殖试验产生影响。但鉴于谷氨酰胺对UMR106细胞增殖影响较为明显,建议在使用该方法测定骨肽生物活性时,同时测定骨肽样品中谷氨酰胺的含量,要求1 mg/mL骨肽样品中所对应的谷氨酰胺浓度不高于4 μmol/L,从而防止相关骨肽样品中添加过高含量的谷氨酰胺影响测定结果。
