“嗅三针”对蛛网膜下腔出血后认知障碍大鼠海马GSK-3β、Caspase-3蛋白表达的影响
2022-09-15孙子昕雷正权
邓 茹,杨 强,周 锋,王 强,孙子昕,雷正权
(1.西安交通大学医学院附属三二〇一医院,陕西 西安 710000;2.陕西中医药大学附属医院,陕西 咸阳 711300;3.陕西中医药大学,陕西 咸阳 711300)
蛛网膜下腔出血(Subarachnoid hemorrhage,SAH)是神经外科常见急症之一,随着现在医疗技术的突飞猛进,其死亡率和致残率较以前有所下降,但蛛网膜下腔出血后患者长期存在的认知功能障碍却往往容易被人们忽视,其主要表现为学习记忆受损、执行功能发生障碍和注意力控制效率低下等;据调查,在全球范围内,每年将近有500多万人患有SAH,虽经及时治疗可挽救一些生命,但仍有46%~60%的SAH患者在治愈后会出现认知功能低下的情况[1-2],伴随着生活节奏的逐渐加快,SAH的发病率呈上升趋势,目前也尚未发现治疗该病的特效药物及方法[3-4]。蛛网膜下腔出血后脑神经细胞的生理病理变化过程较为复杂,包括颅内压和脑血流灌注异常、血脑屏障受损、氧化应激损伤、神经细胞凋亡及炎症反应等[5-7],对其相关机制的进一步研究及寻找行之有效的治疗方法是目前神经系统研究的重点和热点。本课题组团队早期研究证实[8-10],“嗅三针”对改善大鼠认知功能方面具有一定的潜能,能够延缓认知状态的进展,促进神经功能恢复。本研究通过行为学检测干预效果,观察海马神经元细胞形态变化、海马区凋亡相关蛋白糖原合酶激酶-3β(GSK-3β)和半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)表达,以探讨“嗅三针”干预对蛛网膜下腔出血后认知障碍(SAH CI)大鼠保护的可能作用机制。
1 材料与方法
1.1 实验动物与分组
成年雄性SD大鼠32只,体质量225~265 g,SPF级,皆从成都达硕实验中心购买,许可证编号:SCXK(川)2020-030,在陕西省针药结合中心重点实验室饲养,实验饲养条件:温度(22±2)℃,湿度50%~60%,该实验严格遵守实验动物管理和保护规则。应用随机数字表法将大鼠随机分为4组:空白组、假手术组、模型组与嗅三针组,每组8只。
1.2 主要仪器与试剂
1.2.1 仪器 Western电泳仪(美国Bio-Rad公司伯乐1645050);酶标仪(Molecular Devices公司Spectra MAX5);低温高速离心机(德国Hettich公司Mikro185);组织全自动脱水机、石蜡包埋机和组织切片机(科迪仪器设备有限公司KD-TS3A,KD-BM.KD-2268);Morris水迷宫测试系统(诺达思信息技术有限责任公司Water-Maze);电针治疗仪(上海华谊公司G6805-2A)。
1.2.2 试剂 Caspase-3抗体(美国abcam EPR18297);GSK-3β抗体(美国abcam 3D10);β-Actin抗体(北京康为世纪CW0096M);高效RIPA裂解液(北京索莱宝科技公司R0010);山羊抗鼠lgG(H+L)(北京天德悦生物科技有限公司S001F);山羊抗兔lgG(H+L)(北京天德悦生物科技有限公司S004F);苏木-伊红染色试剂盒(北京索莱宝科技公司G1120);SDS-PAGE凝胶制备试剂盒(武汉博士德生物工程有限公司AR0138);Bradford蛋白浓度测定试剂盒(武汉博士德生物工程有限公司AR0145);ECL化学发光底物(广州赛国生物科技有限公司WBKLS0100)。
1.3 模型制备与评定方法
模型组、嗅三针组采用枕大池注血法[11]制备蛛网膜下腔出血后认知障碍大鼠模型。造模前大鼠禁食12 h,以10%的水合氯醛(0.32 mL/100 g)腹腔注射麻醉后,剔除大鼠头部及左侧股动脉部位的鼠毛,用碘酒常规消毒后,取大鼠俯卧位,以枕外隆凸为中点取约1 cm的直切口,缓慢分离皮下筋膜,暴露颈夹肌间隙,显微剪稍分离,暴露枕骨脊间隙后;将大鼠改仰卧位,股动脉区常规消毒,沿股动脉走行切开皮肤,仔细分离出股动脉,用1 mL注射器抽取股动脉血0.3~0.4 mL,无菌棉球压迫止血后,改俯卧位,使头部与身体成大约135 °,注射器进针时与身体平行,从枕骨大孔处刺破环枕筋膜,有透空感后缓慢推进至枕大池处,将血液在2 min内注入枕大池,俯卧位使其头低30°保持20 min,使血液分布于基底动脉周围。完成后缝合头部及股部切口,待苏醒后放入单笼常规喂养,并连续3 d予以常规抗感染干预(腹腔注射硫酸庆大霉素0.5 mg/100 g)。假手术组大鼠仅切开头部和股部皮肤,然后缝合,具体手术方法同制备以上模型;空白组常规喂养,不做任何处理。
蛛网膜下腔出血后认知障碍模型大鼠造模成功的标准[12]:以空白组大鼠定位航行实验逃避潜伏期的平均值作为参考值,计算造模大鼠逃避潜伏期平均值与参考值之差占该鼠平均逃避潜伏期的比值,若该值>20%,则认为蛛网膜下腔出血后认知障碍模型大鼠造模成功。
1.4 干预方法
假手术组、模型组于相同时间采用与嗅三针组相同方法抓取、固定,空白组不予干预。
嗅三针组在造模成功后第1天开始进行电针干预,依据《实验针灸学》动物选穴标准[13],取“印堂”、双侧“迎香”。将大鼠固定于大鼠固定架上,常规消毒后,选用0.25 mm×25 mm华佗牌不锈钢针,迎香穴向内上方斜刺0.3 cm,印堂穴向鼻根部平刺0.3 cm,针刺完后,连接G6805-2A型电针治疗仪,选用0.5~2 mA疏密波,频率为2~15 Hz,印堂穴接正极,一侧迎香穴接负极,10 min后,换另一侧迎香穴接负极,再给予10 min电针刺激,1次/d,连续针刺10 d。
1.5 行为学检测
本实验的行为学主要采用Morris水迷宫测试[14-15],分别在各组大鼠造模前和造模结束后第11天,及针刺干预结束后第1天起,借助Morris水迷宫实验通过定位航行实验和空间探索实验记录各组大鼠逃避潜伏期和穿越平台次数,对数据进行分析,评估大鼠学习记忆能力;该实验用的游泳水池是直径为120 cm、高为50 cm及水深22 cm的圆形水池和直径为10 cm、高为20 cm的圆形平台,平台可随意放置任何一象限,平台没于水下2 cm左右,池壁上4个等距离点将水池平均分为4个象限,池壁外标有4个入水点,水池外围柱子有不同的标记物,整个实验过程中要保持周围参照物环境不变,光照适宜,水温控制在22~25 ℃,由于实验所用SD大鼠均为白色,为保证摄像系统的定位跟踪和图像采集,在水池中加入黑色食用色素混匀。实验开始前对实验室和水迷宫的环境进行检查和调试,并对大鼠进行适应性训练,使大鼠适应水迷宫环境,减小影响实验出现误差的可能,同时使大鼠达到成模指标,剔除认知极差的大鼠。
1.5.1 适应性训练 在任一象限圆形平台对侧象限的中点,将大鼠头部面向池壁放入水中,观察大鼠的游泳速度及能否找到圆形平台且爬上平台,适应性训练实验时长为120 s,若大鼠在规定时长内没有找到圆形平台,实验员将放置在平台并记录10 s,结束后将大鼠放置在吸水毛毯上,擦干毛后放入鼠笼中,按以上方法每只大鼠连续训练3 d,在3 d内,如果大鼠游泳速度比其他大鼠较慢或者完全不会游泳,则作标记后剔除实验。适应性训练的数据不计为实验结果。
1.5.2 定位航行实验 定位航行实验,连续进行5 d,每天固定时间段进行训练,每只大鼠实验4次/d,记录大鼠120 s内寻找平台的时间,即逃避潜伏期,随机将圆形平台放置在任一象限的中央位置中,第1天将大鼠按顺时针方向依次由E、S、W、N共4个入水点顺序,头朝向池壁放入水中,后4 d逆时针调整更换入水位置。如果大鼠在120 s内未找到平台,将引导其上台并停留10 s,并将其逃避潜伏期记录为120 s。每只大鼠每4次入水实验间隔时间为15~20 min,每次测试完后,用干毛巾将大鼠身上的水擦干后放入干净鼠笼中。实验结束后,以5 d大鼠逃避潜伏期的平均值作为实验数据。
1.5.3 空间探索实验 空间探索实验是在每次连续5 d的定位航行实验结束后,第6天开始进行,实验中不安装圆形平台,将原平台的所在象限作为目标象限,选取剩余3个象限为入水点,将大鼠面朝池壁缓慢放入水中,观察并记录大鼠在60 s内穿越原平台次数的数据。
1.6 组织取材及指标检测
1.6.1 组织取材 最后1次行为学检测结束后立即取材。每组随机选取4只大鼠,采用10%水合氯醛(0.32 mL/100 g)腹腔麻醉大鼠后,开胸,暴露心脏,灌注冰生理盐水和4%多聚甲醛磷酸缓冲液后,快速剥离脑组织后放入装有冰4%多聚甲醛的EP管中固定24 h后常规脱水、石蜡包埋制作切片(厚度为4 μm);余下大鼠麻醉后,快速断头,剥离脑组织,在冰盒上快速分离双侧海马组织,装入 EP 管中,即时放入液氮内,标记好放入-80 ℃冰箱待蛋白检测。
1.6.2 HE染色法观察大鼠脑组织形态变化 将制备好的石蜡切片常规脱蜡、水化后浸入苏木素染色液中 5 min,纯水冲洗后3 min,分化液分化30 s,浸入伊红染色液1 min,自来水浸泡3 min,镜下观察着色情况,再进行脱水、透明,然后中性树胶封固,200×光学显微镜下观察。
1.6.3 Western blot法检测海马组织GSK-3β、Caspase-3蛋白表达 取海马组织60 mg,加600 μL RIPA 裂解液(含蛋白酶抑制剂)后在冰上匀浆,提取蛋白。然后计算样品的蛋白浓度,金属浴 95 ℃变性10 min。制10%的分离胶和5%的浓缩胶,上样、电泳、根据β-actin、GSK-3β及Caspase-3的分子量分别在胶上相应位置取切。转膜1.5 h后,5%脱脂奶粉封闭2 h,4 ℃过夜孵育一抗(β-actin 1∶5 000,GSK-3β1∶3 000,Caspase-3 1∶1 000);1×TBST洗膜3次×10 min,孵育二抗(羊抗鼠IgG 1∶3 000,羊抗兔 IgG 1∶5 000)1.5 h。洗膜3次×10 min,用移液器均匀滴加ECL超敏化学发光液(1∶1比例配置),在ECL成像系统下曝光成像并拍照,定量分析各蛋白条带灰度值。
1.7 统计学处理
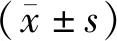
2 结果
2.1 各组大鼠学习记忆能力比较
2.1.1 各组大鼠定位航行实验逃避潜伏期比较 造模前各组大鼠定位航行实验的逃避潜伏期比较,差异无统计学意义(P>0.05)。造模后与造模前比较,假手术组逃避潜伏期无明显变化(P>0.05),模型组和嗅三针组逃避潜伏期明显延长(P<0.01)。经干预10 d后,嗅三针组逃避潜伏期较造模后缩短(P<0.01);模型组较造模后无明显变化(P>0.05)。治疗后,与模型组比较,嗅三针组逃避潜伏期明显缩短,差异具有统计学意义(P<0.01)。见表1。
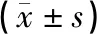
表1 各组大鼠不同时间点逃避潜伏期结果
2.1.2 各组大鼠空间探索实验穿越原平台次数比较 造模前各组大鼠穿越平台次数比较,差异无统计学意义(P>0.05)。造模后与造模前比较,假手术组穿越平台次数无明显变化(P>0.05),模型组和嗅三针组穿越平台次数明显减少(P<0.01)。干预10 d后,嗅三针组穿越平台次数较造模后增多(P<0.05);治疗后,与模型组比较,嗅三针组穿越平台次数增加,差异具有统计学意义(P<0.05)。见表2。
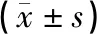
表2 各组大鼠不同时间点穿越平台次数结果
2.2 HE染色检测大鼠海马组织的形态变化
空白组及假手术组大鼠海马HE染色可见CA1区神经元细胞排列紧密,轮廓清楚,形态较规则,能够较清楚看见胞核和胞质,无细胞坏死;模型组神经元细胞排列紊乱,有坏死空洞区,细胞间隙变大,细胞形态受损,出现了细胞核固缩变形、细胞碎裂的现象;嗅三针组细胞形态较模型组有所改善,胞核形态基本正常, 细胞疏松情况减轻,损伤部位得到修复。见图1。
2.3 各组海马组织 GSK-3β蛋白表达比较
通过Image J 软件对蛋白条带的平均灰度值进行分析得出:空白组和假手术组均有一定量的GSK-3β蛋白表达,但两组大鼠的蛋白相对表达量差异无统计学意义(P>0.05),提示仅切开头颅皮肤对大鼠海马区的GSK-3β蛋白表达影响不明显;与假手术组和空白组相比,模型组及嗅三针组的蛋白条带变宽、蛋白表达量明显增多,差异有统计学意义(P<0.05);与模型组相比,嗅三针组的GSK-3β蛋白条带变窄、表达量明显减少(P<0.05),提示嗅三针干预后能够有效抑制SAH CI大鼠海马GSK-3β的表达。见图2、表3。
2.4 各组海马组织Caspase-3蛋白表达比较
通过Image J软件对蛋白条带的平均灰度值进行分析得出:空白组、假手术组的Caspase-3蛋白表达量相当,差异无统计学意义(P>0.05);在造模后,模型组和嗅三针组的Caspase-3蛋白表达量明显增多,与空白组和假手术组比较,差异具有统计学意义(P<0.05);在针刺干预后,嗅三针组的Caspase-3蛋白表达量与模型组比较,明显减少,差异具有统计学意义(P<0.05)。见图3、表3。
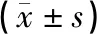
表3 各组大鼠GSK-3β、Caspase-3蛋白表达比较
3 讨论
蛛网膜下腔出血是一种高发病率、高死亡率的神经系统疾病,其发病后长期存在的认知障碍更严重威胁患者的生活质量及生存时间,大部分患者由于缺乏对该类疾病的认识,从而错过最佳的诊疗时间,使其病情更加恶化,发展为痴呆,导致各种意外的发生。因此对于蛛网膜下腔出血后认知障碍修复的机制迫在眉睫。现代研究证实[14-15],海马神经元的凋亡是引起SAH后认知障碍的重要机制学说之一,是其核心环节。神经细胞死亡的主要原因是机体受到创伤后,细胞膜功能严重受损,离子转运功能发生障碍,造成线粒体功能障碍,能量生成减少,引起机体内源性和外源性凋亡途径联系起来共同触发凋亡信号,启动凋亡程序,从而加速细胞凋亡。有研究指出[14],SAH发生后由于血液迅速扩散至整个蛛网膜下腔,导致海马区持续的微循环障碍及局部脑组织的缺血缺氧等继发性损伤导致细胞凋亡,从而引发认知障碍。
GSK-3β是一种具有多功能的丝氨酸/苏氨酸激酶,参与多种信号途径,在神经细胞、心肌细胞和肿瘤细胞等不同类型细胞及多种器官中起到促凋亡的作用,主要是由于GSK-3β活性的异常调节促进了许多蛋白的磷酸化,最终被细胞内的蛋白酶体系统降解,导致细胞凋亡[16-17]。研究发现[18-19],GSK-3β在大脑皮层和海马中广泛表达,参与突触可塑性和记忆形成的控制,在学习、记忆和执行等认知能力的调节中具有重要功能,GSK-3β活性的增强,加快了海马神经元凋亡的速度,从而导致多种中枢神经系统疾病。GSK-3β作为细胞凋亡的上游因子,被激活后可进一步激活Caspase家族、bax及c-jun等与凋亡相关的蛋白激酶,引起一系列的酶链反应,最终加快细胞凋亡的速度。Caspases-3是Caspases家族中的代表性蛋白,位于细胞凋亡的下游,是介导细胞凋亡的关键蛋白酶,目前研究已将Caspase-3定为神经元程序性死亡的核心介质。在神经退行性疾病过程中,GSK-3β活化可上调多巴胺能神经内Caspase-3含量,从而导致细胞凋亡的发生[5]。在脑缺血对神经细胞凋亡影响的研究中,凋亡蛋白GSK-3β和Caspase-3的阳性表达呈正相关[20]。
嗅觉功能与脑神经功能关系密切,嗅觉是人体最重要的感觉功能之一,其中枢位于海马区,而海马区又是与人体学习记忆等认知功能联系密切的中枢部位;研究表明[21],通过针刺“嗅三针”可引起嗅觉通路的兴奋,从而改善海马区的功能,达到醒脑开窍、益智聪神和防治痴呆的效果;“嗅三针”是以双侧迎香穴为主穴,印堂为配穴,常规针刺后予以电针刺激的一组穴位,因均能治疗与嗅觉功能障碍相关的疾病,故命名为“嗅三针”,是由刘智斌教授经过多年临床研究,基于“感知一体,嗅脑同治”的学术思想所创立的一种特色针法,在治疗阿尔兹海默病、痴呆等方面已取得明确的疗效。迎香穴,为手阳明大肠经腧穴,有通利鼻窍的效果,故主治与鼻有关的疾患,正如《针灸大全》中关于此穴云:“鼻塞不闻香臭取迎香”。印堂归属督脉,督脉“入络脑”,可醒脑开窍、通鼻窍,故印堂穴不仅可以治疗鼻渊、鼻衄与嗅觉障碍等疾病,还可以治疗督脉循行远部的脑病,如痴呆病、癫狂病等神志疾病。
本研究发现,经“嗅三针”干预后,SAH CI大鼠水迷宫的平均逃避潜伏期较模型组明显缩短,穿越平台次数增多;海马细胞形态正常,仅有少量的细胞疏松情况,损伤部位得到了一定的修复;海马中GSK-3β和Caspase-3蛋白相对表达量降低。本研究结果提示“嗅三针”对改善SAH CI具有一定的治疗作用,且该治疗作用可能是通过抑制凋亡相关蛋白GSK-3β和Caspase-3的表达量,进而改善认知功能,该作用机制可能是“嗅三针”改善认知障碍的重要环节。
关于细胞凋亡的详细机制研究,本课题组将在后续研究中进一步探讨,为“嗅三针”在SAH CI 治疗中的应用提供循证医学证据。
