脊髓横断后艾灸足三里对胃黏膜损伤大鼠Nrf2/HO-1信号通路的影响
2022-09-15刘桐言
陈 英,曾 强,徐 鹏,王 川,刘桐言
(1.长沙医学院,湖南 长沙 410205; 2.长沙医学院附属第一医院,湖南 长沙 410205)
应激性胃黏膜损伤(Stress gastric mucosal damage,SGMD)是指机体在应激状态下出现的以胃黏膜组织炎症、糜烂和浅表性溃疡等为特征的急性病理性反应[1]。其发病率较高,患病人数约占总人口的10%~20%,目前临床以西药对症治疗及手术治疗为主,但存在不良反应明显、药物依赖性和手术风险较大等问题[2]。而艾灸作为一种无副作用的传统绿色疗法在 SGMD的治疗中受到广泛关注,大量实践及临床研究证实,艾灸能够促进损伤胃黏膜的愈合和修复,对胃痉挛、急慢性胃炎、消化道溃疡等病症均具有较好的疗效,然而其作用机制尚未能明确。机体氧化应激反应引起的活性氧(ROS)增多在SGMD的发生中起到重要作用,核因子E2相关因子2(Nuclear factor erythroid2-related factor 2,Nrf2)可通过调节血红素加氧酶-1(Heine oxygenase-1,HO-1)等抗氧化基因的转录,从而调节氧化还原状态,进一步预防胃黏膜氧化损伤[3]。有研究表明[4-5],艾灸足三里等足阳明经穴可通过抗氧化作用发挥对应激性胃溃疡的治疗功效。另有研究证实[6],脊髓是信号传入胃肠的传递和整合中枢,也是艾灸发挥防治SGMD作用的重要调节途径。基于此,本研究在切断大鼠脊髓的前提条件下,观察艾灸足三里穴对SGMD大鼠胃黏膜Nrf2/HO-1通路相关分子的影响,探讨其胃黏膜保护作用与脊髓的关系。
1 材料与方法
1.1 实验动物
SPF级SD大鼠共50只,体质量180~220 g,雌雄各半,购自湖南省实验动物中心,动物许可证号:SCXK(湘)2016-0001。分笼饲养于相对温度18~25 ℃,相对湿度45%~55%的SPF级实验动物房中。
1.2 实验药物及试剂
温灸纯艾条(φ4 mm)购自南阳汉医责任有限公司;奥美拉唑肠溶片(规格为20 mg/片)购自阿斯利康制药有限公司(批号:201119);青霉素购自华北制药股份有限公司(批号:201020);苏木素-伊红(HE)染色试剂盒购自北京索莱宝科技有限公司(批号:2041S06);超氧化物歧化酶(SOD)、丙二醛( MDA)、谷胱甘肽过氧化物酶(GSH-Px)和一氧化氮(NO)大鼠ELISA检测试剂盒购自武汉博士德生物技术有限公司(批号分别为:20210125、20201223、20210205、20201117);抗一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)、核转录因子E2相关因子2(Nrf2)和血红素加氧酶-1(HO-1)抗体购自CST公司(批号分别为:205433、205521、205616、205427);总RNA提取试剂盒购自TaKaRa公司(批号:223519)。
1.3 分组与造模
实验大鼠按体质量随机分为5组:空白组、模型组、药物组、艾灸组及手术+艾灸组,各组数量均为10只,雌雄分笼后适应性饲养1周。1周后,手术+艾灸组大鼠给予脊髓横断术:大鼠腹腔注射水合氯醛(400 mg/kg)麻醉,取仰卧位固定于手术台,按大鼠肋骨定位椎体序列,随后由沿背部正中线切开T8~12段,暴露T9~11椎体棘突和椎板,剪除T10段椎板并暴露T10水平处脊髓,轻轻挑起脊髓,切开硬膜,将三角刀片垂直插入脊髓后正中沟并横向切开,去掉脊髓周围约2 mm以上组织,大鼠即刻出现下肢抽搐、剧烈摆尾或尿失禁现象,以大鼠T10以下肢体瘫痪、感觉和肌张力消失、出现尿潴留为手术成功。术后剖面用纱布止血后缝合切口,给予青霉素钠(16万U/d)连续肌肉注射3 d,并人工辅助排空膀胱2次/d,直到大鼠恢复自身排尿反射,期间其余组大鼠正常饲养。手术完成后,除空白组外,其余组大鼠采用无水乙醇+阿司匹林灌胃法制备SGMD模型:大鼠禁食24 h,造模第1天先给予无水乙醇(6 mL/kg)灌胃处理,1 h后再给予阿司匹林生理盐水混悬液(200 mg/kg)灌胃,此后3 d继续给予阿司匹林生理盐水混悬液灌胃,每日1次,3 d灌胃结束后禁食 24 h,给予治疗。
1.4 干预方法
艾灸组、手术+艾灸组参照《实验针灸学》定位,取大鼠双侧“足三里”穴(膝关节后外侧,腓骨小头下5 mm处)进行温和灸治疗:大鼠捆绑于鼠板后定位取穴,穴位局部剪毛处理,将艾条固定于小型艾灸支架后点燃,距离双侧足三里穴约0.5 cm处同时施灸,每日两次(早8:00、下午14:00各1次),每次30 min,连续治疗8 d。药物组给予奥美拉唑肠溶片溶液0.2 mg/kg灌胃,1次/d,连续灌胃8 d。空白组和模型组仅捆绑,不予治疗。
1.5 观察指标
1.5.1 胃黏膜损伤指数(UI)检测 大鼠腹腔注射水合氯醛(400 mg/kg)麻醉,腹主动脉取血将贲门和幽门行结扎处理,向胃内注射10 mL预冷生理盐水冲洗后将全胃取出,再置于生理盐水溶液中20 min。沿胃大弯剪开,冲洗胃中内容物后铺平,按Guth标准[7]对黏膜损伤指数(UI)进行评估:糜烂损伤呈斑点状计1分;损伤<1 mm记2分;损伤 1~2 mm 计3分;损伤>2 mm,≤4 mm时计4分;损伤>4 mm计5分;当损伤宽度>1 mm时,按2倍计分。UI=胃黏膜各处糜烂分值相加的总和。
1.5.2 胃黏膜组织病理学观察 UI检测结束后,取大鼠部分胃组织投入10%多聚甲醛溶液,固定48 h后梯度酒精依次浸泡脱水,随后置于二甲苯中透明,经石蜡液包埋后作5 μM厚切片。切片经二甲苯脱蜡、梯度酒精水化、苏木素染色、盐酸酒精分化、伊红染色、梯度酒精脱水和二甲苯透明后,用中性树脂进行封片,光学显微镜下观察胃黏膜组织形态并拍照。
1.5.3 血清中SOD、MDA、NO及GSH-Px水平测定 大鼠腹主动脉取血,将采集血液于3 000 r/min转速下离心15 min,收集上清,弃去沉淀,分装冻存于-20 ℃冰箱。参照ELISA试剂盒步骤测定血清中超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)和谷胱甘肽过氧化物酶(GSH-Px)水平:血清放置于常温下平衡1 h,3 000 r/min离心15 min,样品孔每孔加入血清10 μL,抗体100 μL,样品稀释剂40 μL及辣根过氧化物酶(HRP)标记的二抗100 μL,置于37 ℃温箱中孵育1 h,洗板后加入显色液100 μL,37 ℃温箱避光反应15 min,加入终止液50 μL,酶标仪450 nm波长检测各孔吸光度,绘制标准曲线,计算各样本SOD、MDA、NO及GSH-Px的水平。
1.5.4 胃黏膜组织iNOS、COX-2、Nrf2及HO-1蛋白表达检测 取各组大鼠胃黏膜组织100~200 mg,RAPI裂解液裂解,冰上匀浆,4 ℃ 离心机12 000 r/min离心20 min提取组织总蛋白,BCA法测定蛋白浓度。采用SDS-PAGE浓缩胶电泳转膜,5%脱脂奶粉封闭2 h后,TBST洗膜3次,加入一抗,4 ℃孵育一夜,TBST室温洗膜3次,加入二抗稀释液于室温下孵育1 h,TBST洗膜3次。加入ECL工作液孵育后使用凝胶成像分析系统曝光,Image J软件分析条带灰度值,计算目的蛋白表达水平。
1.5.5 胃黏膜组织iNOS、COX-2、Nrf2及HO-1 mRNA表达检测 取各组大鼠部分胃黏膜组织,将组织充分研磨后采用Trizol裂解液提取总RNA,按紫外分光光度法检测黏膜组织总RNA浓度,将样品RNA逆转录合成 cDNA,再按PCR试剂盒步骤进行扩增反应。反应条件为95 ℃ 预变性 3 min,95 ℃变性10 s, 60 ℃退火30 s,扩增 40个循环。结果以β-actin为内参,2-△△Ct法计算各组iNOS、COX-2、Nrf2及HO-1的相对mRNA表达量。具体引物序列见表1。

表1 各基因引物序列
1.6 统计学处理
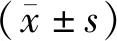
2 结果
2.1 大鼠胃黏膜损伤指数(UI)比较
模型组与空白组比较,大鼠UI指数明显升高,差异具有统计学意义(P<0.01);艾灸组大鼠胃黏膜UI指数较模型组明显降低,差异具有统计学意义(P<0.01);手术+艾灸组UI明显高于艾灸组,差异具有统计学意义(P<0.05),与模型组比较差异无统计学意义(P>0.05)。结果见表2。
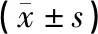
表2 各组大鼠胃黏膜损伤指数比较
2.2 大鼠胃黏膜组织形态学改变
HE染色可见,空白组大鼠胃黏膜细胞排列规整,胞质和胞核清晰,未见炎细胞浸润。模型组大鼠黏膜下层水肿,胃腺细胞排列无序,可见大量细胞坏死,胞内充血水肿,胞质和胞核不清,毛细血管扩张,细胞间隙可见炎性细胞浸润。艾灸组与药物组经治疗后,大鼠胃黏膜组织损伤较模型组明显改善,细胞排列较整齐,胞内充血水肿减轻,少量炎细胞浸润。手术+艾灸组大鼠仍可见黏膜下层水肿及炎性细胞浸润。结果见图1。
2.3 大鼠血清中SOD、MDA、NO及GSH-Px水平比较
与空白组比较,模型组大鼠血清中SOD、GSH-Px水平明显降低,MDA、NO的水平显著升高,差异具有统计学意义(P<0.01)。经治疗后,艾灸组显著上调了大鼠血清中SOD、GSH-Px水平,下调了MDA、NO的水平,差异具有统计学意义(P<0.01)。手术+艾灸组SOD、MDA、NO及GSH-Px水平较模型组有一定程度的改善,但差异无统计学意义(P>0.05)。与艾灸组比较,手术+艾灸组SOD、GSH-Px的水平明显较低,MDA、NO水平明显较高,差异具有统计学意义(P<0.05或P<0.01)。结果见表3。
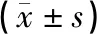
表3 各组大鼠血清中SOD、MDA、NO及GSH-Px的表达
2.4 大鼠胃黏膜组织中iNOS、COX-2、Nrf2及HO-1蛋白表达比较
模型组大鼠胃黏膜组织中iNOS、COX-2的蛋白表达较空白组明显增多,Nrf2、HO-1的表达明显减少,差异具有统计学意义(P<0.01)。艾灸组显著下调了模型大鼠iNOS、COX-2蛋白表达水平的升高,上调了Nrf2和HO-1的蛋白表达,差异具有统计学意义(P<0.01)。手术+艾灸组iNOS、COX-2、Nrf2及HO-1的蛋白表达水平与模型组相比差异无统计学意义(P>0.05),与艾灸组比较,iNOS、COX-2的表达明显增多,Nrf2、HO-1的表达显著减少,差异具有统计学意义(P<0.05或P<0.01)。结果见图2、表4。
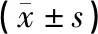
表4 各组大鼠胃黏膜组织iNOS、COX-2、Nrf2及HO-1的蛋白表达
2.5 大鼠胃黏膜组织iNOS、COX-2、Nrf2及HO-1 mRNA表达比较
与空白组比较,模型组大鼠胃黏膜组织中iNOS、COX-2 mRNA表达明显增高,Nrf2、HO-1 mRNA表达显著降低,差异具有统计学意义(P<0.01)。艾灸组iNOS、COX-2 mRNA表达较模型组明显减少,Nrf2、HO-1的表达水平明显增多,差异具有统计学意义(P<0.01)。手术+艾灸组iNOS、COX-2、Nrf2、HO-1 mRNA表达较模型组比较差异无统计学意义(P>0.05),iNOS、COX-2 mRNA表达较艾灸组明显增多,Nrf2、HO-1的表达较艾灸组显著减少,差异具有统计学意义(P<0.05或P<0.01)。结果见表5,各基因扩增曲线、溶解曲线见图3。
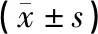
表5 各组大鼠胃黏膜组织iNOS、COX-2、Nrf2及HO-1 mRNA表达
3 讨论
应激性胃黏膜损伤(Stress gastric mucosal damage,SGMD)以糜烂、水肿及溃疡等胃黏膜炎症表现为主要特征,而炎症反应能够诱发氧化应激,使机体抗氧化能力降低,生成过多的活性氧自由基(Reactive oxygen species,ROS),进而导致氧化通路的激活,不断加重胃黏膜损伤[8]。艾灸以温热刺激体表穴位,可通过激发经络之气的活动来调节机体生理功能,刺激机体产生内源性保护物质,并发挥抗炎、抗氧化等一系列作用,作为一种无痛、无副作用的绿色疗法,在SGMD的防治方面具有独特优势[9]。
足阳明胃经属胃络脾,为治疗胃腑多种疾患的重要纽带。足三里为足阳明经五腧穴中的合穴,亦为胃腑下合穴,具有生发胃气、益气补虚和通络除痹之功。胃属土,本经亦属土,故足三里为土经土穴,最能安土,为治疗胃经诸病首选穴,临床用于胃痛、胃炎和胃肠溃疡等病症均具有确切疗效[10-11]。刘密等[12]通过研究证实,艾灸足三里穴可降低应激性胃溃疡大鼠胃组织丙二醛(Malondialdehyde,MDA)的含量,同时使超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)的活性升高,表明艾灸足三里可通过抗氧化作用促进损伤胃黏膜的愈合。
脊髓是中枢神经系统中的一部分,能够作为大脑与周围神经间的通路,将来自四肢和躯干的体感信息从周围神经传达到脑[13]。研究表明[6],脊髓在艾灸对胃黏膜的保护效应中起到信息传导的作用,在切断实验动物的脊髓后,发现艾灸对胃黏膜损伤的治疗作用有所降低,提示脊髓参与了艾灸对胃黏膜损伤的修复,而关于艾灸是如何通过脊髓达到保护效应的具体机制还需深入研究。
本实验采用无水乙醇结合阿司匹林灌胃建立大鼠SGMD模型,观察艾灸足三里穴对SGMD大鼠胃黏膜损伤的保护作用,同时设立手术+艾灸组,给予脊髓横断术以观察脊髓对艾灸保护效应的影响。结果显示,相较于治疗前,艾灸足三里对SGMD大鼠胃黏膜损伤具有显著的改善作用,比较各组UI值可见,艾灸治疗明显降低了大鼠UI值的升高,而脊髓横断术影响了其治疗效果,UI值升高,与模型组比较差异无统计学意义。观察各组病理结果可见,艾灸组治疗有效减轻了大鼠胃黏膜组织损伤,而手术+艾灸组对胃黏膜病变的改善并不明显,表明脊髓是艾灸足三里穴发挥对SGMD治疗作用信号转导通路中的一个重要部位。超氧化物歧化酶(Superoxide dismutase,SOD)是机体氧自由基的天然清除剂,具有极强的抗氧化能力;丙二醛(Malondialdehyde,MDA)是体内脂质过氧化反应的产物,SOD活性和MDA含量的多少能够反应机体氧化损伤程度[14-15]。谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)能够清除有毒的过氧化物,维持细胞内氧化还原状态[16]。一氧化氮(Nitric oxide,NO)是一种具有双重作用的炎症介质,少量的NO对细胞具有保护作用,可加速损伤愈合,而高浓度的 NO可上调炎症反应导致组织及细胞损伤[17]。通过ELISA实验观察艾灸足三里对SOD、GSH-Px活性及MDA、NO含量的影响,结果发现,艾灸可增强大鼠血清中SOD和GSH-Px的活性,同时降低升高的MDA和NO水平,增强抗氧化能力,从而减轻炎症反应,恢复胃黏膜氧化损伤,而脊髓横断抑制了艾灸的抗氧化效果,各指标血清水平与模型组比较未见明显差异。
核因子E2相关因子2(Nuclear factor erythroid2-related factor 2,Nrf2)是在氧化应激反应及炎症环境下发挥抗氧化功能的关键转录因子,氧化应激时,Nrf2被释放并进入细胞核,参与调控血红素加氧酶-1(Heine oxygenase-1,HO-1)等下游抗氧化基因的转录,从而达到降低机体氧化应激水平、保护细胞和组织的作用[18-19]。在SGMD发生时,Nrf2/HO-1信号通路的激活能够调节胃黏膜细胞的氧化还原状态,清除多余ROS,抵抗胃黏膜氧化损伤[20-21]。本研究中模型组大鼠胃黏膜组织中Nrf2和HO-1的蛋白及mRNA表达量较空白组均显著减少,经艾灸足三里治疗后,Nrf2和HO-1的表达水平明显上调,提示艾灸治疗能够促进Nrf2核易位,诱导HO-1的表达,而手术+艾灸组胃黏膜组织中Nrf2和HO-1的表达要明显低于艾灸组。另一方面,艾灸治疗可显著抑制炎性蛋白酶一氧化氮合酶(induced nitrogen monoxide synthase,iNOS)和环氧化酶-2(Cyclooxygenase,COX-2)在蛋白和mRNA水平的表达,而手术+艾灸组胃黏膜组织iNOS和COX的表达较艾灸组明显升高。表明脊髓横断影响了艾灸足三里穴对Nrf2/HO-1通路的调控作用,减弱了艾灸的抗炎和氧化应激抑制作用。
综上所述,本实验结果表明艾灸足三里穴可通过激活Nrf2/HO-1信号通路、降低氧化应激水平来减轻SGMD大鼠胃黏膜炎症反应;而对大鼠脊髓的横断明显影响了其抗炎、抗氧化作用,提示脊髓是艾灸足三里穴发挥胃黏膜损伤修复作用的重要途径,艾灸治疗所诱导的Nrf2/HO-1通路的表达受到脊髓的调控。
