海桐皮汤提取膏经皮给药对小鼠抗炎镇痛作用及机制研究
2022-09-05李法杰谷金玉万田豪
李法杰,谷金玉,张 悦,沈 硕,姚 瑶,万田豪,夏 迪,张 清
(1. 中国中医科学院望京医院,北京 100102;2. 中国中医科学院中医临床基础医学研究所,北京 100700;3. 中国中医科学院中药研究所,北京 100700)
伤害性刺激引起的机体持续疼痛及炎症反应是临床最常见的伴随症状,也是全球重要健康问题之一,可导致个体痛苦、生活质量恶化、家庭负担沉重及巨大的社会经济负担[1]。针对骨科术后、跌倒损伤等躯体急、慢性疼痛和炎症反应,临床常用的一线药物有阿片类镇痛药和非甾体类抗炎药等,然而上述药物可引起恶心、呕吐等胃肠道毒性和耐药、成瘾、嗜睡、骨脆性增加等副作用[2]。中药经皮给药对防治疼痛及减少炎症反应疗效确切、毒副作用少,是一种颇具前景的补充替代疗法[3]。海桐皮汤首见于《医宗金鉴·正骨心法要旨》,由海桐皮、透骨草、乳香、没药、当归、川椒、红花、川芎、防风、白芷、威灵仙、甘草组成,具有祛湿温经散寒、活血消肿止痛的功效[4]。临床常用海桐皮汤熏洗患处,通过经皮给药以促进患者骨折术后愈合,并治疗骨关节炎、跟痛症、跌打损伤等骨伤科疾病[5-7];基础研究表明,海桐皮汤熏蒸可降低软骨细胞凋亡率、减少白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)等炎性细胞因子的表达[8,9]。但原处方药味较多且剂型为汤剂,存在不便携带、需要煎煮、药物利用不充分等弊端。为此,本团队按照海桐皮汤的经典原方,制备成海桐皮汤提取膏,以期为临床骨伤科等疾病提供一种抗炎、镇痛的外用中药药膏。
本研究应用海桐皮汤提取膏对小鼠经皮给药,采用热板法、角叉菜胶导致的足跖肿胀及醋酸扭体反应等实验,并检测各组小鼠血浆中的肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、IL-1β、IL-6 等炎性细胞因子的含量,以阐释海桐皮方提取膏的抗炎、镇痛效果及其可能机制。
1 材料与方法
1.1 动物
SPF 级KM 小鼠,雄性,体质量(20±2)g,由中国食品药品检定研究院(北京大兴)提供,许可证号:SCXK(京)-2017-0005。常规饲养于通风、光照12/12 h,温 度 为21°C±2°C,相 对 湿 度 为50%±10%,大鼠自由摄食和饮水。本实验经中国中医科学院针灸研究所动物实验伦理审查,伦理审查申请号:中科针伦D2022-04-11。实验过程严格遵照“3R”原则及科技部颁布的《关于善待实验动物的指导性意见》相关规定。
1.2 实验药物及制备工艺
1.2.1实验药物 海桐皮汤提取膏的中药组成:海桐皮(批号:20211116,北京本草方源药业集团有限公司)、红花、醋没药、醋乳香、威灵仙、防风(批号分别 为:21072701、21032201、21062301、21040601、2108098,北京四方中药饮片有限公司)、酒当归、甘草、川椒、透骨草(批号分别为:211035、211099、211033、211121,北京盛世龙药业有限公司)、白芷、川芎(批号分别为:B9051511、B8291511,北京金崇光药业有限公司),上述药物经中国中医科学院中药研究所鉴定为正品,均符合《中国药典》2020 年版检验标准的规定。双氯芬酸二乙胺乳胶剂(批号:8P3U,规格20 g/支,中美天津史克制药有限公司)。
1.2.2制备工艺 制备工艺1:按照海桐皮汤原方比例称取适量处方中乳香、没药、酒当归、川芎、川椒、白芷、防风,于10 倍量水中用水蒸气蒸馏法提取挥发油,并另存挥发油及水煎液,药渣与海桐皮、透骨草、威灵仙、红花、甘草5 味药材合并水提,两处水煎液合并减压浓缩后挥发油,搅匀,制成每克含生药1.512 g(1.512 g/g)的中药制剂,置于4 ℃冰箱保存备用,使用前室温解冻,加入水凝胶基质中,调整生药浓度为2.0 g/mL。
制备工艺2:药材用量同上,全方水提,弃去药渣,浓缩水煎液制成每克含生药1.712 g(1.712 g/g)的中药制剂,置于4 ℃冰箱保存备用,使用前室温解冻,加入水凝胶基质中,调整生药浓度为2.0 g/mL。
1.3 主要试剂及仪器
1.3.1 主要试剂 TNF-α 酶联免疫吸附测定(ELISA)试剂盒(批号:Cat.#ELS286,上海艾来萨生物科技有限公司)、IL-1β、IL-6 ELISA 试剂盒(批号分别为:ab197742、ab222503,英国Abcam 公司);角叉菜胶(批号:20170912,北京索莱宝科技有限公司);甲醛、冰醋酸均为分析纯,由国药集团提供。
1.3.2 主要仪器 爪肿胀测量仪(Ahlborn Almemo,2450)、冷热板(Ugo Basile,35150)、微量电子天平(Mettler Toledo,ML204)、高速冷冻离心机(Eppendorf Centrifuge,5430R)、打孔器(直径6mm,泽亚科教,ZEYA/EP-1)。
1.4 给药剂量
实验前1 d 在小鼠腹部大约3 cm2范围电动推剪脱毛。参照文献[10]、[11],小鼠与人体剂量换算:(1.44×10 000 cm2×0.05 mL/cm2×0.003)÷67 cm2=0.03 mL/cm2,其 中,1.44×10 000 cm2是 人(50 kg)的体表面积,0.05 mL/cm2是外用药物人体常用剂量,0.003 是小鼠与人按照体表面积折算的等效剂量换算系数,67 cm2是小鼠体表面积。计算所得,本实验小鼠用药剂量为0.03 g/cm2×3 cm2=0.09 g/只。
1.5 观察指标及检测方法
1.5.1 镇痛作用
1.5.1.1 热板法实验 实验分组前,首先对SPF 级正常雄性KM 小鼠进行痛阈筛选,冷热板测痛仪温度调节在(55±0.5)℃,取雄性KM 小鼠分别置于热板上,测量小鼠从后足接触热板至添足时间,即为痛阈值,每隔5 min 测一次,共3 次,筛选均值5~30 s 的入组。将痛阈筛选合格的雄性小鼠按体质量随机分为模型组(予以空白凝胶,0.09 g/只)、工艺1 组(予以工艺1 提取膏,0.09 g/只)、工艺2 组(予以工艺2 提取膏,0.09 g/只)和扶他林组(予以双氯芬酸钠二乙胺乳胶剂,0.09 g/只),每组10 只。将相应剂量的药膏均匀涂抹于对应小鼠的腹部脱毛处,1 次/d,连续干预14 d。于初次给药前及末次给药后30、60、90、120 min 按上法分别测定痛阈值。如超过60 s 仍无添后足反应,应立刻停止观察并按60 s计算[12]。
1.5.1.2 扭体反应实验 SPF 级正常雄性KM 小鼠40 只,分组、用药及干预方式同1.5.1.1,1 次/d,连续干预14 d。末次给药半小时,各组小鼠腹腔注射冰醋酸(0.6%,10 mL/kg),观察并记录小鼠15 min 内第一次出现扭体的时间(即扭体潜伏期)和扭体次数。主要表现为腹部内凹、躯干扭曲、后肢伸展及臀部抬高[13]。
1.5.2 抗炎作用
1.5.2.1 足肿胀实验 SPF 级正常雄性KM 小鼠50只,按体质量随机分为5 组,除空白组外,其余分组及干预方法同1.5.1.1,1 次/d,连续干预14 d。于末次给药半小时后,各组在右后足跖皮下注射1%角叉菜胶30 μL 致炎。借助爪肿胀测量仪依次测定致炎前(0 h)和致炎后1、2、3、4 h 各组小鼠右后足容积[14],并计算各组小鼠右后足肿胀度(mL)=致炎后右后足容积(mL)-致炎前右后足容积(mL);肿胀率(%)=肿胀度/致炎前右后足容积×100%。
1.5.2.2 耳肿胀实验 采用二甲苯致耳肿胀实验以验证药物的抗炎作用。SPF 级正常雄性KM 小鼠40 只,分组及干预方法同1.5.1.1,1 次/d,连续干预14 d。于末次给药1 h 后,在小鼠右耳廓内外面涂抹30 μL 二甲苯致炎,左耳作为对照组不涂抹任何药物。二甲苯干预1 h 后处死小鼠,沿耳廓基线剪下小鼠双耳,并在双耳同一部位借助6 mm 直径的打孔器打下圆形耳片,借助微量电子称称重后,进行耳肿胀度及肿胀抑制率[15]的计算,肿胀度(mg)=右耳耳片质量(mg)-左耳耳片质量(mg);肿胀抑制率(%)=[(对照组小鼠肿胀度-给药组小鼠肿胀度)/对照组小鼠肿胀度]×100%。
1.5.2.3 ELISA 足肿胀实验结束后,摘除小鼠眼球取血并离心保存,室温静置20 min 后,4 ℃、3 500 r/min 离心15 min,上清液置于-80 ℃冰箱保存,借助ELISA 试剂盒进行TNF-α、IL-1β、IL-6 的含量。
1.5.2.4 HE 足肿胀实验结束后,取右后足足跖皮下组织,置于4%多聚甲醛溶液中,4 ℃、固定48 h,随后将其放于25%蔗糖溶液中脱水24 h,将脱水后的组织取出,石蜡包埋,并用石蜡切片机连续切片,切片厚度为4 μm,随后进行HE 染色,在显微镜下观察皮下组织病理变化。
1.6 统计学处理
采用SPSS26.0 统计软件统计,所有数值以均值±标准差(±s)表示,分别进行正态分布、方差齐性检验及单因素方差分析判断组间差异,两两比较采用LSD 检验,P<0.05 为差异有统计学意义的标准;使用GraphPad8.0.1 做图。
2 结果
2.1 各组小鼠热板实验痛阈值比较
给药前各组小鼠的基线痛阈值差异无统计学意义(P>0.05);末次给药后30 min,与模型组比较,其余各组小鼠的痛阈值明显增加,差异具有统计学意义(P<0.05);与工艺1、工艺2 组相比,扶他林组痛阈值明显提高差异具有统计学意义(P<0.05)。末次给药后60 min,与模型组相比,工艺1 组和扶他林组的痛阈值提高(P<0.01);与工艺1 相比,扶他林组的痛阈值提高更为明显(P<0.05)。末次给药后90 min,与模型组相比,扶他林组痛阈值仍明显提高,差异具有统计学意义(P<0.01),工艺1 和2 组虽有上升趋势,但无统计学差异(P>0.05);与扶他林组相比,工艺1 和2 组的痛阈值降低,差异具有统计学意义(P<0.05)。末次给药后120 min,与模型组相比,扶他林组痛阈值明显提高(P<0.01),工艺1 组痛阈值有增加趋势,但无统计学差异(P>0.05)(表1)。
表1 各组小鼠热板实验痛阈值的比较(n=10,±s)Tab 1 Comparison of pain thresholds in the hot plate test of mice in each group(n=10,±s)
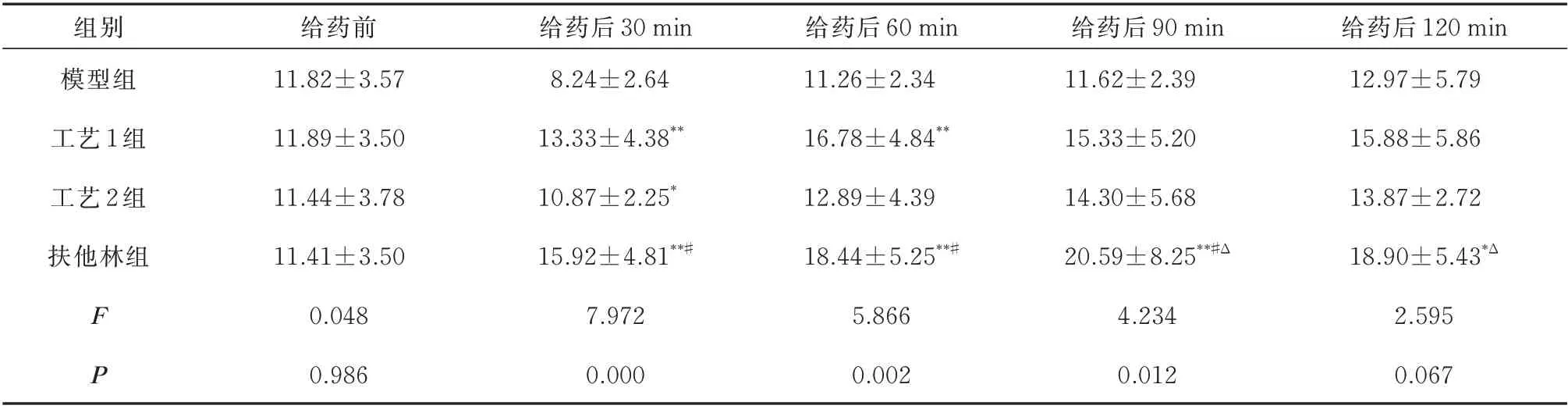
表1 各组小鼠热板实验痛阈值的比较(n=10,±s)Tab 1 Comparison of pain thresholds in the hot plate test of mice in each group(n=10,±s)
注:与模型组比较,*P<0.05,**P<0.01;与工艺1 组比较,#P<0.05;与工艺2 相比,△P<0.05。
组别模型组工艺1 组工艺2 组扶他林组给药前11.82±3.57 11.89±3.50 11.44±3.78 11.41±3.50 0.048 0.986给药后30 min 8.24±2.64 13.33±4.38**10.87±2.25*15.92±4.81**#7.972 0.000给药后60 min 11.26±2.34 16.78±4.84**12.89±4.39 18.44±5.25**#5.866 0.002给药后90 min 11.62±2.39 15.33±5.20 14.30±5.68 20.59±8.25**#Δ 4.234 0.012给药后120 min 12.97±5.79 15.88±5.86 13.87±2.72 18.90±5.43*Δ 2.595 0.067 F P
2.2 各组小鼠扭体反应潜伏期及扭体次数的比较
结果显示,给药14 d 后,与模型组比较,工艺1、工艺2 及扶他林组小鼠的扭体潜伏期明显延长,且扭体次数均明显减少,差异有统计学意义(P<0.01);与工艺1 相比,工艺2 组的扭体次数增加,差异有统计学意义(P<0.05),扭体潜伏期有缩短趋势,但无统计学差异;与扶他林组相比,工艺2 组的扭体潜伏期缩短更明显,其扭体次数明显增加,差异有统计学意义(P<0.01)(表2)。
表2 各组小鼠扭体反应潜伏期及扭体次数的比较(n=10,±s)Tab 2 Comparison of the latency period and number of torsional reactions of mice in various groups(n=10,±s)
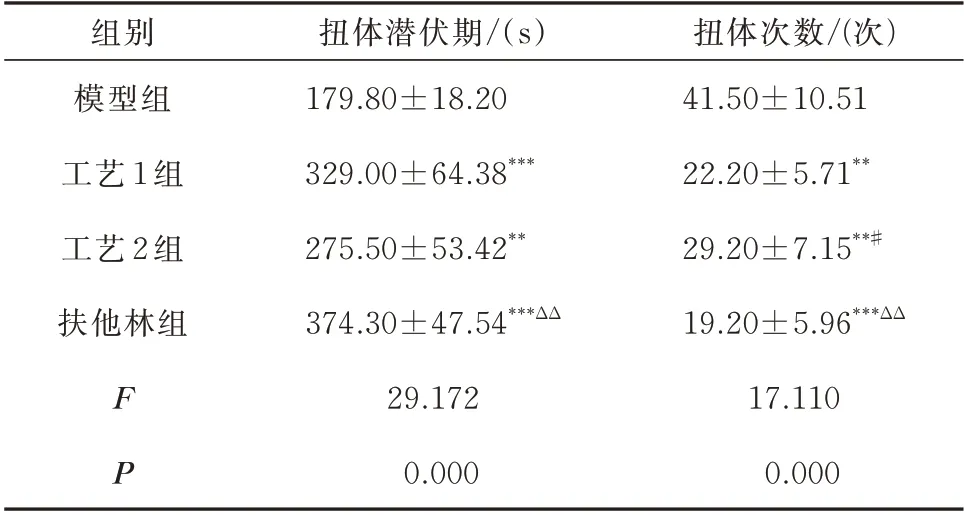
表2 各组小鼠扭体反应潜伏期及扭体次数的比较(n=10,±s)Tab 2 Comparison of the latency period and number of torsional reactions of mice in various groups(n=10,±s)
注:与模型组比较,**P<0.01,***P<0.001;与工艺1 组比较,#P<0.05;与工艺2 组比较,△△P<0.01。
扭体次数/(次)41.50±10.51 22.20±5.71**29.20±7.15**#19.20±5.96***ΔΔ 17.110 0.000组别模型组工艺1 组工艺2 组扶他林组F P扭体潜伏期/(s)179.80±18.20 329.00±64.38***275.50±53.42**374.30±47.54***ΔΔ 29.172 0.000
2.3 各组小鼠右后足肿胀度的比较
与空白组相比,模型组小鼠右后足跖注射角叉菜胶后肿胀度及肿胀率均明显增高,差异有统计学意义(P<0.01),表明小鼠急性炎症造模成功;与模型组比较,工艺1 组、工艺2 组、扶他林组在各时间点均能显著降低小鼠右后足肿胀度及肿胀率,差异有统计学意义(P<0.01);与工艺1 组相比,工艺2组在致炎后1~3 h 小鼠足趾的肿胀度及肿胀率增加,差异有统计学意义(P<0.05),扶他林组在致炎后1~2 h 肿胀度降低更明显,差异有统计学意义(P<0.05);与工艺2 组相比,工艺1 组致炎后1~3 h、扶他林组致炎后1~4 h 的小鼠足部肿胀度及肿胀率均降低,差异有统计学意义(P<0.05)(表3)。
表3 各组小鼠右后足肿胀度的比较(n=10,±s)Tab 3 Comparison of swelling degree of right hind paw of mice in each group(n=10,±s)
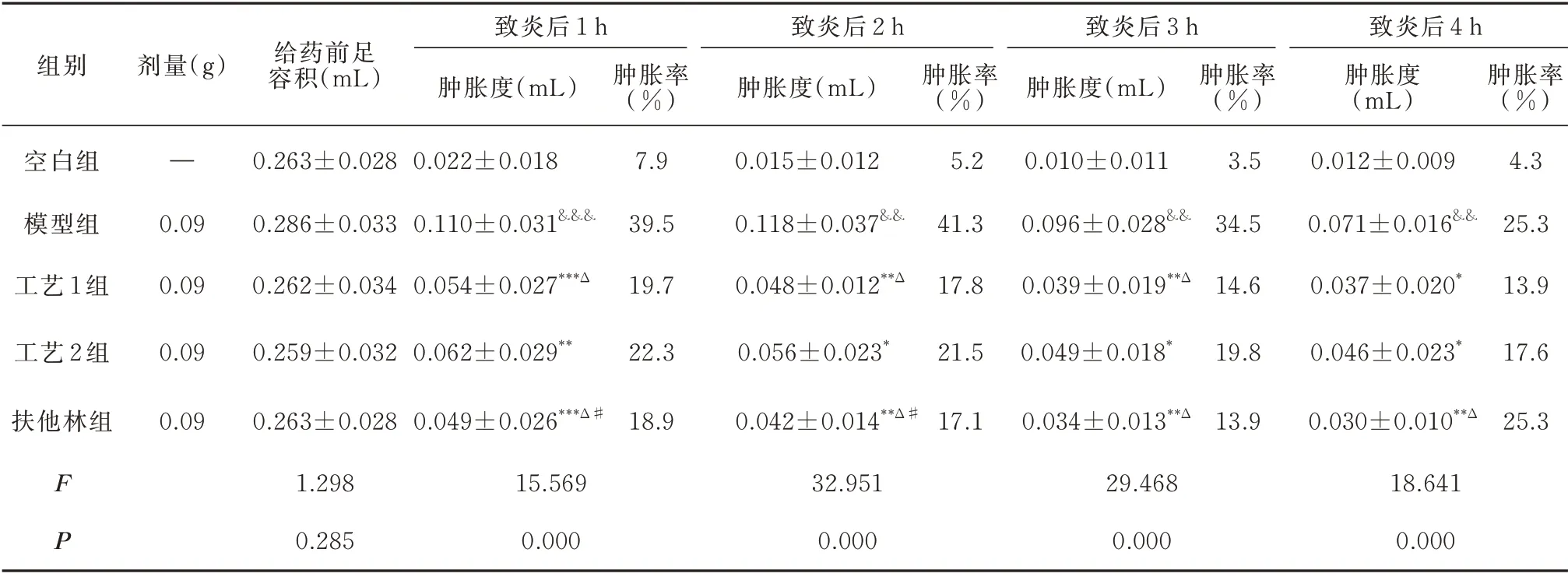
表3 各组小鼠右后足肿胀度的比较(n=10,±s)Tab 3 Comparison of swelling degree of right hind paw of mice in each group(n=10,±s)
注:与空白组比较,&&P<0.01,&&&P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001;与工艺1 组比较,#P<0.05;与工艺2 相比,△P<0.05。
组别剂量(g) 给药前足容积(mL)致炎后1 h肿胀度(mL) 肿胀率(%)致炎后2 h肿胀度(mL) 肿胀率(%)致炎后3 h肿胀度(mL) 肿胀率(%)肿胀率(%)空白组模型组工艺1 组—0.09 0.09 0.263±0.028 0.286±0.033 0.262±0.034 0.022±0.018 0.110±0.031&&&0.054±0.027***Δ 7.9 39.5 19.7 0.015±0.012 0.118±0.037&&0.048±0.012**Δ 5.2 41.3 17.8 0.010±0.011 0.096±0.028&&0.039±0.019**Δ 3.5 34.5 14.6致炎后4 h肿胀度(mL)0.012±0.009 0.071±0.016&&0.037±0.020*4.3 25.3 13.9工艺2 组0.09 0.259±0.032 0.062±0.029**22.3 0.056±0.023*21.5 0.049±0.018*19.8 0.046±0.023*17.6扶他林组0.09 0.049±0.026***Δ#18.9 0.042±0.014**Δ#17.1 0.034±0.013**Δ 13.9 0.030±0.010**Δ 25.3 F P 0.263±0.028 1.298 0.285 15.569 0.000 32.951 0.000 29.468 0.000 18.641 0.000
2.4 各组小鼠耳廓肿胀度及肿胀抑制率的比较
与模型组相比,其余3 组小鼠耳廓肿胀度均有显著的抑制作用,差异有统计学意义(P<0.05),工艺1 组的耳廓肿胀抑制率为43.86%,工艺2 组的耳廓肿胀抑制率为25.79%,扶他林组的耳廓肿胀抑制率为61.27%。与工艺1 组相比,工艺2 组的耳廓肿胀度增加,而扶他林组的耳廓肿胀度降低,差异有统计学意义(P<0.05);与扶他林组比较,工艺2 组的耳廓肿胀度增加,差异有统计学意义(P<0.05),而工艺1 组有增加趋势,但无统计学差异(P>0.05)(表4)。
表4 各组小鼠耳廓肿胀度及肿胀抑制率的比较(n=10,±s)Tab 4 Comparison of ear swelling and swelling inhibition rate of mice in each group(n=10,±s)
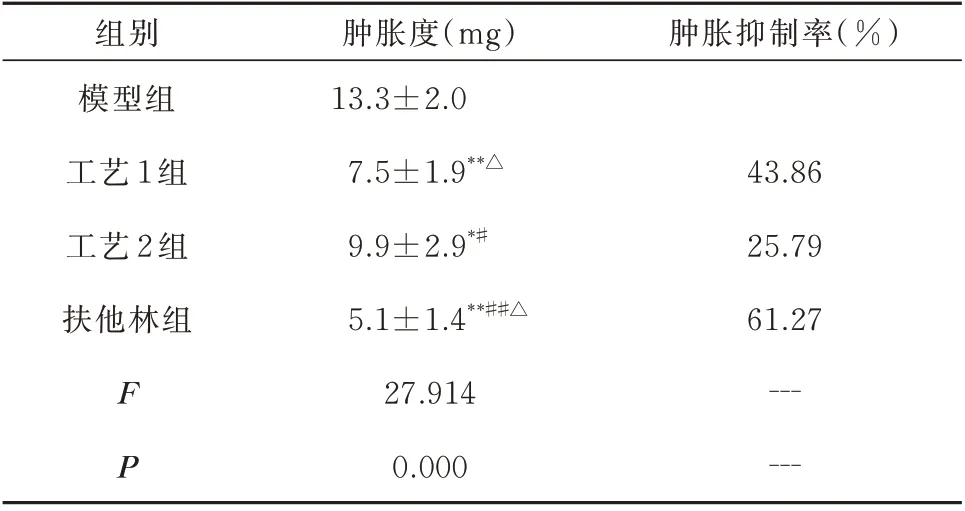
表4 各组小鼠耳廓肿胀度及肿胀抑制率的比较(n=10,±s)Tab 4 Comparison of ear swelling and swelling inhibition rate of mice in each group(n=10,±s)
注:与模型组比较,*P<0.05,**P<0.01;与工艺1 组比较,#P<0.05,##P<0.01;与工艺2 相比,△P<0.05。
组别模型组工艺1 组工艺2 组扶他林组肿胀抑制率(%)肿胀度(mg)13.3±2.0 7.5±1.9**△9.9±2.9*#5.1±1.4**##△27.914 0.000 43.86 25.79 61.27——--F P
2.5 各组小鼠TNF-α、IL-1β、IL-6 含量的比较
相比于空白组,模型组小鼠血清中TNF-α、IL-1β、IL-6 的含量明显增加,差异具有统计学意义(P<0.01);相比于模型组,工艺1 组、工艺2 组及扶他林组的IL-1β 的含量明显减少,差异具有统计学意义(P<0.05),工艺1 组和扶他林组的TNF-α 含量明显减少,差异具有统计学意义(P<0.01),扶他林组的IL-6 含量减少,差异具有统计学意义(P<0.05),工艺1 组和工艺2 组的IL-6 有降低趋势,但无统计学差异(P>0.05);相比于工艺1 组扶他林组的TNF-α 显著降低,差异具有统计学意义(P<0.05);相比于工艺2 组扶他林组的TNF-α 降低,差异具有统计学意义(P<0.01),工艺1 组和扶他林组的IL-1β 降低,差异具有统计学意义(P<0.05)(表5)。
表5 各组小鼠TNF-α、IL-1β、IL-6 含量的比较(pg/mg,n=6,±s)Tab 5 Comparison of TNF-α、IL-1β、IL-6 content of mice in each group(pg/mg,n=6,±s)
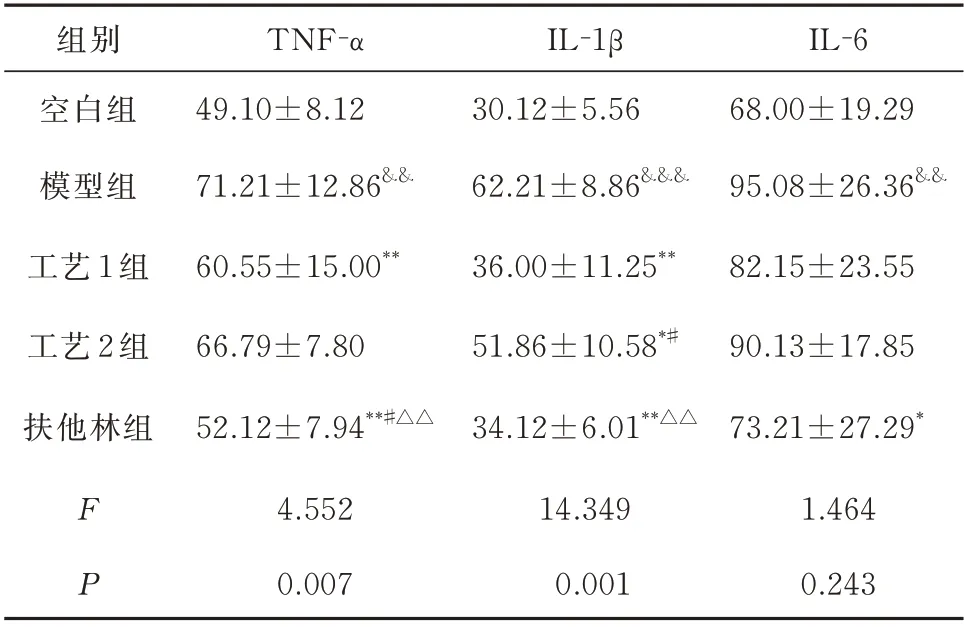
表5 各组小鼠TNF-α、IL-1β、IL-6 含量的比较(pg/mg,n=6,±s)Tab 5 Comparison of TNF-α、IL-1β、IL-6 content of mice in each group(pg/mg,n=6,±s)
注:与空白组比较,&&P<0.01,&&&P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001;与工艺1 组比较,#P<0.05;与工艺2相比,△P<0.05,△△P<0.01。
组别空白组模型组工艺1 组工艺2 组扶他林组TNF-α 49.10±8.12 71.21±12.86&&60.55±15.00**66.79±7.80 52.12±7.94**#△△IL-1β 30.12±5.56 62.21±8.86&&&36.00±11.25**51.86±10.58*#34.12±6.01**△△IL-6 68.00±19.29 95.08±26.36&&82.15±23.55 90.13±17.85 73.21±27.29*1.464 0.243 F P 4.552 0.007 14.349 0.001
2.6 各组小鼠右后足足跖皮下组织HE 的比较
结果显示,空白组皮下组织的嗜中性粒细胞等炎性细胞表达较少,无明显炎性反应(图1A);模型组小鼠致炎后皮下组织肿胀、增厚,镜下可见间隙疏松增宽、弥漫性中性粒细胞浸润及淋巴细胞增多聚集、血管内皮细胞增生(图1B);工艺1 组和工艺2组嗜中性粒细胞增多伴散在分布,但工艺2 的组织细胞聚集倾向较工艺1 加重,且血管扩张明显(图1C、D);扶他林组致炎后皮下组织肿胀度较轻,大量肌纤维母细胞浸润伴中性粒细胞和淋巴细胞散在分布(图1E)。结果显示,工艺1、2 组和扶他林组均可抑制二甲苯所致的小鼠足跖肿胀,且扶他林的效果最明显,工艺1 优于工艺2。
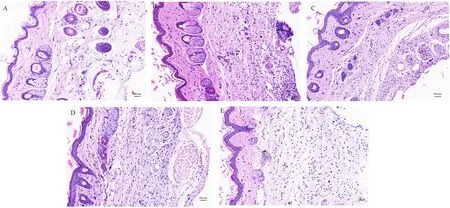
图1 各组小鼠右后足足跖皮下组织HE 的比较(×20,bar=100 μm)Fig 1 Comparison of HE of Subcutaneous tissue of the right foot(×20,bar=100 μm)
3 讨论
海桐皮汤中的海桐皮、透骨草、乳香、没药、川椒、川芎、白芷、红花、甘草等中药含有挥发油类、多糖类及黄酮类活性成分,具有抗氧化、解热镇痛、抗炎抑菌等药理作用,防治颈肩腰腿痛、跌打损伤及筋翻骨错等疼痛性疾病的疗效显著[16-26]。吴尚先《理瀹骈文》记载:“凡汤丸之有效者,皆可熬膏”[27],为解决该方携带不便、需要煎煮、药物利用不充分等弊端,本团队按照海桐皮方的经典原方比例称取药物,通过两种不同工艺制备成膏剂,其中工艺1 首先对含挥发油类的药物进行挥发油及水煎液提取另存,然后与水提煎液浓缩的清膏混合;工艺2 为全方水提,直接水煎液浓缩为清膏。临床常用扶他林软膏治疗骨关节炎类疾病,可抗炎镇痛,提高患者的痛阈值[28-30],因此,本实验选择扶他林软膏作为阳性对照药,通过热板痛、扭体反应、足跖肿胀和耳廓肿胀实验等,初步探讨经不同工艺制备的海桐皮汤提取膏的抗炎镇痛作用及其可能机制。
抗炎药物需要同时具有镇痛活性,热板痛和扭体反应是两种常用评价药物镇痛潜能的实验。本实验结果显示在末次给药后30、60 min 及90 min 工艺1 组、工艺2 组、扶他林组的痛阈值均明显高于模型组,工艺1 组的痛阈值高于工艺2 组,且在末次给药60、120 min 后,工艺1 组的痛阈值与扶他林组无统计学差异。研究表明,腹腔注射醋酸可导致小鼠腹膜紧张,并激活血清素、组胺、缓激肽和前列腺素等炎症介质的合成和释放,诱导小鼠出现腹部收缩、身体扭曲、背部拱起及活动减少等扭体反应[31]。本实验显示,两种不同工艺获取的海桐皮汤提取膏均可起到延长小鼠扭体潜伏期,减少小鼠扭体次数的作用,且工艺1 组的作用效果与扶他林组相似。结果表明,海桐皮汤提取膏具有外周镇痛效应,且将含挥发油类的药物进行挥发油及水煎液提取另存的工艺1 制备方法更优。
二甲苯诱导小鼠耳肿胀和角叉菜胶诱导小鼠足部肿胀是急性炎症模型,被广泛应用于抗炎药物的疗效评价和化合物的抗炎活性筛选[32]。角叉菜胶诱导的小鼠足部水肿主要为炎症早期的渗出性水肿,其导致的渗出性水肿根据释放炎性介质的不同,可分为两个阶段:第一阶段为足部注射角叉菜胶2 h 内,炎性介质主要为组胺、血清素和缓激肽;第二阶段为角叉菜胶注射2 h 后,炎症由前列腺素和环氧合酶等炎性物质的释放所介导,此外,第二阶段与局部和全身炎症有关,也是非甾体类抗炎药的作用靶点[33,34]。本实验证明,工艺1、工艺2 制备的海桐皮汤提取膏均可明显抑制角叉菜胶诱导的两个阶段的渗出性水肿,减少小鼠足部肿胀度及肿胀率,且工艺1 优于工艺2。根据实验结果推测,海桐皮汤提取膏抗炎与组胺、血清素、缓激肽和前列腺素表达下调及抑制环氧酶活性等相关。
TNF-α、IL-1β、IL-6 作为参与机体免疫应答、免疫调节及炎性反应的重要细胞因子已得到证实[35]。同时,研究发现TNF-α 通过旁分泌和自分泌的形式调节细胞和体液免疫,过量的TNF-α 可异常激活核转录因子(NF-κB)等信号通路,可进一步导致炎症、自身免疫性疾病的发生[41]。此外,还可大量诱导产生包括IL-1β、IL-6 在内的促炎性细胞因子[36]。简言之,上述细胞因子过度存在会使增加炎症介质,形成炎症级联效应,故对抑制细胞因子的过量释放也是评价药物抗炎潜能的重要指标[37]。临床试验证明,予以抗TNF-α 和抗IL-1β 治疗对类风湿性关节炎有确切疗效[38]。本实验结果证实,工艺1 和工艺2制备的海桐皮汤提取膏可降低角叉菜胶诱导的足肿胀模型小鼠血清中的TNF-α、IL-1β 含量,且工艺1 组降低IL-1β 过度表达的效果优于工艺2。
相比于现有的氮酮、二甲基亚砜等促渗剂,中药挥发油兼具较强透皮吸收促进作用与皮肤刺激及毒副作用小的同时,尚能与透皮吸收的药物产生协同作用,现已成为经皮给药吸收促进剂的研究热点[39]。研究显示,已有34 味中药挥发油被作为透皮促渗剂应用,其中包含了海桐皮汤中的当归、川椒、川芎、红花、白芷、防风等中药[40]。本实验结果提示,工艺1 制备的海桐皮汤提取膏抗炎镇痛效果优于工艺2,而工艺1 与工艺2 最大的区别在于对中药挥发油的提取与另存,故推断中药挥发油的单独提取与另存是工艺1 优于工艺2 的主要原因所在。
综上所述,两种不同工艺制备的海桐皮汤提取膏均有一定的抗炎镇痛作用,其可能的机制是抑制了TNF-α、IL-1β、IL-6 等促炎性细胞因子的释放,尤其是IL-1β。就工艺制备而言,工艺1 的抗炎镇痛效果优于工艺2,原因可能与中药挥发油的单独提取、储存相关,此工艺保证了挥发油有较长时效的药理活性。
作者贡献度说明:
李法杰、谷金玉:设计本实验;李法杰、谷金玉、万田豪、夏迪:负责动物造模、药物干预、取材、指标检测;沈硕、姚瑶:经不同工艺制备了海桐皮汤提取膏;张悦:进行数据统计分析;李法杰:撰写文章;张清:审核。
