质量控制对单采双份血小板的影响分析
2022-08-19王静
王静
随着社会科学技术的发展,临床医学设备也在不断的发展。血制品是临床治疗中一种非常特殊的制品,与普通的药物不同,血制品均是由其他健康人员身体内部捐献而来。我国一直大力提倡无偿献血制度,且有越来越多的社会健康人员积极加入到无偿献血的队伍中,无偿献血的人数逐年上升。献血主要分为两种,一种是献全血,另一种则是成分献血。而随着成分输血的开展,单采血小板已经能够成功的进行了普及。血小板的输注效果常常和单次血小板的输注数量有关,并且在长久的研究中发现,反复输注容易导致受血者出现血小板抗体,从而造成输注失败。因此,在血小板的输注过程中常常需要医院做到单次输入量足的情况[1]。而另一方面,对于血小板高计数的献血者采用双份血小板采集的方式能够有效地缓解供血不足的情况[2]。为了在单采血小板的过程中具有更好的采集质量,同时保证献血者的安全性,本站采用了对比研究的方式探究在单采双份血小板的过程中进行质量控制的作用和影响。现将资料整理报告如下。
1 资料与方法
1.1 一般资料 选择本站在2019 年5 月~2020 年5 月期间进行血液采集的献血者共计100 例,随机将献血者分为对照组和观察组,每组50 例。对照组中男35 例,女15 例;年龄18~42 岁,平均年龄(31.42±2.54)岁;身高153~186 cm,平均身高(171.12±3.38)cm;体重50~95 kg,平均体重(61.34±5.61)kg。观察组中男35 例,女15 例;年龄18~45 岁,平均年龄(32.41±3.18)岁;身高153~180 cm,平均身高(171.54±3.85)cm;体重50~96 kg,平均体重(61.74±5.47)kg。两组一般资料对比差异无统计学意义(P>0.05),具有可比性。本次研究已经通过了医院伦理委员会的审批;所有献血者均对本次研究的全过程知情,且签署了知情书。
1.2 纳入标准 ①献血者均为自愿参与本次研究过程,且知晓本次试验的全过程;②所有献血者的体重需>50 kg;③在采集前,献血者的血小板计数(PLT)需要≥250×109/L;④献血者无传染性疾病和相关的血液疾病,体检结果显示健康。
1.3 排除标准 ①对本次研究结果不认同的,拒绝签署知情书的献血者;②体重过轻或年龄过小的献血者;③献血者没有良好的表达能力,存在精神疾病的献血者;④存在凝血功能障碍的献血者;⑤有长期服用镇痛药物史的献血者;⑥尚处于妊娠期与哺乳期中的献血者;⑦合并恶性肿瘤的献血者;⑧存在高血压、冠心病等慢性疾病的献血者;⑨其他不符合纳入标准的献血者。
1.4 方法
1.4.1 采集前检测
1.4.1.1 外室标本留取 ①核对献血者的身份,将登记条码粘贴在《献血者知情同意及健康状况征询表》的相应位置,在“启奥血站管理信息系统”录入献血者的基本信息并扫描登记号保存;②将与登记条码相同编号的“标本”签粘贴在标本管上,用5 ml 注射器采集5 ml 静脉血,留取约4 ml 于标本管内与抗凝剂充分混匀,待进行血常规检测;③再次核对标本管与登记表的条码号是否一致。将注射器内剩余的少量血液于离心管中,并在离心管上编写条码号的后三位数,离心,待检测谷丙转氨酶(ALT)。
1.4.1.2 谷丙转氨酶检测 两组献血者均采用生化分析仪(测试谷丙转氨酶)进行采集前检测谷丙转氨酶:①样本测试:a.质控样品测试:先测试质控品,记录机器测试质控结果值;根据质控结果进行对比,确定合格样本值;b.标本测试:根据机器提示,依次测试标本,等待测试结果。②谷丙转氨酶试剂配置和准备:a.将R2 试剂倒入R1 试剂瓶内混匀即为谷丙转氨酶工作液(试剂);将R2 试剂瓶蓝色盖子盖在R1 试剂瓶上,以表示该瓶溶液为配制好的工作液,在瓶身上记录配制时间。b.用移液器加谷丙转氨酶工作液500 μl 至塑料试管中,作为测试备用。可一次准备多个试管的工作液。移取适量工作液后,剩余及时放入冰箱冷藏保存。③采血与测试:a.抽取静脉血0.5~0.6 ml 加入抗凝离心管中,并使血液和抗凝剂混匀。b.将抗凝离心管盖严并对称放入离心机中,开启离心机。c.从停止工作的离心机中取出离心管,首先观察是否脂血,若为脂血则终止检测,个人数字助理(PDA)录入“脂血”,告知献血者延缓献血。d.用移液器从离心管中吸入40 μl 血清至准备好的盛有500 μl 谷丙转氨酶工作液试管中,混匀测试,并将测试结果录入PDA。e.如有多个样本可以连续测试但连续测试时,不要一次混匀多个样本,做一个样本混匀一个样本。f.结果判定标准:谷丙转氨酶≤50 U/L 判定为合格,否则为不合格。
1.4.1.3 血生化计数检测 两组献血者均采用全自动血液分析仪 (Sysmex XS-500i)进行采集前检测血生化计数。①质控品检查准备。a.质控品在使用前后均保存于2~8℃冰箱,使用后用湿巾将瓶盖及瓶口处血渍擦拭干净并立即放入冰箱。b.取出质控品,确认质控品的批号、效期及质控品的容量,并将质控品放置室温环境下(18~30℃)15 min;将质控品瓶置于双手掌心,来回转动10 次,瓶倒置后再来回转动10 次,颠倒混匀10 次,重复以上动作8 次以上,或者2 min。查看瓶底是否已经没有细胞固状球体粘附,以确保质控混合完整,准备测量。②质控检测。a.选择好质控文件后,确认打开所选有效期内质控文件,混匀质控标本,开始分析质控样本,分析完成后跳出质控样本分析结果,观察结果是否在控,若在控按“接受”按钮退出,开始检测献血者样本,若失控按“取消”退出,查找原因,继续检测质控样本,直到质控结果在控。b.样品检测:点击手动进入“手工样本号”对话框,选择分析模式“CBC+DIFF”,末梢全血要求尽量采集≥50 μl,混匀标本,置于样本针下,按“开始”键开始分析样本。分析结束后在“浏览器”下的“主屏”界面,观看结果直方图和散点图,判断是否需要复片。c.将测量结果录入PDA,PDA 上点击“智能采血”,输入个人账号及密码,点击“登录”→工作表,选WS211029001-站内单采模式-机采成分科→完成→初筛→PDA 扫描体检表条形码→依次输入身高、体重、血型、谷丙转氨酶、血红蛋白(Hb)、红细胞压积(HCT)、PLT、白细胞→PDA 再次扫描体检表条形码自动保存。d.结果判定标准:Hb 男≥120 g/L,女≥115 g/L;HCT≥0.36;PLT≥150×109/L 且<450×109/L ;各项均符合即为合格,否则其中任一项不符合即视为不合格。
1.4.1.4 收尾 快速检测合格后,PDA 电脑录入,核对无误引导献血者到机采室内采集单采血小板。
1.4.2 采集方法
1.4.2.1 对照组 献血者采用常规双份血小板采集方案。环境要求:温度15~28℃,相对湿度≤80%,周围通风、散热。选择单针血小板采集程序,正确安装消耗品管路并进行管路检测及初始化,在选择程序后、初始化过程中或初始化完成均可输入献血者信息及采集参数并保存传输数据;采血前PDA 扫描机器编号对所用耗材及辅料核查,确保在有效期内使用,对献血者进行身份核查,确保其符合《献血者健康检查要求》;采用Amicus 血细胞分离机,根据献血者的体重情况设置相关的参数。采集速度控制在90 ml/min,回血速度控制在100 ml/min,血小板的预设值控制在5.0×1011/L。采集原理:将献血者的全血通入到特制的封闭管路中,利用离心的原理将献血者的血液分为不同的层面,然后将需要的层面进行抽取后,将剩余的血液回输回献血者身体内。
献血者静脉穿刺前常规口服葡萄糖酸钙20 ml,采集过程中根据献血者的身体状态和循环处理血量再给予适量葡萄糖酸钙口服;将统一编号的识别条码,依次贴于该献血员的登记表、耗材、标本管、血小板保存袋、留样管小辫且连续完成一一对应,粘贴无误;从“留样袋”中 留取“酶免”和“核酸”检测标本血液各约5 ml,颠倒8 次混匀。按照《单采成分血标本留取操作规程》留取血标本,在PDA 进行机采标本同源性核查;采集血小板的同时,收集一定量的血浆,使最终单采血小板制品符合GB18469-2012《全血及成份血质量要求》。
1.4.2.2 观察组 献血者在对照组基础上使用质量控制方案进行控制,主要措施包括以下几个方面。①献血者筛查:为了保证双份血小板采集的有效率,在进行采集前需要对献血者进行一定的筛查。首先献血者需要符合采集前PLT≥250×109/L 的要求。同时献血者在供血前1 个月内没有服用过阿司匹林等药物,且献血者在血液采集前没有出现饥饿、疲乏和劳累等状况,献血者应该得到良好的休息,精神状态良好,符合基本供血需求。同时在检测前需要针对于献血者的血液情况做二次的血液指标检测。②调整血细胞分离机的参数:在血液采集的过程中,需要合理设置血液采集机的参数,以保证采集效果。界面探测值设定为10,可以采集到更多的血小板的同时,能够尽量的减少红细胞和白细胞的污染情况。在血小板的收集过程中需要对献血者各方面因素考虑周全。同时可以采用预算值、全血处理量、血浆处理量等多项指标针对于献血者的采集状况进行控制。③设备保养:为了保证采集的血小板的有效率。在日常工作中需要做好采集器的保养工作,严格实行对机器的日、周、月三级保养制度,保证机器能够时刻处于最佳状态。机器出现问题时,需要立刻进行检修。④做好人员培训:为了保证采集效率和采集质量,需要定期对科室内的相关人员进行轮岗培训。对已掌握的技能进行考核的同时促进新能力的学习,让相关的医护人员能时刻保持良好的采血能力,从而保证在进行采血工作的过程中的积极性和有效性。⑤规范化流程:在进行采血工作的过程中,为了保证采集到的血小板的质量,需要建立标准化的采集和保存流程。让献血者的血液能够在采集后快速地进行保存,从而保证血小板的采集的有效率。
1.5 观察指标及判定标准 对比两组献血者血小板采集达标情况,不良事件发生情况,供血过程满意情况。①血小板采集不合格标准:PLT<2.5×1011/L 或红细胞计数>8×109/L 或白细胞计数>5×108/L。②供血过程中的不良事件主要包括低血钙、血流不畅、血管痉挛、意识障碍。③对两组献血者进行满意度调查,分析献血者对供血流程的满意程度,分为满意、比较满意、不满意3 个阶段,总满意率=(满意+比较满意)/总例数×100%。
1.6 统计学方法 采用SPSS22.0 统计学软件对数据进行处理。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组献血者血小板采集达标情况对比 观察组献血者的血小板达标率92%、白细胞达标率96%、整体达标率88%均显著高于对照组的78%、84%、68%,差异具有统计学意义(P<0.05);两组献血者的红细胞达标率均为100%,组间比较差异无统计学意义(P>0.05)。见表1。
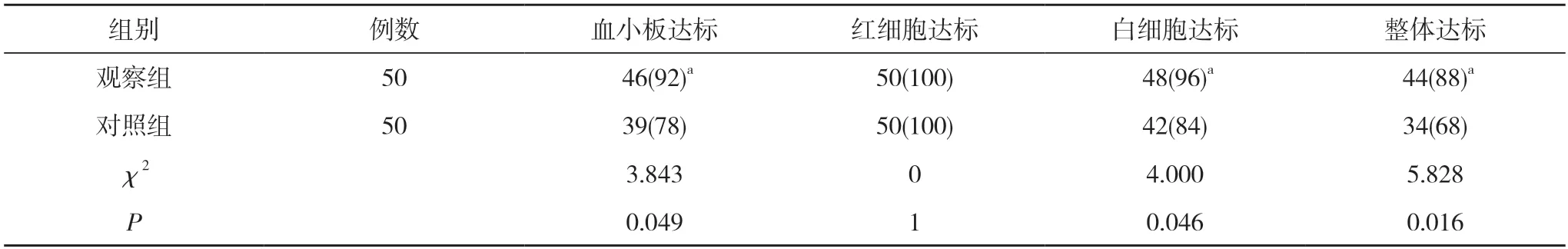
表1 两组献血者血小板采集达标情况对比[n(%)]
2.2 两组献血者不良事件发生情况对比 观察组献血者的不良事件的发生率为20%,显著低于对照组的40%,差异具有统计学意义(P<0.05)。见表2。

表2 两组献血者不良事件发生情况对比[n(%),%]
2.3 两组献血者供血过程满意情况对比 观察组献血者的供血过程总满意率为92%,显著高于对照组的78%,差异具有统计学意义(P<0.05)。见表3。
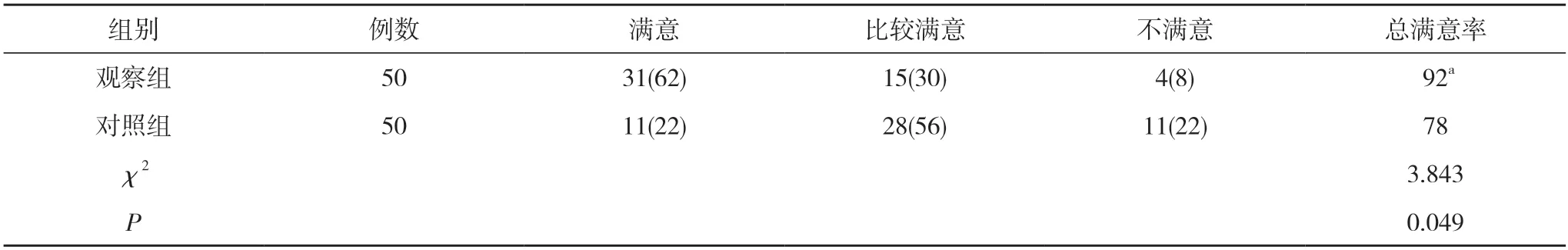
表3 两组献血者供血过程满意情况对比[n(%),%]
3 讨论
目前,在临床医学上血小板输注的治疗方案应用较广,这就使得医院血小板的库存数量常年处于不足的状态[3]。单采双份血小板能够很好的缓解这种状态[4]。在献血者进行血小板采集的过程中通过单采双血小板的方式能够在不伤害献血者的身体的情况下采集到双份的血小板。但是在这过程中需要格外注意质量控制[5]。
献血不良事件是献血过程中献血者出现的不良症状,不仅会给采血工作带来不便,极有可能导致献血者不愿重复献血,对无偿献血队伍的建立造成一定的影响[6]。在单采双份血小板的过程中,采用质量控制能够保证对献血者进行更为深入的筛选工作,从而降低双份血小板采集过程中对献血者的身体造成损伤的几率[7,8]。同时质量控制手法能够通过对医生的培训、对整体流程的梳理、对相关的标准的制定等方式来保证在献血者血小板采集全过程中做到对血小板的正确保护,以提升血小板的采集有效率,降低采集成本,让采血科室能够针对于献血者的不同情况调整血小板的采集数量[9]。在本此研究中可以明显看出,观察组献血者的血小板达标率92%、白细胞达标率96%、整体达标率88%均显著高于对照组的78%、84%、68%,差异具有统计学意义(P<0.05);两组献血者的红细胞达标率均为100%,组间比较差异无统计学意义(P>0.05)。观察组献血者的不良事件的发生率为20%,显著低于对照组的40%,差异具有统计学意义(P<0.05)。观察组献血者的供血过程总满意率为92%,显著高于对照组的78%,差异具有统计学意义(P<0.05)。与谭咏恩等[10]的研究结论类似。由此证实,单采双份血小板过程中进行质量控制能够降低献血者不良事件的发生率,并提升其整体的采集有效率,同时,还可以提升献血者对供血流程的满意度,效果较好。
综上所述,采用单采双血小板能够有效缓解医院用血紧张问题,同时不会对献血者造成伤害。在采血的过程中使用质量控制方案,能够提升采集的血小板的有效率,改善采血流程,提升献血者的满意度,值得在临床上进行推广与应用。
