乳蛋白对豆乳凝胶物性学特征的影响机理
2022-07-07徐若琳庞志花陈存社刘新旗赵奕昕
徐若琳,刘 萍,庞志花,*,陈存社,刘新旗,赵奕昕,李 通
(1.北京工商大学 北京食品营养与人类健康高精尖创新中心,北京 100048;2.中国肉类食品综合研究中心,北京 100068)
大豆起源于我国,但我国对其副产品的加工工业起步较晚,发展也较为缓慢,而随着市场的需求以及消费水平的逐步提高,低成本高蛋白的大豆制品越来越受到消费者的关注。豆乳酸奶是以大豆为原料发酵而成的酸奶制品,是一种相对较新的产品,学术界和工业界等各界人士对该产品越来越感兴趣。然而,与传统的牛乳发酵的酸奶相比,豆乳酸奶存在口感质地粗糙等缺陷,严重阻碍了其商业化。蛋白质是该体系中形成凝胶的主要物质组分,对其凝胶特性以及微观结构有直接的影响,从而影响其口感质地。因此,重组蛋白质组成应该是调节豆乳凝胶质地最直接的方法。雷永刚研究了添加大豆蛋白和乳清蛋白对大豆酸奶物性特征、微观结构以及感官品质的影响;Roesch等通过改变脱脂奶粉与大豆蛋白浓缩物的比例,调节酸化凝胶的微观结构和黏弹性特性;Jose等混合了乳清和大豆蛋白,并随着乳清蛋白比例的增加,获得了具有较高凝胶强度和持水能力的凝胶;Granata等通过添加酪蛋白酸盐、酪蛋白水解物以及乳清蛋白水解物改善豆乳酸奶类产品的质地,其中添加酪蛋白酸盐和酪蛋白水解物的产品质地更贴近牛乳酸奶。可见科学组配大豆蛋白和乳蛋白可以改善豆乳酸奶的口感质地,从而充分利用大豆蛋白资源,拓宽豆乳酸奶市场,对于缓解我国乳源紧张局面、增强大豆蛋白质的深加工利用具有重要意义。然而,由于不同类型乳蛋白的分子特性不同,不同类型乳蛋白和大豆蛋白混合凝胶的形成机制应该是不同的,从而诱导出不同性质的凝胶,所以乳蛋白对豆乳凝胶的机理影响的研究至关重要。
在混合体系中,乳蛋白和大豆蛋白都能形成凝胶结构,但大豆蛋白由于其较高的等电点而被认为先于乳蛋白形成凝胶。然而,通过在加热过程中与大豆蛋白形成复合物,乳清蛋白可以参与大豆蛋白的凝胶化。而酪蛋白和大豆蛋白之间缺少相互作用,在混合凝胶体系中容易发生空间位阻效应以及填充效应,对凝胶强度产生影响。因此,初步推断由于大豆蛋白与乳清蛋白和酪蛋白间的相互作用程度不同,以及天然酪蛋白与部分解离酪蛋白的分子结构不同,如酪蛋白酸钠(sodium caseinate,NaCas),从而会对豆乳凝胶化机制产生不同的影响。本研究选取3种乳蛋白粉,即同时含有胶束酪蛋白和乳清蛋白的乳浓缩蛋白(milk protein concentrate,MPC)、乳清分离蛋白(whey protein isolate,WPI)以及NaCas,分别从体系层面、颗粒层面以及分子层面探讨不同类型乳蛋白对豆乳凝胶化的影响机理,从而改善豆乳酸奶制品的口感,利于豆乳酸奶产业的发展。
1 材料与方法
1.1 材料与试剂
C42豆乳粉(蛋白质含量39.7%) 黑龙江省农垦龙王食品有限责任公司;MPC70粉(蛋白质含量69.5%)银川市金河乳业有限公司;WPI粉(蛋白质含量91%)美国Hilmar公司;NaCas粉(蛋白质含量85%) 河北百味生物科技有限公司。
葡萄糖--内酯(glucono--lactone,GDL) 西格玛奥德里奇(上海)贸易有限公司;牛血清白蛋白(bovine serum albumin,BSA) 北京百奥森泰生物技术有限公司;考马斯亮蓝G-250 天津市津科精细化工研究所;实验所用水均为蒸馏水。
1.2 仪器与设备
KQ-500DE数控超声波清洗器 昆山市超声仪器有限公司;D-3L高压均质机 美国PhD-Tech公司;DHR-1流变仪 美国TA仪器公司;SU8180扫描电子显微镜株式会社日立制作所;IXMTD203 HH系列数显恒温水浴锅 江苏金坛市科析仪器有限公司;AR1502CN电子天平 奥豪斯仪器(上海)有限公司;EURO-ST40DS025电子搅拌器 德国IKA公司;ECO-70雪花制冰机 上海领德仪器有限公司;MJ系列生化培养箱 上海一恒科学仪器有限公司;FE20K pH计梅特勒-托利多仪器(上海)有限公司;FOSS-8400全自动凯式定氮仪 丹麦福斯集团公司;X-30R台式高速离心机 美国贝克曼库尔特有限公司;SALD-3000激光衍射粒度仪 日本岛津制作所。
1.3 方法
1.3.1 豆乳凝胶的制备
选用的C42豆乳粉是在135~140 ℃加热5 s使酶失活后,在92~96 ℃经降膜蒸发器消毒并浓缩,再经喷雾干燥制得。在保证豆乳凝胶最终蛋白质含量为4.5%(/)的前提下,将所需量的C42豆乳粉末分散在去离子水中恒定搅拌30 min,制备重组纯豆乳得到对照组。实验组则是将3种乳蛋白粉(MPC、WPI、NaCas)分别以1∶9、2∶8、4∶6(/)替代部分大豆蛋白(C42豆乳粉),在去离子水中溶解并用电动搅拌器分散搅拌30 min,制备混合溶液。为使其充分溶解,在功率300 W的条件下超声5 min,并利用均质机加压10 000 psi,均质后分装为50 g一份,4 ℃过夜保存。隔天在95 ℃水浴锅中热处理10 min,取出后迅速用冰水浴降温到40 ℃,添加1.675%(/)的GDL,置于40 ℃水浴锅中培养4 h酸化后取出,待降温至10 ℃(pH 4.5)冷藏于4 ℃冰箱中后熟48 h。
1.3.2 添加乳蛋白的豆乳凝胶的乳清制备
准确称取200 g原料于250 mL离心瓶中,置于40 ℃水浴锅酸化成凝胶,在4 ℃生化培养箱后熟48 h后取出。在3 000×、4 ℃条件下离心30 min,取上清液于3 500 Da透析袋中,透析3 h。利用冷冻干燥机将上清液冻干,于密封袋中-20 ℃保存,用于蛋白组成分析。
1.3.3 黏弹性的测定
采用DHR-1流变仪对豆乳凝胶进行剪切扫描、频率扫描测定。将4 ℃生化培养箱中后熟2 d的样品顺时针轻轻搅拌10 次,再逆时针搅拌10 次。然后取适量样品放置于流变仪的底板,对样品进行修边而不过度干扰样品。在频率0.01~10 Hz、应变0.5%,温度4 ℃条件下,采用小振幅频率扫描法测定豆乳凝胶的流变特性,得到弹性模量(’)、黏性模量(″)随频率的变化曲线。
1.3.4 粒径测定
利用SALD-3000激光衍射粒度仪测量凝胶中蛋白凝聚物的粒度分布。将4 ℃生化培养箱中后熟48 h的凝胶样品搅拌均匀后,用蒸馏水稀释10 倍,在涡旋振荡器上振动15 s混匀,立即取适量样品于流通池内进行连续测量。粒子折射率为1.45,精准率为0.001。得到平均粒径()、、、数据后,按下式计算颗粒差异度:

1.3.5 微观结构测定
利用扫描电子显微镜观察豆乳凝胶的微观结构。从表面下约1 cm处取出凝胶样品并安装在铝制样品架上。样品在-210 ℃被浸入液氮浆液后,冷冻标本转入低温制备室,在-140 ℃用冷刀片进行断裂,此后在-68~-65 ℃刻蚀破碎的样品12 min,最后样品被转移到冷阶段。对凝胶扫描电镜图像进行分析,获得典型的集料尺寸,对放大3 000 倍图像进行分析。
1.3.6 豆乳凝胶乳清中蛋白含量测定
利用Bradford的蛋白质-染料结合的原理,以BSA为标准,测定凝胶上清液中蛋白质含量。考马斯亮蓝G-250染料在酸性溶液中与蛋白质结合,在最大吸收峰595 nm波长处具有强吸收,通过测定595 nm波长处的吸光度增量,可得蛋白含量。
1.3.7 聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析
采用不连续SDS-PAGE法进行分析,将各样品的上清液冻干粉用蒸馏水配比成蛋白质浓度相同的溶液,与上样缓冲液以3∶1(/)混匀,沸水浴10 min,冷却至室温后上样,上样量为10 μL。根据目标蛋白分子质量分布范围,MPC、NaCas的分离胶质量分数为12%,WPI的分离胶质量分数为15%,浓缩胶质量分数均为5%。样品在浓缩胶时电压为80 V,跑到分离胶时将电压调至100 V。当条带跑到泳道末端后取胶,利用考马斯亮蓝G-250在摇床染色30 min后脱色,最后利用蛋白质凝胶成像系统观察并分析电泳谱图,绘制光密度扫描图。
1.4 数据处理
实验数据采用Excel 2010、SPSS 10.0统计分析软件进行分析处理,每组实验有3个平行。采用Tukey检验方法,在95%的置信水平下,进行差异显著性分析。
2 结果与分析
2.1 豆乳凝胶的流变学特性
由图1可知,在0.01~10 Hz,豆乳凝胶的和值随着扫描频率的增大均呈增加的趋势,且所有样品的值都大于值,这表明所有的凝胶都是弹性成分占优势,且样品表现出类固体的特征。添加WPI(≥20%)以及40% NaCas的凝胶表现出更高黏弹性,而其他样品与纯豆乳凝胶相比差异较小,说明添加WPI(≥20%)以及40% NaCas的凝胶结构更为致密,凝胶强度更高。此外,相同添加比例下,较高添加比例WPI(≥20%)凝胶的和值均大于其他两种乳蛋白凝胶,可见较高添加比例WPI(≥20%)对豆乳凝胶强度的影响最大,这可能与乳清蛋白和大豆蛋白在热处理过程中通过二硫桥的相互作用形成复合物相关;而酪蛋白与大豆蛋白之间并没有显著的相互作用。此外,乳蛋白的等电点低于大豆蛋白(乳清蛋白等电点为5.5,酪蛋白为4.6),在酸化阶段pH值降低,添加MPC或WPI均会由于蛋白质间的相互作用及其自身凝胶特性缩短凝胶化时间,其中添加WPI的凝胶体系由于巯基与二硫键之间的疏水相互作用和交换反应会比MPC更早发生凝胶化。因此,WPI比MPC具有更显著的影响。另一方面,NaCas是通过调整牛乳pH值到等电点从而沉淀酪蛋白并去除乳清后,再利用NaOH将pH值调整到7.0后干燥得到。在此过程中,基本上所有的胶体磷酸钙都被溶解,导致酪蛋白胶束解离成较小的颗粒。因此,添加NaCas的凝胶体系的聚集相较其他两种较缓慢。
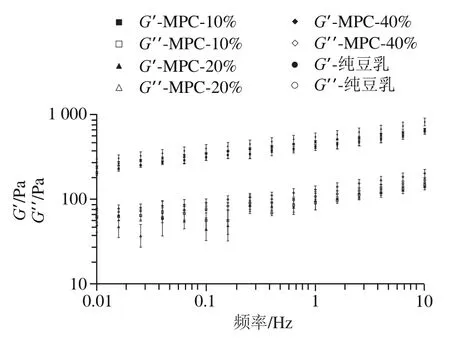

图1 添加不同比例乳蛋白的豆乳凝胶频率扫描曲线Fig. 1 Frequency sweep curves for soymilk gels with different levels of milk proteins added
2.2 豆乳凝胶的粒径
在蛋白质聚集过程中,颗粒度常用来表征蛋白聚集程度,直接影响产品的口感,尤其是滑润感。由表1可知,MPC的加入显著降低了体系的;但随着MPC添加比例的增大,凝胶体系的大颗粒比例增加,颗粒差异度上升。这可能是由于添加MPC的豆乳凝胶存在尚未参与聚集反应的酪蛋白胶束或者聚集程度较低的聚集体;同时MPC比例的升高也会增加乳清蛋白的比例,其与大豆蛋白的相互作用,可以形成较大的凝胶颗粒;另外大量酪蛋白胶束的存在也可能导致蛋白体系的分离,从而加剧了大豆蛋白的聚合。添加WPI(≤20%)时,体系的显著降低,这也进一步证明较低替代比例的乳清蛋白可以减小凝胶体系的粒径;而40%的替代比例导致体系显著增大,高达105.96 μm,可能是由于WPI具有极高的水结合能力,高替代比例下的聚集体可能无法在上清液中溶解,同时在酸化阶段大量双蛋白复合物形成聚集体,导致高添加比例下粒径增大。NaCas在低添加比例下(10%)可以显著降低豆乳凝胶的;在不小于20%的添加比例下,混合凝胶与纯豆乳凝胶的无显著差异,但颗粒差异度显著增大,这可能是由于NaCas钠离子的释放导致更严重的大豆蛋白聚集。Martin等报道了NaCas与大豆蛋白的混合会增大热处理后体系的粒径。对比添加40% 3种蛋白粉豆乳凝胶的,与纯豆乳凝胶相比,NaCas凝胶的没有显著差异,WPI凝胶的显著增大,而MPC凝胶的显著减小。由此可见,相较其他两种乳蛋白,添加40% WPI的豆乳凝胶易形成更大的聚集体。

表1 添加不同比例乳蛋白的豆乳凝胶的粒径分析Table 1 Particle size analysis of soymilk gels with different levels of milk proteins added
2.3 豆乳凝胶的微观结构
凝胶的微观结构与其凝胶强度、持水性等宏观物理性质密切相关。由图2可知,4种豆乳凝胶均成三维网络状结构。纯豆乳的框架结构呈三维纤维网络絮状,其孔隙较均匀且规则,一些枝杈的末梢会有小球状的结团,这与报道的结构一致。相比纯豆乳凝胶,添加MPC的豆乳凝胶网状结构会更细腻,且枝杈不呈水滴状;相对添加其他两种乳蛋白粉的豆乳凝胶,其孔隙更为密集且规则;添加MPC的豆乳凝胶的锁水能力更强,结构更为稳定。添加NaCas的豆乳凝胶的结构框架由更多的丝状物组成,其纤维网状立体结构的支架可能是含有一部分大小不同的变性酪蛋白颗粒堆积形成,没有形成很致密的链状结构。添加WPI的豆乳凝胶框架结构相较前两者呈扁平状,胶体结构更为复杂,框架网络结构较不规则,显示与空白较大的差异。
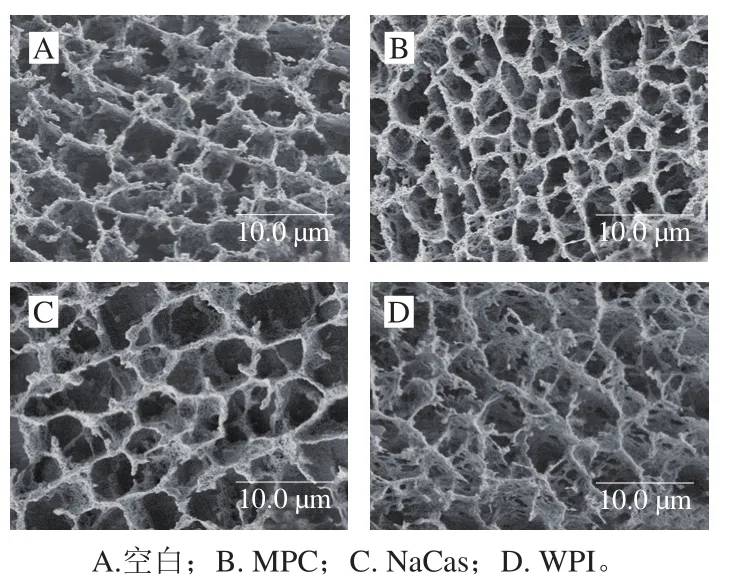
图2 添加不同乳蛋白比例为40%的豆乳凝胶的微观结构Fig. 2 Scanning electron micrographs of soymilk gels with 40% milk proteins added
2.4 豆乳凝胶上清液的蛋白质组成分析

图3 添加不同比例乳蛋白的豆乳凝胶的上清液电泳图Fig. 3 SDS-PAGE patterns of soymilk gel supernatants with different levels of milk proteins adde
为了进一步分析乳蛋白的凝胶参与情况,及其对大豆蛋白的凝胶参与情况的作用,利用SDS-PAGE法分析凝胶上清液,所得电泳图谱如图3所示。利用Image Lab软件对豆乳凝胶上清液中蛋白组分进行定性和相对含量测定,各目标蛋白条带颜色深度(即trace值)与蛋白质浓度在一定范围内呈线性关系,因此可求得各个条带的相对比例,从而进行泳道之间蛋白相对含量对比,进而初判参与形成凝胶的蛋白质,探究乳蛋白对豆乳凝胶形成的影响。
大豆蛋白的不同亚基在凝胶过程中起不同作用,一些蛋白可能并不参与凝胶的形成。如图4和表2所示,豆乳粉中主要形成凝胶的是大豆7S蛋白的’、、亚基和大豆11S蛋白的酸性亚基(11S-AS)、碱性亚基(11SBS)。不少学者研究表明,这可能是由于豆乳蛋白颗粒的核心部分是由11S-BS与7S的亚基相互作用形成,表现为疏水性,粒子表面亲水性较强的11S-AS和7S的’、亚基,使豆乳蛋白粒子较稳定地存在于豆乳体系中。由图3、4可知,添加3种乳蛋白后,上清液中分子质量在75~145 kDa的蛋白相对含量几乎为0,说明3种乳蛋白的添加对7S的’、亚基的凝胶化没有影响。如图4a所示,添加NaCas的凝胶上清液中,-酪蛋白和、-酪蛋白的强度显著下降,说明NaCas中、-酪蛋白以及-酪蛋白会参与凝胶形成,结合表3可知,11S-BS的相对含量显著升高,说明NaCas会阻碍大豆粉中11S-BS凝胶化。WPI中-乳球蛋白(-lactoglobulin,-Lg)是含量最高且极易受温度影响的一类蛋白,当温度高于30 ℃时其二聚体发生解离,三级球状结构解体,螺旋结构消失。如图4b所示,添加WPI的凝胶上清液中,-Lg和-乳白蛋白(-lactalbumin,-La)的强度显著下降,说明WPI中-Lg与-La参与凝胶形成,结合表4可知,添加较低比例WPI(≤20%)的凝胶上清液中7S-的相对含量显著下降,说明该条件下WPI中-Lg与-La参与凝胶形成的同时可能会促进7S-凝胶化。如图4c所示,MPC中主要形成凝胶的是-Lg、BSA和、-酪蛋白以及部分-La和-酪蛋白,结合表4、5可知,与添加WPI的凝胶上清液相比,添加MPC的凝胶上清液中-Lg的相对含量为0%,有可能是由于乳蛋白间的疏水作用促进了酪蛋白与-Lg的结合。
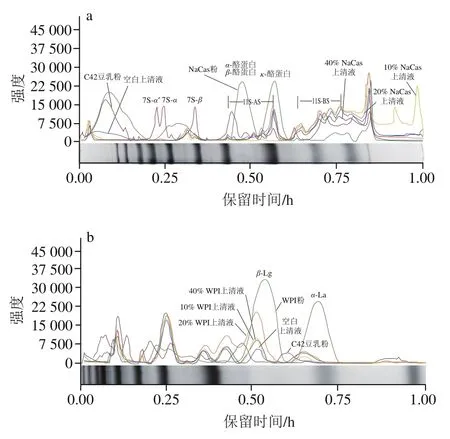
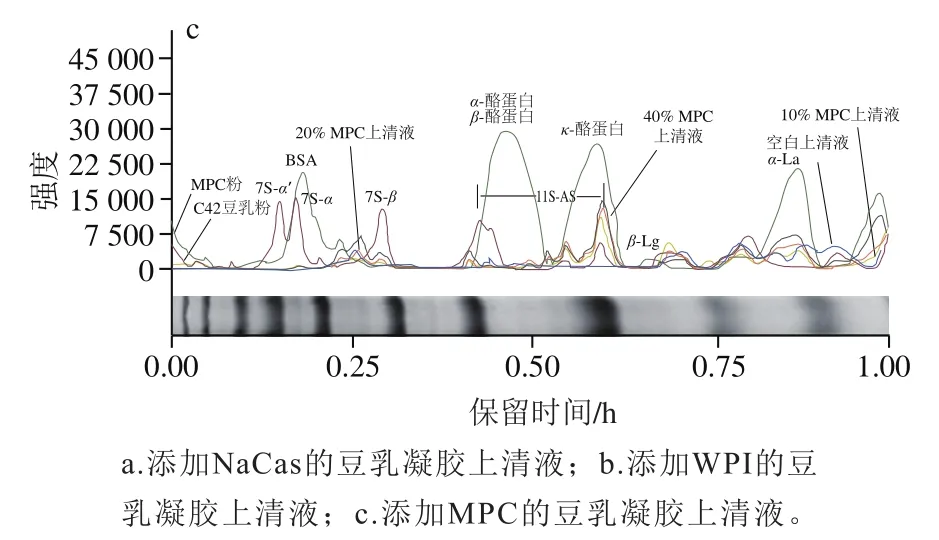
图4 添加不同比例乳蛋白的豆乳凝胶的SDS-PAGE图谱光密度扫描Fig. 4 Optical density scanning of SDS-PAGE patterns of soymilk gels with different levels of milk proteins added

表2 不同种类乳蛋白和大豆蛋白的电泳谱图数据分析Table 2 Analysis of SDS-PAGE patterns of different types of milk proteins and soy proteins

表3 添加不同比例NaCas的豆乳凝胶的电泳谱图数据分析Table 3 Analysis of SDS-PAGE patterns of soybean milk gels with different levels of NaCas added

表4 添加不同比例WPI的豆乳凝胶的电泳谱图数据分析Table 4 Analysis of SDS-PAGE patterns of soybean milk gels with different levels of WPI added
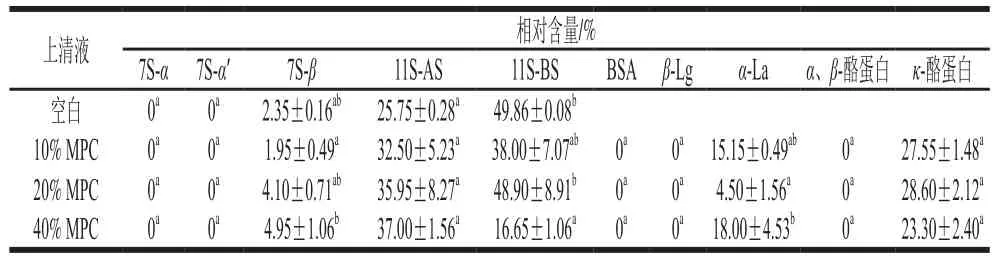
表5 添加不同比例MPC的豆乳凝胶的电泳谱图数据分析Table 5 Analysis of SDS-PAGE patterns of soybean milk gels with different levels of MPC added
3 结 论
通过不同层面研究了3种不同类型乳蛋白对豆乳凝胶化的影响及机理。在分子层面,通过SDS-PAGE确定豆乳上清液中的蛋白质组成从而判断参与凝胶的蛋白组分;在体系层面,利用震荡频率扫描的流变学方法探究凝胶形态变化,明确乳蛋白在凝胶中的作用;在颗粒层面,通过粒径测定分析凝胶聚合程度。研究结果表明,WPI(≥20%)、40% NaCas部分替代大豆蛋白制备双蛋白凝胶,可以显著增强蛋白凝胶强度,其中,WPI(≥20%)对豆乳凝胶的作用最为显著,主要归因于乳清蛋白,尤其是-Lg与大豆蛋白间的相互作用。同时,低比例的乳蛋白的添加可以有效降低凝胶的颗粒粒径,而高比例的WPI会大幅度增大体系的凝胶颗粒,这为改善豆乳酸奶粗糙口感的研究提供一定的参考。在微观结构方面,MPC的添加使得凝胶的结构更为致密规则,NaCas的添加形成了细丝网状结构,而WPI的添加使得凝胶结构趋于不规则、致密。SDS-PAGE及光密度扫描结果显示,添加WPI(≤20%)可能会促进大豆7S-参与凝胶,而NaCas则会阻碍大豆11S-BS的凝胶化。本实验在机理上初步浅析乳蛋白对豆乳凝胶化的影响,对于乳蛋白与大豆蛋白之间如何相互作用的深入探讨是今后的研究重点。
