酪蛋白胶束结构和理化性质的研究进展
2014-03-22,,,,,*
,,,,,*
(1.渤海大学食品科学研究院,辽宁省食品安全重点实验室,辽宁锦州 121013;2.中国农业大学,食品科学与营养工程学院,北京 100083)
酪蛋白是乳中含量最多的一大类蛋白的总称,约占牛乳中总蛋白含量的80%。根据对游离态钙离子的敏感程度,酪蛋白分为四类:αs1-、αs2-、β-和κ-酪蛋白。酪蛋白在牛乳中不是单独存在的,而是与磷酸钙相互结合形成直径约为200nm的近似球状的复合物,即“酪蛋白胶束”[1]。牛乳中的酪蛋白胶束具有很高的稳定性。自从二十世纪六十年代以来,很多学者对酪蛋白胶束的结构进行了深入而细致的研究,但是对其结构的阐述仍停留在理论模型的假说方面,尚无一致的结论[2]。
早在十九世纪人们就已经发现了酪蛋白胶束的存在[3]。但是直到二十世纪六十年代时,酪蛋白胶束的结构才逐渐成为乳品工作中研究的热点。到目前为止,尽管食品生产者可以根据一些经验操作生产出一些与酪蛋白胶束相关的食品(如奶酪、酸奶、奶粉和干酪素)[4],但是由于人们对酪蛋白胶束的内部结构尚不明确,因此限制了酪蛋白胶束的一些更为广泛地应用,如一些营养物质载体的制备或者具有特定功能性质产品的生产[5]。本文就酪蛋白胶束结构和部分重要的理化性质研究进展进行综述,以期对乳蛋白资源的开发和利用提供一些思路。
1 酪蛋白胶束中蛋白的组成
αs1-酪蛋白在荷斯坦牛乳中占总酪蛋白含量的40%左右,共由199个氨基酸组成,其分子质量约为2.3万道尔顿。由于αs1-酪蛋白中含有8个磷酸丝氨酸残基,因此其每个分子结构中含有8个磷酸化的矿质元素结合位点(主要是无机磷、钙和镁)[6]。其结构的疏水性见图1。从图1可以看出,αs1-酪蛋白中的疏水区域和亲水区域在其结构的划分并不明显,两者基本呈交替出现的状态[7]。
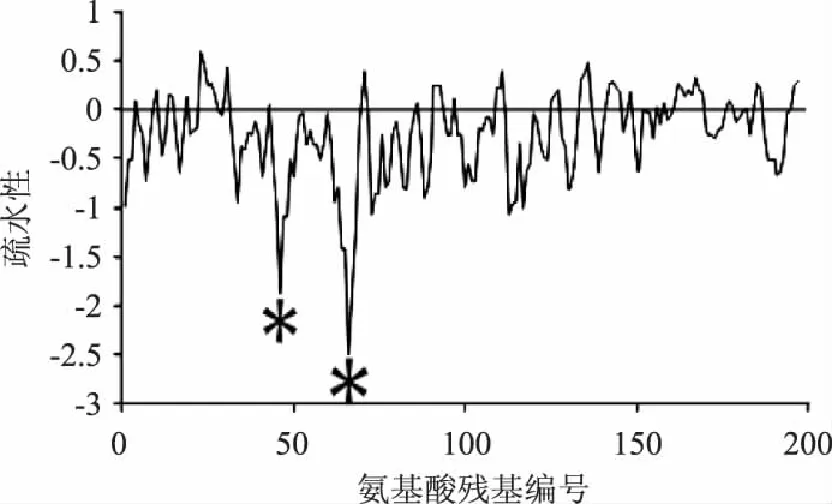
图1 αs1-酪蛋白的疏水性示意图[12] Fig.1 The hydrophobicity of αs1-casein
αs2-酪蛋白的含量约占荷斯坦牛乳酪蛋白总含量的10%,其分子质量也约为2.3道尔顿,共由207个氨基酸组成[8]。αs2-酪蛋白中共含有10个磷酸丝氨酸残基。其结构的疏水性见图2,其结构中含有2个疏水性比较强的区域,分布于C端的160~207位和90~120位[6]。
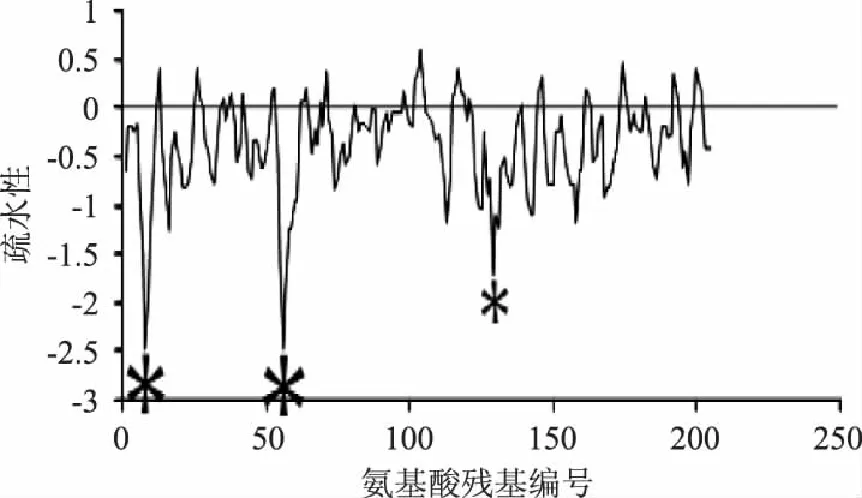
图2 αs2-酪蛋白的疏水性示意图[12] Fig.2 The hydrophobicity of αs2-casein
β-酪蛋白在荷斯坦牛乳中占总酪蛋白含量的40%左右,共由209个氨基酸组成,其分子质量约为2.4万道尔顿[9]。由于β-酪蛋白中含有5个磷酸丝氨酸残基,因此其每个分子结构中含有5个磷酸化的矿质元素结合位点(主要是无机磷、钙和镁)。其结构的疏水性见图3,β-酪蛋白中的疏水区域约占其总链长度的3/4,是所有酪蛋白中疏水性最强的[10]。
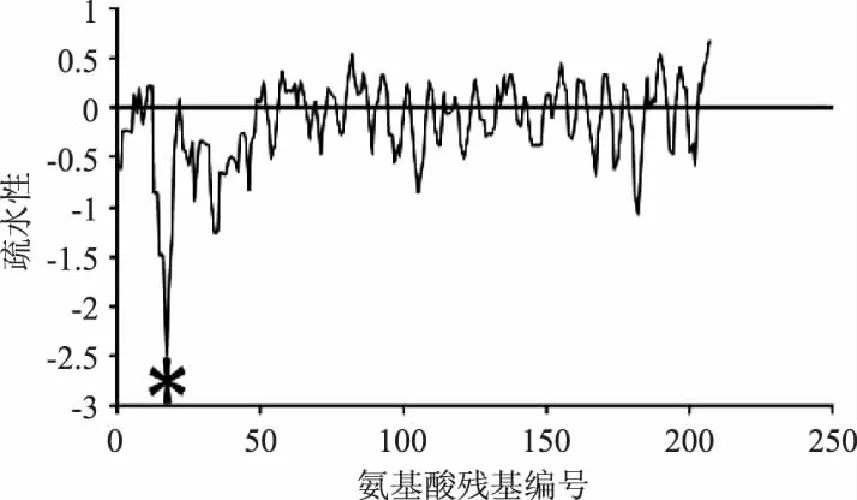
图3 β-酪蛋白的疏水性示意图[12] Fig.3 The hydrophobicity of β-casein
κ-酪蛋白约占荷斯坦牛乳中总酪蛋白含量的10%,含有169个氨基酸残基,其分子质量约为1.9万道尔顿[11]。与其它酪蛋白最大的不同是,κ-酪蛋白中不含磷酸丝氨酸残基,所以也就不能结合钙、无机磷和镁等矿质元素。同时κ-酪蛋白的糖基化程度很高。此外,凝乳酶可以切断κ-酪蛋白中105位和106位的氨基酸之间的肽键,使κ-酪蛋白的负电荷消失,从而导致酶凝乳凝胶的形成[10]。
2 酪蛋白胶束中矿质元素的组成
酪蛋白胶束中主要的矿质元素占胶束中干重的百分比见表1。尽管胶束中含有镁、锌、钠、钾和柠檬酸等盐类物质,但是磷酸钙的含量约占总胶束中盐含量的90%。磷酸钙在胶束中的存在形式有很多种,钙和无机磷在溶解相和胶束中动态平衡见图4。胶束中钙和无机磷的含量分别约占牛乳中总钙和总磷含量的72%和48%[13]。根据胶束中钙和磷的摩尔比,人们可以推断出磷酸钙在胶束中的存在形式。但是不同的学者所得到的钙和磷的摩尔比是不同的。有的学者通过研究认为,胶束中的钙和无机磷的摩尔比约等于1.5,因此就认为胶束中的磷酸钙是Ca3(PO4)2。但是这一结论存在着明显的不足之处。由前述可知,胶束中的酪蛋白中含有很多磷酸化的位点,这些磷酸化位点中的磷不可能是以无机磷状态存在的,因此这一结论中并没有将胶束中磷酸化的有机磷部分除去,因此这一结论存在着很大的争议。但是目前尚无一种新技术,能够对酪蛋白胶束中磷酸钙的确切组成进行检测。
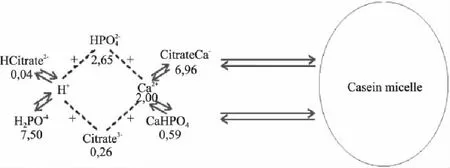
图4 钙和磷在胶束相和溶解相中的存在形式 Fig.4 The existential form of calcium an phosphate in micelle and serum phase
3 酪蛋白胶束的基本理化性质
水分子、酪蛋白和矿质元素共同组成了牛乳中的酪蛋白胶束。除去水分子后的酪蛋白胶束含有约93%的酪蛋白和7%的矿质元素。酪蛋白胶束的具体组成成分和基本的理化性质分别见表1和表2。尽管将牛乳中这种酪蛋白与矿质元素的复合体称为“胶束”,但是酪蛋白胶束与传统意义上的胶束还是存在着很大的区别[14]。酪蛋白胶束是由约2万个酪蛋白分子结合在一起的,但是它们的结构并不像传统意义上的胶束一样具有亲水的头部和疏水的尾部。矿质元素、αs-和β-酪蛋白组成了酪蛋白胶束的内部结构,而κ-酪蛋白覆盖在酪蛋白胶束的表面,对维持胶束的稳定性起到了重要的作用。值得我们注意的是,酪蛋白胶束的内部包含着大量的水(平均每克蛋白要结合3~4g水),这是酪蛋白胶束内部结构的一个很重要的特点。

表1 荷斯坦牛乳酪蛋白胶束的组成[15]Table 1 The composition of casein micelles in cow milk

表2 牛乳酪蛋白胶束的理化性质[16]Table 2 The physicochemical poperties of cow casein micelles
酪蛋白在乳中浓度约为25g/kg[17]。在牛乳中四种酪蛋白(αs1-、αs2-、β-和κ-酪蛋白)的比例约为4∶1∶3.5∶1.5。在有些物种的酪蛋白胶束中,可能没有其中的一种及以上酪蛋白,或者说各个酪蛋白的相对或者绝对比例是不同的[1],或者对于同一种酪蛋白而言,其氨基酸的序列存在差异。比如,人乳中酪蛋白的含量约为4g/kg,占人乳中总蛋白含量的30%~50%。人乳中的这些酪蛋白以β-酪蛋白为主,αs-酪蛋白的含量几乎没有。
在牛乳中αs-和β-酪蛋白具有多个磷酸化基团,它们的氨基酸序列中都含有SerP-SerP-SerP-X-SerP序列。这一氨基酸序列使酪蛋白能够结合大量的钙离子,从而使酪蛋白发生沉淀[4]。这些磷酸化的色氨酸残基也能够使得磷酸钙与酪蛋白结合。κ-酪蛋白只有一个磷酸丝氨酸残基,因此即使在很高的钙离子浓度的条件下,仍然不能发生沉淀。所有的酪蛋白都含有一定数量的疏水性氨基酸,κ-和β-酪蛋白含有大量的疏水区域。所有的酪蛋白都没有太多规则的二级结构,同时也没有固定不变的三级结构。因此它们的结构被称为流变性的或者无定形态的结构。这就意味着酪蛋白的结构很容易随着外界环境的变化而变化。
4 酪蛋白胶束理论结构模型的研究进展
到目前为止,由于检测手段的限制,人们还不能全面地阐述酪蛋白胶束的结构[18]。目前为止,人们针对胶束的理化性质在不同条件下的行为得出一致结论是,酪蛋白胶束是一种类似于覆盆子的结构,而不是一种单纯的球体结构,其扫描电镜图见图5[19]。κ-酪蛋白位于酪蛋白胶束的表面,决定了酪蛋白胶束的很多性质,尤其是胶束的稳定性。κ-酪蛋白中的106至169位片段所组成的聚电解质(简称酪蛋白糖巨肽)伸向溶液中,通过静电斥力和空间位阻效应保持胶束之间的稳定性[4]。酪蛋白糖巨肽是高度亲水性的多肽段,不仅包含一个磷酸化基团,而且含有多个糖基化的基团。糖巨肽中的亲水性氨基酸能够与水分子紧密结合。所以酪蛋白胶束表面就通过κ-酪蛋白与水分子结合形成5~10nm的毛发层结构。这种毛发层结构使酪蛋白胶束之间维持很好的空间位阻效应。
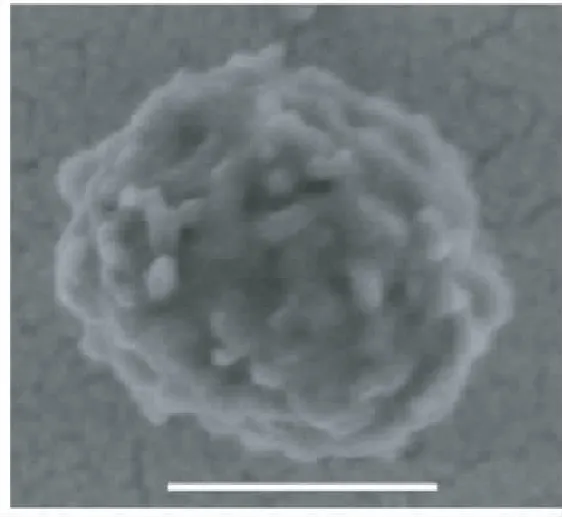
图5 酪蛋白胶束的冷场发射电镜的扫描图 Fig.5 Picture obtained from field emission scanning eletron microscope
由于目前的研究手段和技术是无法直接检测和观察酪蛋白胶束的内部结构的,所以酪蛋白胶束的结构一直处于理论假设和模型的建立阶段。这些模型中比较著名的理论结构模型有套核结构模型、内部结构模型、亚单元结构模型和Holt结构模型。
套核结构模型:酪蛋白胶束的内部是as-酪蛋白和β-酪蛋白通过疏水作用力结合而成,κ-酪蛋白位于酪蛋白胶束的表面,组成了胶束的“外套”,这样酪蛋白胶束就呈现一种放射状的玫瑰花似的聚合体[20]。
亚单元模型:不同的酪蛋白单体之间相互聚合形成了一个个小单元,这些小单元相互结合形成酪蛋白胶束[21-22]。见图6所示,首先,单体酪蛋白分子通过分子间的疏水作用相结合成一个个亚单元。这些亚单元总共含约20个单体酪蛋白分子。它们又可以分为两大类:富含β-和as-酪蛋白组成的亚单元和κ-酪蛋白组成的亚单元。κ-酪蛋白组成的亚单元占总亚单元的比例较少,覆盖在酪蛋白胶束的表面,而含β-和as-酪蛋白组成的亚单元存在于胶束的内部。胶体磷酸钙将各个亚单元连接起来[21]。但是到目前为止,尚没有任何实验能够证明酪蛋白胶束中富含β-和as-酪蛋白组成的亚单元和κ-酪蛋白组成的亚单元的存在。

图6 亚单元结构模型的示意图[25] Fig.6 The sub-micelle model of casein micelles
双结合模型:图7所示,αs-和β-酪蛋白通过两种作用力相互连接—分子内部的疏水作用力和胶体磷酸钙的连接作用[23]。这些相互结合后的酪蛋白位于胶束的内部,κ-酪蛋白几乎不含磷酸丝氨酸,因此它不能通过磷酸钙的连接作用与其它酪蛋白相互结合,所以位于胶束的表面,同时起到限制胶束无限增长的作用[24]。
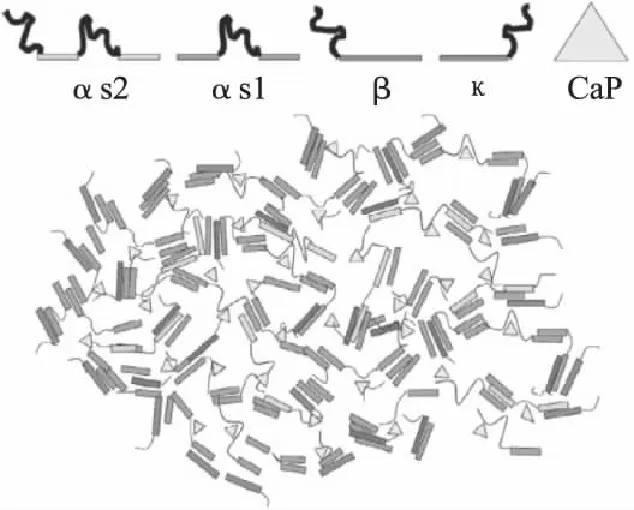
图7 酪蛋白胶束的双结合模型示意图[23] Fig.7 The dual-binding model of casein micelles
Holt结构模型认为,酪蛋白胶束内部是胶体磷酸钙将单体酪蛋白分子连接起来而组合成的纳米簇状复合物,κ-酪蛋白像“毛刷”一样位于酪蛋白胶束的表面。Holt模型是综合了上述的各个模型的合理之处后,通过小角X射线衍射以及各种验证性的实验结果所得出的目前关于酪蛋白胶束最为合理的结构模型[24],见图8。
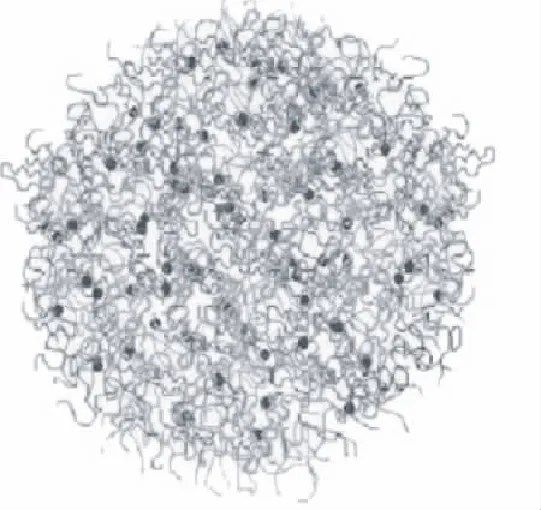
图8 Holt理论结构模型[26-27] Fig.8 The Holt model of casein micelles
酪蛋白胶束的结构是非常复杂的,它们是由高度磷酸化的αs和β-酪蛋白与磷酸钙相互缠绕在一起而形成的,κ-酪蛋白覆盖在酪蛋白胶束的表面,阻止了胶束的生长。目前已经有大量的研究证实,酪蛋白胶束的粒径决定于酪蛋白胶束表面的κ-酪蛋白占总酪蛋白的相对百分比。酪蛋白也存在很多变体,研究发现,与A变体的κ-酪蛋白相比,B变体的κ-酪蛋白的相对百分比更高,胶束的尺寸更小。通过梯度离心后得到不同粒径的酪蛋白胶束,然后分析其组成后发现,酪蛋白胶束的平均直径与酪蛋白胶束中所含的κ-酪蛋白的相对百分比成反比,与β-酪蛋白的相对百分比成正比。这一现象能够很好地证明,β-酪蛋白位于酪蛋白胶束的表面,而κ-酪蛋白位于胶束的内部。
5 结语
酪蛋白胶束位于乳品工业的核心地位,乳的酸凝、酶凝以及液态乳稳定性的变化,从本质上来说,都是乳中酪蛋白胶束所发生的一系列变化所导致的。但是由于人们对酪蛋白胶束的内部结构尚不明确,因此,乳品工业中与酪蛋白胶束相关的单元操作大都依赖于传统的经验操作。因此,有必要对酪蛋白胶束的结构进行更为深入的研究。同时,不同资源乳(如水牛乳、羊乳和牦牛乳)中的酪蛋白胶束的结构和组成存在较大的差异,因此有必要对这些特种乳资源的酪蛋白胶束进行研究,以此来探讨不同乳源的胶束的形成机制。总之,酪蛋白胶束内部结构的准确揭示需要新的研究手段的出现和广大乳品科技工作者的不断努力。
[1]Wang P,Liu H,Wen P,etal. The composition,size and hydration of yak casein micelles[J]. International Dairy Journal,2013,31(2):107-110.
[2]Rabo F,El-Dieb S,El-Asser M,etal. Effect of some physical treatments and additives on some functional properties of buffaloes’ and cows’ casein micelles[J]. Egyptian Journal of Dairy Science,2010,38(1):35-44.
[3]Waugh DF,Von Hippel PH. κ-Casein and the stabilization of casein micelles[J]. Journal of the American Chemical Society,1956,78(18):4576-4582.
[4]Dalgleish DG. On the structural models of bovine casein micelles-review and possible improvements[J]. Soft Matter,2011,7(6):2265-2272.
[5]Bachar M,Mandelbaum A,Portnaya I,etal. Development and characterization of a novel drug nanocarrier for oral delivery,based on self-assembled β-casein micelles[J]. Journal of Controlled Release,2012,160(2):164-171.
[6]McMahon DJ,Oommen BS. Supramolecular Structure of the Casein Micelle[J]. Journal of Dairy Science,2008,91(5):1709-1721.
[7]Fox P,Brodkorb A. The casein micelle:historical aspects,current concepts and significance[J]. International Dairy Journal,2008,18(7):677-684.
[8]Osta R,Marcos S,Rodellar C. A MnlI polymorphism at the bovine αs2‐casein gene[J]. Animal genetics,1995,26(3):213-213.
[9]Givens I,Aikman P,Gibson T,etal. Proportions of A1,A2,B and C β-casein protein variants in retail milk in the UK[J]. Food Chemistry,2013,139(1-4):549-552.
[10]O’Mahony J,Fox P. Milk Proteins:Introduction and Historical Aspects[M]. Advanced Dairy Chemistry:Springer;2013. p. 43-85.
[11]Nagy K,Váró G,Szalontai B. κ-Casein terminates casein micelle build-up by its “soft” secondary structure[J]. European Biophysics Journal,2012,41(11):959-968.
[12]Horne DS. Casein micelle structure and stability[M]. In:Abby T,Mike B,Harjinder S,editors. Milk Proteins. San Diego:Academic Press,2008:133-162.
[13]Ahmad S,Gaucher I,Rousseau F,etal. Effects of acidification on physico-chemical characteristics of buffalo milk:A comparison with cow’s milk[J]. Food Chemistry,2008,106(1):11-17.
[14]Glantz M,Hakansson A,Lindmark Mansson H,etal. Revealing the size,conformation,and shape of casein micelles and aggregates with asymmetrical flow field-flow fractionation and multiangle light scattering[J]. Langmuir,2010,26(15):12585-12591.
[15]McMahon DJ,Brown RJ. Composition,Structure,and Integrity of Casein Micelles:A Review[J]. Journal of Dairy Science,1984,67(3):499-512.
[16]Fox PF,Brodkorb A. The casein micelle:Historical aspects,current concepts and significance[J]. International Dairy Journal,2008,18(7):677-684.
[17]Nair PK,Alexander M,Dalgleish D,etal. Physico-chemical properties of casein micelles in unheated skim milk concentrated by osmotic stressing:interactions and changes in the composition of the serum phase[J]. Food Hydrocolloids,2013,In the press,doi:http://dx.doi.org/10.1016/j.foodhyd.2013.01.001.
[18]Dalgleish DG,Corredig M. The structure of the casein micelle of milk and its changes during processing[J]. Annual Review of Food Science and Technology,2012,3:449-467.
[19]Dalgleish DG,Spagnuolo PA,Douglas Goff H. A possible structure of the casein micelle based on high-resolution field-emission scanning electron microscopy[J]. International Dairy Journal,2004,14(12):1025-1031.
[20]Horne DS. Casein micelles as hard spheres:limitations of the model in acidified gel formation[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2003,213(2-3):255-263.
[21]McMahon D,Oommen B. Casein Micelle Structure,Functions,and Interactions[M]. Germany:Springer,2013:185-209.
[22]Ma J,Xu Q,Zhou J,etal. Nano-scale core-shell structural casein based coating latex:Synthesis,characterization and its biodegradability[J]. Progress in Organic Coatings 2013,In the press,doi:http://dx.doi.org/10.1016/j.porgcoat.2013.04.006.
[23]Qi P,X. Studies of casein micelle structure:the past and the present[J]. Lait,2007,87(4-5):363-383.
[24]De Kruif CG,Huppertz T,Urban VS,etal. Casein micelles and their internal structure[J]. Advances in Colloid and Interface Science,2012,171-172(0):36-52.
[25]Horne DS. Casein micelle structure:Models and muddles[J].Current Opinion in Colloid & Interface Science,2006,11(2-3):148-153.
[26]Phadungath C. Casein micelle structure:a concise review[J].Songklanakarin J Sci Technol,2005,27(1).
[27]Holt C,Horne D. The hairy casein micelle:evolution of the concept and its implications for dairy technology[J]. Nederlands melk en Zuiveltijdschrift,1996,50(2):85-111.
