白喉乌头对胶原诱导关节炎大鼠模型作用机制研究
2022-07-02张晨曦王灵锐文清慧
张晨曦,葛 畅,丛 珊,王灵锐,文清慧,罗 剑,罗 莉
(新疆医科大学 1第一附属医院风湿免疫科,2第一临床医学院,乌鲁木齐 830054)
类风湿关节炎(Rheumatoid arthritis,RA)是一种慢性自身免疫性疾病,其病理基础为侵蚀性滑膜炎症、骨和关节软骨进行性破坏,最终导致关节畸形功能障碍[1]。RA 全球发病率约为0.5%~1%,我国RA患者约有500 万人,其中女性患病率较高[2-3]。树突状细胞(Dendritic cells,DCs)、T 细胞介导的自身免疫活化异常在RA 的发生与发展中起着重要作用。DCs是体内抗原呈递能力最强的抗原提呈细胞(Antigen presenting cell,APC),具有诱导初始型T 淋巴细胞分化,激活免疫应答和诱导免疫耐受能力[4]。RA 患者滑膜组织中成熟的DCs呈高表达,可通过高表达的共刺激分子和MHC-II 分子诱导CD4+T 细胞活化介导炎症反应[5]。因此抑制DCs 成熟,诱导免疫耐受可缓解RA 病情。 白喉乌头(Aconitum leucostomum Worosch.)是毛莨科乌头属的多年生草本植物产于新疆北部地区,常以根部入药,具有祛风除湿、温经止痛的功效[6]。单体1(Delvestidine)和单体4(氨茴酰牛扁碱)是白喉乌头发挥抗RA 作用的主要活性成分[7]。研究表明,白喉乌头能够减轻胶原诱导关节炎(Colla⁃gen induced arthritis,CIA)大鼠关节肿胀度,减少炎性细胞浸润,缓解CIA大鼠关节症状[8],但其作用机制尚不明确。本研究通过建立CIA大鼠模型,分析检测白喉乌头对CD11c+DCs 表面MHC-II 分子表达的影响,进一步探究白喉乌头治疗RA的作用机制。
1 材料与方法
1.1 实验动物60 只SPF 级雄性SD 大鼠,6~8 周龄,体重(200±20)g,购自新疆医科大学动物实验中心[动物许可证号:SYXK(新)2016-0001]。所有大鼠在23℃~25℃,55%~60%湿度环境中,保持正常昼夜节律,自由进食和饮水,适应性喂养1 周后进行后续实验。
1.2 试剂与仪器白喉乌头总生物碱(辰光生物科技公司,HA001011)、单体1:Delvestidine(辰光生物科技公司,HB001005)、单体4:氨茴酰牛扁碱(辰光生物科技公司,HA001017),雷公藤多苷片(远大医药黄石飞云制药公司,Z42021212),牛II型胶原(美国Chondrex公司,20022),完全弗氏佐剂(美国Sigma 公司,F5881),重组Anti-CD11c 抗体(美国abcam 公司,ab52632),Anti-MHC ClassII 抗体(美国abcam 公司,ab55152),ELISA 试剂盒(联科生物技术有限公司),酶标仪(美国Thermo 公司,VL0LA0D2),光学显微镜(日本OLYMPUS 公司,CX43),数显游标卡尺(日本Mitutoyo公司,500-180-30)。
1.3 方法
1.3.1 制备CIA 大鼠模型将2 mg/mL 的牛II 型胶原溶于0.05 mol/L 的冰乙酸中,得到终浓度为4 mg/mL的牛II 型胶原乙酸溶液,4℃过夜,充分溶解,加入等体积完全弗氏佐剂充分乳化[9]。于大鼠左足跖部、尾根部及皮背部皮下注射牛II 型胶原乳剂(0.3mL/只)进行初次免疫,1 周后,将上述胶原乳剂同部位进行加强免疫。
1.3.2 分组及干预措施将所有大鼠按随机数字表法分为正常组、模型组、阳性药组(雷公藤多苷组)、总生物碱组、单体1 组、单体4 组,每组各10 只,除正常组外,其余组大鼠建立CIA 大鼠模型,初次免疫3 周后(即加强免疫2周后),参照文献[10]进行灌胃,总生物碱组给予45 mg·kg-1·d-1的总生物碱灌胃,单体1组给予98 mg·kg-1·d-1的单体1 灌胃,单体4 组给予98 mg·kg-1·d-1的单体4灌胃,阳性药组给予1 mg·kg-1·d-1的雷公藤多苷片灌胃,正常组给予2 mL/d 的生理盐水灌胃,模型组给予2 mL/d 的生理盐水灌胃。药物干预剂量依据查阅白喉乌头毒理学资料及相关文献,通过半数致死量计算出适宜给药浓度[8,11],且经预实验证实。
1.3.3 各组大鼠关节肿胀度、关节炎指数评分游标卡尺分别测量造模前后第3、4、5、6、7 周大鼠左后足踝关节直径,由2 名工作年限5 年以上,具有副研究员以上职称的专业动物实验人员同时测量,取两者平均值。关节肿胀度(%)=(给药后每周关节直径-造模前关节直径)/造模前关节直径×100%;关节炎指数评分(Arthritis index,AI)是评定CIA 大鼠模型造模成功与否的标准,AI评分标准[12]:无关节红肿为0 分,小趾关节轻度肿胀为1 分,趾骨关节及足趾红肿为2分,踝关节以下均红肿为3 分,包含踝关节在内的全部足趾肿胀为4 分。AI 评分≥6 分提示CIA 大鼠造模成功,分值越高代表致炎效果越充分,关节炎模型建立越成功。
1.3.4 组织病理学检测给药4周后处死所有大鼠,取各组大鼠踝关节,置于4%多聚甲醛溶液,固定24 h,置于10%EDTA 脱钙液中脱钙4 周,待针刺关节无阻力或阻力很小时,即完成脱钙。标本脱水浸蜡、包埋、切片,苏木素-伊红(Hematoxylin-eosin,HE)染色,置于显微镜下观察踝关节滑膜病理形态(×100)。
1.3.5 ELISA 法检测血清炎症因子水平腹主动脉采集血液,室温静置20 min,待血液自然凝固,离心取上清液,根据ELISA 试剂盒说明书进行操作,分别检测各组大鼠血清炎症因子白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-4(Interleukin-4,IL-4)、白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-10(Interleukin-10,IL-10)、肿瘤坏死因子-α(Tumor ne⁃crosis factor-α,TNF-α)的光密度(OD)值。
1.3.6 免疫荧光双重染色检测踝关节滑膜组织中DCs踝关节滑膜石蜡切片,烤片、脱蜡、抗原修复,加入0.3%牛血清蛋白,室温孵育,封闭30 min。于切片关节滑膜部位依次加入一抗,4℃孵育过夜,加入二抗,避光,37℃恒温箱内孵育30 min,加入4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)荧光染液,孵育5 min,封片,置于荧光显微镜下观察(×200)。
1.4 统计学处理采用SPSS22.0 统计软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠关节肿胀度、关节炎指数评分比较初次免疫第3 周,各组大鼠关节炎指数AI 评分≥6 分,CIA模型造模成功。灌胃4周后,与正常组大鼠比较,模型组大鼠关节肿胀度显著升高,AI 评分显著升高,差异具有统计学意义(P<0.01);与模型组比较,阳性药组、总生物碱组、单体1 组、单体4 组大鼠初次免疫后第6 周、第7 周关节肿胀度显著改善,AI 评分显著下降,差异具有统计学意义(P<0.01)(图1)。

图1 各组大鼠关节肿胀度、关节炎指数评分比较
2.2 各组大鼠踝关节组织病理学结果HE 染色结果显示,正常组大鼠滑膜细胞排列规则,表面光滑,关节滑膜边界清晰,无炎性细胞浸润,无血管增生;模型组大鼠滑膜细胞排列紊乱,层数明显增多,细胞间纤维结缔组织增生、水肿和有大量炎性细胞(单核细胞、多核细胞、淋巴细胞等)浸润,滑膜毛细血管增生,扩张的腔内充满红细胞;阳性药组、总生物碱组、单体1 组及单体4 组大鼠滑膜组织结构排列较模型组整齐,可见不同程度炎症细胞浸润,且均较模型组减少,可见少量毛细血管增生充血(图2)。

图2 各组大鼠踝关节组织病理学结果(×100)
2.3 各组大鼠血清中IL-1β、IL-4、IL-6、IL-10、TNF-α 表达水平比较与正常组比较,模型组大鼠血清中IL-1β、IL-6、TNF-α 水平均显著升高,IL-4、IL-10 水平均显著下降(P<0.05~0.01);与模型组比较,阳性药组、总生物碱组、单体1 组和单体4 组大鼠血清中IL-1β、IL-6、TNF-α 水平均显著下降,IL-4、IL-10水平均显著升高(P<0.05~0.01)(图3)。
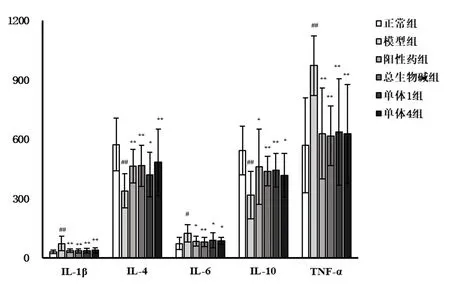
图3 各组大鼠血清中IL-1β、IL-4、IL-6、IL-10、TNF-α表达水平比较
2.4 CD11c+DCs 表面MHC-II 分子在CIA 大鼠踝关节滑膜组织中的表达情况免疫荧光双重染色结果显示,与正常组比较,模型组大鼠中CD11c+DCs 表面MHC-II 分子表达量明显升高(P<0.01);与模型组比较,阳性药组、总生物碱组、单体4 组大鼠中CD11c+DCs 表面MHC-II 分子表达量降低(P<0.05~0.01)。其中,总生物碱组、单体4 组大鼠CD11c+DCs表面MHC-II 分子表达量与阳性药组大鼠差异性较小,单体1 组大鼠CD11c+DCs 表面MHC-II 分子表达量较模型组大鼠降低,但差异无统计学意义(图4、表1)。
表1 各组大鼠CD11c+DCs表面MHC-II分子表达情况(±s,个/HPF)

表1 各组大鼠CD11c+DCs表面MHC-II分子表达情况(±s,个/HPF)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别正常组模型组阳性药组总生物碱组单体1组单体4组共定位双阳性细胞计数26.78±10.06 55.22±13.35##34.00±6.73**33.11±13.20**45.33±4.69 42.11±7.42*

图4 CD11c+DCs表面MHC-II分子在CIA大鼠关节滑膜组织中的表达情况
3 讨论
RA 是一种复杂免疫途径介导的慢性炎症性疾病,在RA 中DCs 调节T 细胞活化功能发挥着重要作用[13]。DCs 是目前发现机体功能最强的抗原呈递细胞,其基本功能是识别、摄取、处理加工及提呈抗原,并直接激活初始型CD4+T 细胞刺激基础免疫应答,诱导辅助型T 细胞1(Th1)和辅助型T 细胞2(Th2)细胞分化。DCs 按照成熟活化状态可分为成熟DCs(mDCs)和未成熟DCs(imDCs),正常生理状态下大多DCs 处于未成熟状态,分布在外周组织和淋巴结中,具有强大的抗原摄取能力,维持外周免疫耐受。CD11c是DCs经典的标记分子,可表达于mDCs和im⁃DCs表面,本课题组前期研究表明,在RA患者关节液中CD11c+mDCs 聚集,关节液内成熟DCs 含量与RA患者疾病活动度、炎症反应呈正相关[14],这表明RA患者关节炎症诱发DCs 成熟并使其聚集于炎症部位。李梦圆等[5]研究同样表明,RA 患者滑膜液中CD11c+mDCs 含量显著升高,分泌大量炎症因子诱发炎症反应。此外,免疫炎症状态下,抗原刺激imDCs迁移至炎症部位获得成熟表型,使mDCs 表面MHC-Ⅱ分子(DCs 成熟标记物)大量表达[15],分泌促炎细胞因子TNF-α、IL-1β、IL-6 等,进一步促进DCs 成熟,增强其抗原递呈能力,激活机体免疫应答。同时,受IL-10等抑制因子的影响,mDCs能够抑制T细胞功能并介导免疫耐受[16]。因此通过抑制DCs 活化与成熟,影响T 细胞相关炎性因子释放是缓解关节炎症的有效途径。
本研究证实模型组大鼠关节滑膜组织中CD11c+DCs 表面MHC-II 分子高表达,说明mDCs 在滑膜组织聚集诱发炎症反应。初次免疫第3 周开始灌胃给药4周后,总生物碱组、单体1组及单体4组大鼠关节滑膜组织中CD11c+DCs 表面MHC-II 分子表达量均下降,这与Wang 等[17]研究结果一致。提示白喉乌头能够降低CD11c+DCs 表面MHC-II 分子表达,即下调mDCs 含量。同时本研究发现模型组大鼠血清中促炎因子TNF-α、IL-1β、IL-6 水平明显升高,IL-4、IL-10 水平明显下降,初次免疫第3 周开始灌胃给药4 周后,阳性药组、总生物碱组、单体1 组及单体4组大鼠血清中促炎因子TNF-α、IL-1β、IL-6水平显著下降,IL-4、IL-10 水平显著升高。这提示灌胃给药后,滑膜组织中CD11c+DCs 表面MHC-II 分子表达量下降,即mDCs 表达量降低,致使炎症因子TNF-α、IL-1β、IL-6 释放减少,抑炎因子IL-4、IL-10 升高诱导免疫耐受。
综上所述,白喉乌头可能通过抑制CD11c+DCs表面MHC-II 分子表达,抑制DCs 分化与成熟,调节相关炎症因子的释放,改善CIA大鼠模型的关节症状及炎症,为白喉乌头缓解类风湿关节炎作用机制提供了实验依据。
