4-PBA通过抑制内质网应激减轻碘普罗胺诱导的HK-2细胞损伤
2022-06-28董姝君高昕乐陈燕玲何柳桦王静蕾夏雨果陈应琼
董姝君,高昕乐,罗 婷,陈燕玲,何柳桦,王静蕾,夏雨果,陈应琼
(1.遵义医科大学珠海校区 病理生理学教研室,广东 珠海 519041;2.遂宁市中心医院 病理科,四川 遂宁 629000)
对比剂肾病是导致医源性急性肾功能损伤的第三大主因,也是缺血性心脏病患者PCI术后死亡的主要原因[1-2]。对比剂肾病的发病机制复杂,目前认为其发病机制主要与对比剂引起近端肾小管空泡转化、间质水肿和肾小管变性,肾脏微血管结构改变,氧化应激及炎症反应等因素有关[3-4]。其中,肾小管上皮细胞损伤在对比剂肾病的发生发展中占据重要地位。课题组前期研究结果显示,对比剂可直接激活肾小管上皮细胞内炎症小体继而诱导细胞凋亡[5]。而炎症小体的激活以及细胞凋亡均与内质网应激有密切关系[6]。在缺血缺氧以及代谢障碍等刺激因素作用下,内质网功能出现紊乱,使大量错误折叠蛋白质堆积,此时内质网可通过未折叠蛋白反应及内质网相关降解途径(泛素-蛋白酶体)来减少错误折叠蛋白质在内质网腔内蓄积,这个过程称为内质网应激[7]。适度的内质网应激有助于内质网稳态的恢复,但当其反应过度时则会激活炎症小体,甚至引起细胞凋亡。由于内质网应激与炎症小体及细胞凋亡密切相关,而对比剂引起的细胞损伤又与炎症小体的激活以及细胞凋亡密切相关,我们推测内质网应激可能参与了对比剂诱导的肾小管上皮细胞损伤。因此,本研究拟探讨内质网应激抑制剂4-PBA对碘普罗胺诱导的HK-2细胞是否具有保护作用及其可能机制,为对比剂肾病的防治提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验对象 HK-2细胞株由中山大学病理生理学教研室王蔚东教授馈赠,购自美国菌种保藏中心(American type culture collection,ATCC)[8]。
1.1.2 实验材料及试剂 4-PBA为美国MedChem Express公司产品;碘普罗胺为拜耳医药保健有限公司产品;BCA蛋白浓度测定试剂盒购自美国Thermo Fisher Scientific公司;发光底物HRP为美国Milipore公司产品;胰蛋白酶-EDTA(0.25%)、DMEM/F12培养基及胎牛血清购自美国Gibco公司;荧光探针DCFH-DA、DAPI染色液为美国Sigma-Aldrich公司产品;CCK-8试剂盒为日本同仁化学研究所产品;GRP78、eIF2α、p-eIF2α、p-JNK、Bax、Bcl-2及内参GAPDH等Ⅰ抗及相应的Ⅱ抗均为美国Cell Signaling Technology公司产品。
1.1.3 实验仪器 Multiskan Mk3酶标仪(美国Thermo Fisher Scientific);Mini-PROTEAN Tetra电泳仪、转膜仪(美国Bio-Rad公司);CyFlow Cube流式细胞仪(德国PARTEC公司);双色近红外多功能成像仪(德国Analytik Jena公司)。
1.2 方法
1.2.1 细胞培养 用含10%FBS的DMEM/F12培养基,在37℃,5% CO2培养箱中培养HK-2细胞,当细胞铺满T25瓶底约90%时进行传代处理以及后续实验。
1.2.2 实验分组 实验分为5组:对照组、150 mgI/mL碘普罗胺组、碘普罗胺+不同浓度(1、2.5、5 mmol/L)4-PBA处理组。
1.2.3 CCK-8法检测HK-2细胞细胞活力 将HK-2细胞按5 000个/孔的密度接种到96孔板中,每组设置5个复孔。4-PBA处理组分别用1、2.5、5 mmol/L 浓度的4-PBA预处理细胞20 min后,根据实验分组加入碘普罗胺继续培养3 h。然后去除培养基,每孔加入100 μL无血清培养基配制的10% CCK-8溶液,避光作用1.5 h,用酶标仪测定450 nm波长处吸光度值(OD),细胞存活率(%)=(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。
1.2.4 DCFH-DA染色观察细胞内ROS生成 将细胞按合适密度接种到6孔板中。根据上述分组对细胞进行处理后,吸除培养液,用PBS洗3遍,然后每组加入1 mL无血清培养基配制的DCFH-DA染液(终浓度为1 μg/L),37℃避光染色15 min后,用PBS洗3遍,用荧光显微镜(200×)观察细胞绿色荧光强度并随机选取6个不同视野的细胞进行拍照。
1.2.5 流式细胞仪检测细胞内ROS水平 将细胞按合适密度接种到6 cm培养皿中,根据上述分组对细胞进行处理后,去除培养液,用不含EDTA的胰酶消化、离心并收集细胞,染色方法及处理同“1.2.3”。用流式细胞仪检测各组细胞平均荧光强度,FCS express 4.0软件进行数据分析处理。
1.2.6 Rh123染色法观察细胞线粒体膜电位 将细胞按合适密度接种到6孔板中,根据上述分组对细胞进行处理后,吸除培养液,然后每组加入1 mL无血清培养基配制的终浓度为1 μg/L的Rh123染液,37℃避光孵育15 min后,PBS洗3次,荧光显微镜(200×)观察细胞内黄绿色荧光并随机选取6个不同视野的细胞进行拍照。
1.2.7 DAPI染色法观察细胞核形态 将细胞接种到6孔板中,待细胞充分贴壁且铺满板底约90%时,去除培养基,根据上述分组对细胞进行处理后,吸出培养液,每组加入1 mL用甲醇配制的终浓度为1 μg/L的DAPI染色液,放入培养箱避光染色20 min后,PBS洗3次,荧光显微镜(400×)观察细胞内具有凋亡形态的细胞核并随机选取6个不同视野的细胞进行拍照。
1.2.8 Western blotting检测 将细胞接种到6 cm培养皿中,待细胞贴壁并生长至皿底约90%时加入不同药物处理。药物处理3 h后去除培养基,用预冷的PBS洗3次,每皿滴加120 μL RIPA裂解液,冰上裂解细胞15 min。刮取细胞并离心取上清液,BCA法进行蛋白浓度测定。根据蛋白分子量配制SDS电泳凝胶。电泳条件:恒压80 V,30 min;然后恒压120 V,60~80 min。电转条件:恒流220 mA,60~120 min。5%脱脂奶粉封闭1 h,分别加入Bax、Bcl-2、Cleaved-Caspase-3、CHOP、GRP78、p-JNK、JNK、p-eIF-2α、eIF-2α及p-IRE1α蛋白Ⅰ抗(1∶1 000),在4℃孵育过夜。用PBST洗3次,然后加入Ⅱ抗(1∶5 000)在室温下孵育60 min,PBST洗3次后,加入ECL发光液后用成像仪扫描成像,然后用Image J软件分析灰度值。

2 结果
2.1 4-PBA对碘普罗胺诱导的HK-2细胞存活率的影响 与对照组相比较,碘普罗胺组细胞存活率显著降低(P<0.01),而加入1、2.5、5 mmol/L的4-PBA处理后[9],细胞存活率明显增高(P<0.01,见表1)。
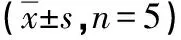
表1 4-PBA对碘普罗胺诱导的HK-2细胞存活率的影响
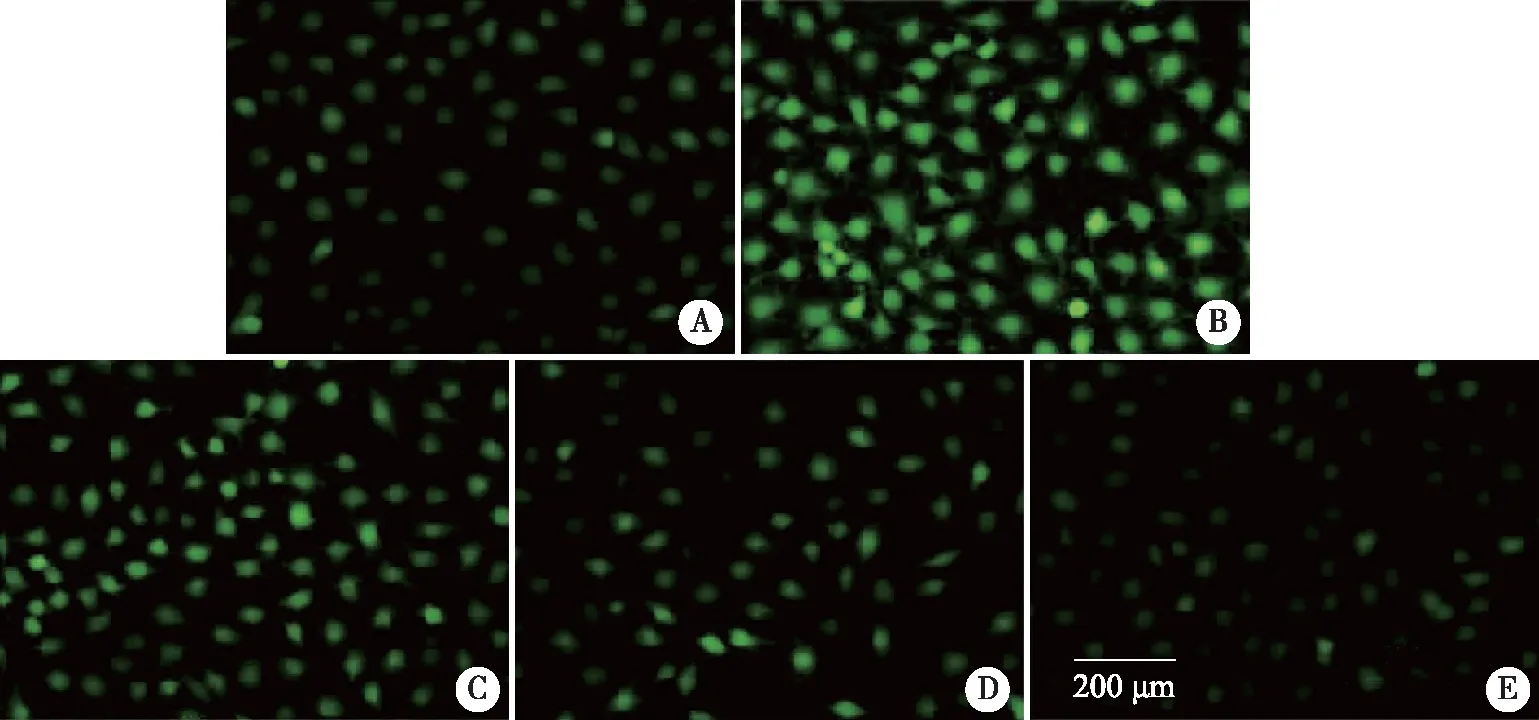
2.2 4-PBA碘普罗胺诱导的HK-2细胞内ROS生成的影响 DCFH-DA经过细胞内ROS的氧化可生成DCFH,在荧光显微镜下显示绿色荧光,其含量与细胞内ROS的数量呈正比。与对照组相比,碘普罗胺组细胞的荧光强度明显增强,而加入1、2.5、5 mmol/L浓度的4-PBA处理后细胞荧光强度均较碘普罗胺组减弱(见图1)。用流式细胞仪对细胞的荧光强度进行定量分析,结果与显微镜下观察的一致(见图2,表2)。
A:对照组;B:150 mgI/mL碘普罗胺组;C:150 mgI/mL碘普罗胺+1 mmol/L 4-PBA组;D:150 mgI/mL碘普罗胺+2.5 mmol/L 4-PBA组;E:150 mgI/mL碘普罗胺+5 mmol/L 4-PBA组;×200。
A:对照组;B:150 mgI/mL碘普罗胺组;C:150 mgI/mL碘普罗胺+1 mmol/L 4-PBA组;D:150 mgI/mL碘普罗胺+2.5 mmol/L 4-PBA组;E:150 mgI/mL碘普罗胺+5 mmol/L 4-PBA组。

表2 各组细胞平均荧光强度
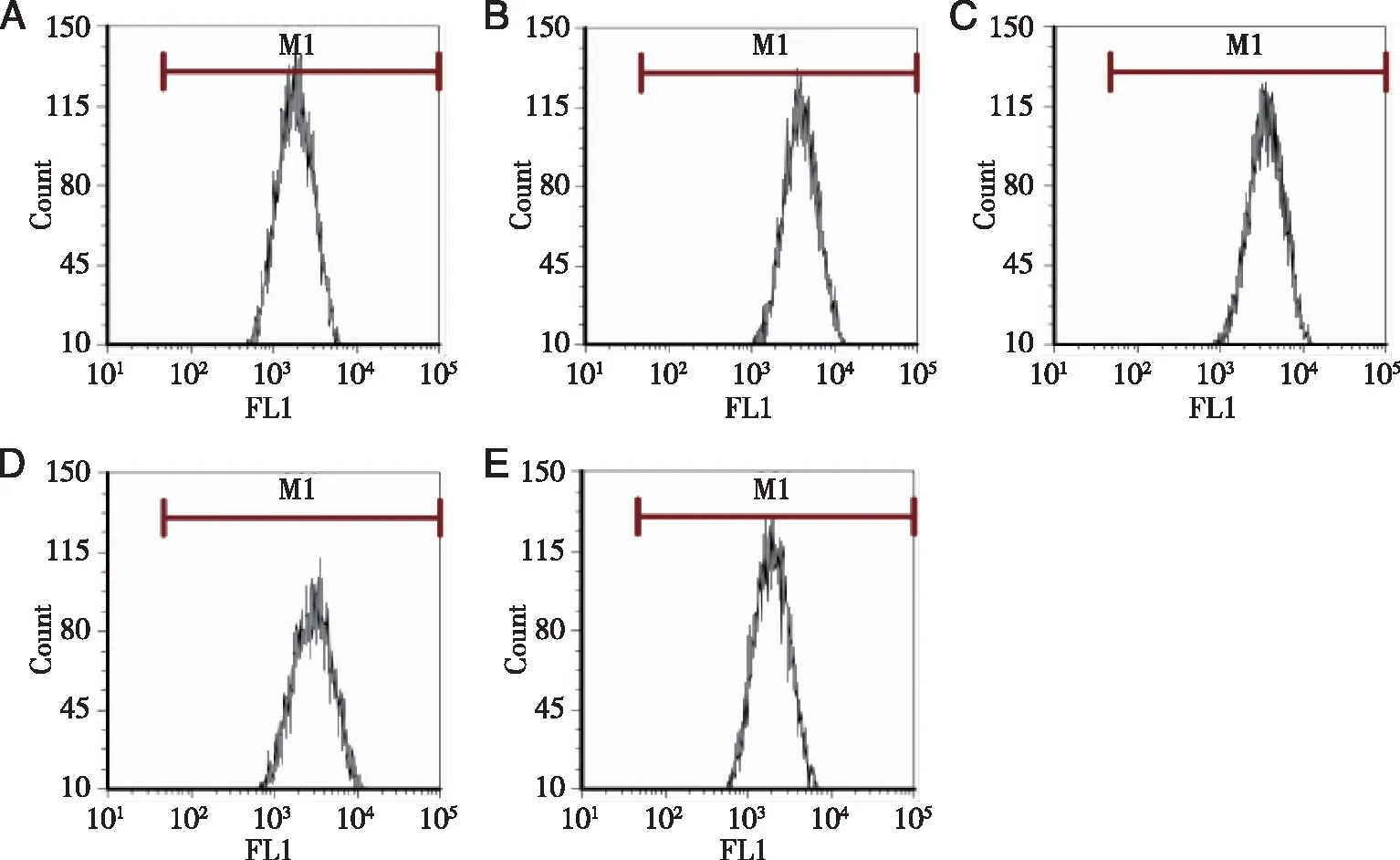
2.3 4-PBA对碘普罗胺诱导的HK-2细胞ΔΨm 的影响 Rh123可以穿透细胞膜并在活细胞线粒体内聚集,在显微镜下观察活细胞会发出黄绿色荧光,且强弱程度与ΔΨm呈正比。在荧光显微镜下观察,碘普罗胺组荧光强度较对照组减弱,而加入不同浓度的4-PBA处理后,细胞荧光强度均较碘普罗胺组增高(见图3)。
A:对照组;B:150 mgI/mL碘普罗胺组;C:150 mgI/mL碘普罗胺+1 mmol/L 4-PBA组;D:150 mgI/mL碘普罗胺+2.5 mmol/L 4-PBA组;E:150 mgI/mL碘普罗胺+5 mmol/L 4-PBA组;×200。
2.4 4-PBA对碘普罗胺诱导的HK-2细胞凋亡相关蛋白Cleaved-Caspase-3、Bax、Bcl-2蛋白表达水平的影响 与对照组HK-2细胞相比,碘普罗胺组Bax蛋白表达明显增高,而Bcl-2蛋白表达明显降低,Bax/Bcl-2比值以及Cleaved-Caspase-3表达较对照组上调。而加入不同浓度的4-PBA处理后,Cleaved-Caspase-3蛋白表达水平及Bax/Bcl-2比值均较碘普罗胺组降低(P<0.05,见图4,表3)。
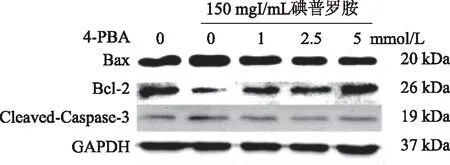
图4 4-PBA对碘普罗胺诱导的HK-2细胞Cleaved-Caspase-3、Bax、Bcl-2蛋白表达的影响

表3 各组细胞Bax/ Bcl-2比值以及Cleaved-Caspase-3蛋白表达水平
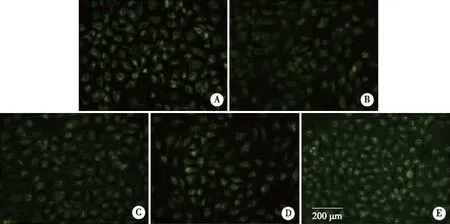
2.5 4-PBA对碘普罗胺诱导的HK-2细胞凋亡的影响 经DAPI染色观察各组细胞的细胞核形态变化,对照组细胞的细胞核基本呈现均匀的低密度蓝色荧光,而经碘普罗胺处理后,部分细胞核出现核固缩或核分裂等凋亡细胞的典型特征,在荧光显微镜下可观察到细胞核局部有致密浓染的蓝色荧光。加入1、2.5、5 mmol/L浓度的4-PBA处理后,出现凋亡特征的细胞数较碘普罗胺组减少(见图5)。
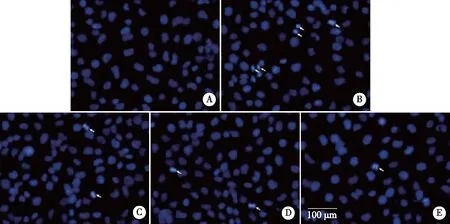
A:对照组;B:150 mgI/mL碘普罗胺组;C:150 mgI/mL碘普罗胺+1 mmol/L 4-PBA组;D:150 mgI/mL碘普罗胺+2.5 mmol/L 4-PBA组;E:150 mgI/mL碘普罗胺+5 mmol/L 4-PBA组;白色箭头所示为发生凋亡的细胞;×400。
2.6 4-PBA对碘普罗胺诱导的HK-2细胞内质网应激相关蛋白GRP78、CHOP、p-IRE1α、p-JNK、JNK及p-eIF-2α、eIF-2α表达水平的影响 Western blotting结果显示,与对照组相比,碘普罗胺组HK-2细胞GRP78、CHOP、p-IRE1α蛋白表达水平、p-JNK/JNK及p-eIF-2α/eIF-2α比值增高;而加入不同浓度的4-PBA处理组后GRP78、CHOP、p-IRE1α、p-JNK、JNK及p-eIF-2α/eIF-2α比值均较碘普罗胺组降低,差异具有统计学意义(P<0.05,见图6,表4)。
表4 各组细胞GRP78、CHOP、p-IRE1α蛋白表达水平及p-JNK/JNK、p-eIF-2α/eIF-2α比值
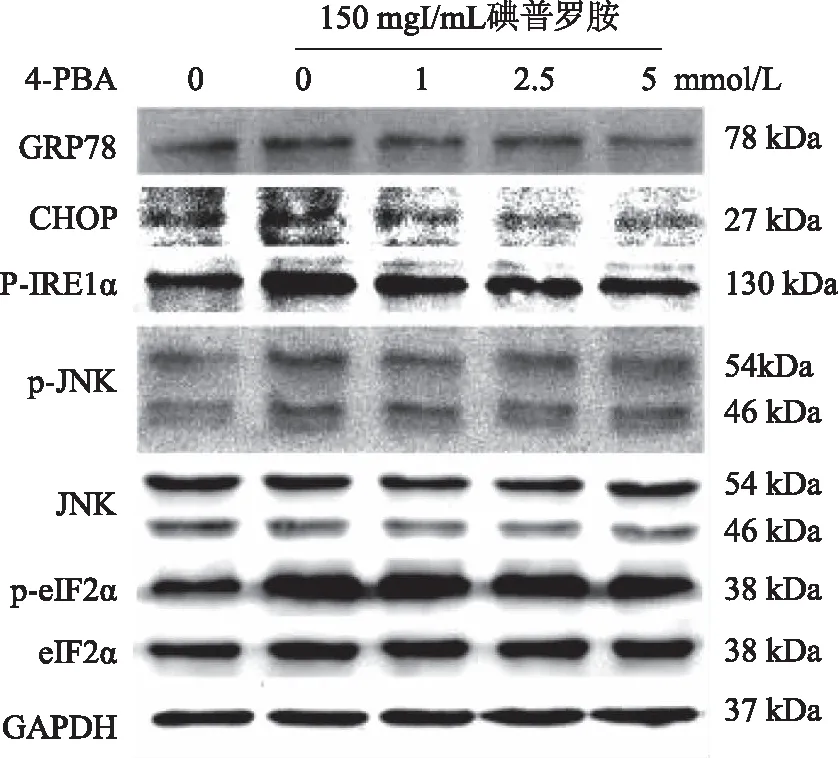
图6 4-PBA对碘普罗胺诱导的HK-2细胞内质网应激相关蛋白表达水平的影响
3 讨论
研究报道,内质网应激与肾小管损伤密切相关。内质网功能出现紊乱导致大量蛋白质被错误折叠,并激活肌醇必需蛋白1α(Inositol requiring protein-1,IRE1α)、蛋白激酶RNA样内质激酶(Protein kinase RNA-like ER kinase,PERK)及激活转录因子-6(Activating transcription factor-6,ATF-6)等跨膜受体感应蛋白,促使内质网通过未折叠蛋白反应(Unfolded protein response,UPR)及内质网相关降解途径(泛素-蛋白酶体),减少错误折叠蛋白质在内质网腔内蓄积[10]。活化的IRE-1α可通过激活JNK以及p38丝裂原活化蛋白激酶诱导前凋亡基因CHOP的表达,从而诱导细胞凋亡[11]。PERK的激活可使真核翻译起始因子2α(eIF2α)磷酸化,从而抑制mRNA翻译,并诱导CHOP的表达[12-13]。本研究显示,150 mgI/mL的碘普罗胺作用HK-2细胞3h后,细胞活力降低,Bax/Bcl-2、p-JNK/JNK及p-eIF-2α/eIF-2α比值以及Cleaved-Caspase-3、GRP78、CHOP、p-IRE1α的表达明显增高,说明碘普罗胺可能通过激活内质网应激,触发细胞凋亡介导HK-2细胞损伤。
4-PBA是一种低分子量且具有伴侣活性的化合物,可作为特异的内质网应激抑制剂发挥其药理作用,通过阻断UPR的激活从而减轻内质网应激相关损伤[14]。有研究表明,4-PBA可以通过抑制NF-κB途径以及Caspase-3的激活减轻脂多糖诱导的炎症反应[15]。在衰老小鼠心脏组织中,内质网应激明显增强,线粒体功能障碍,而经过4-PBA预处理后可显著降低内质网应激,恢复线粒体的功能[16]。本研究结果显示,与碘普罗胺处理组相比,细胞活力随4-PBA浓度的增加而逐渐上升,而Bax/Bcl-2、p-JNK/JNK、p-eIF-2α/eIF-2α比值以及Cleaved-Caspase-3、GRP78、CHOP、p-IRE1α的蛋白表达水平均降低。
内质网应激激活UPR后,活化的IRE-1α和PREK可通过调控硫氧还蛋白结合蛋白(Thioredoxin interaction protein,TXNIP)转录水平,诱导ROS的产生,从而激活NLRP3炎症小体,诱导细胞损伤、焦亡[17]。NLRP3炎症小体的激活进一步加剧肾小球硬化,使肾小管基底膜增厚,肾小管间质纤维化,肾小管上皮细胞出现空泡化甚至凋亡。我们前期研究结果显示,用不同浓度的碘普罗胺处理HK-2细胞后,细胞活力明显下降,ROS水平、NLRP3、ASC、caspase-1及IL-1β蛋白的表达均明显增高[5],提示碘普罗胺极有可能通过ROS途径激活NLRP3炎症小体引起HK-2细胞损伤。在本研究中,我们发现经碘普罗胺作用3h后的HK-2细胞,ROS水平明显升高,不同浓度的4-PBA均可减少ROS的产生,减轻细胞损伤。说明碘普罗胺可能通过内质网应激激活UPR,诱导ROS的产生,而4-PBA 是否能抑制NLRP3炎症小体的激活还需进一步研究。
此外,内质网应激诱导的Ca2+被释放到细胞质中导致线粒体内膜去极化,并通过抗凋亡蛋白Bcl-2和促凋亡蛋白Bax调节线粒体途径,对细胞凋亡起调控作用[18-19]。本研究结果显示,HK-2细胞经碘普罗胺处理3h后,ΔΨm明显降低,部分细胞出现核固缩或核碎裂,凋亡相关蛋白Bax/Bcl-2比值以及Cleaved-Caspase-3的表达增高,而不同浓度的4-PBA均可逆转上述效应。
虽然本研究在细胞水平上初步证实了4-PBA的保护作用及其可能机制,但仍存在不足之处。在接下来的实验中,我们将继续研究4-PBA是否能抑制ERS介导的NLRP3炎症小体的激活,并通过建立对比剂肾病动物损伤模型进一步探讨4-PBA的作用机制。
综上所述,4-PBA可通过抑制内质网应激减轻碘普罗胺引起的肾小管上皮细胞损伤。但4-PBA 是否能抑制NLRP3炎症小体的激活还需进一步研究。
