牛血清白蛋白-羟基磷灰石构建的组织工程支架用于尿道损伤修复的效果
2022-06-22张楷乐杨冉星王宇晖
杨 铭 张楷乐 王 营 杨冉星 刘 猛 王宇晖 傅 强
创伤后尿道狭窄的治疗一直是临床难以解决的问题,其原因为受损后尿道黏膜的记忆性修复能力较差,常引起胶原过度沉积形成瘢痕而堵塞尿道[1]。组织工程和再生医学在各个领域应用的研究较多,但用于尿道损伤修复的研究十分匮乏,对于无瘢痕再生的治疗至今尚无有效的方法。目前,临床上常用舌黏膜、颊黏膜和阴囊皮瓣等自体移植物进行尿道损伤修复,但可能会发生许多复杂的并发症,令患者饱受困扰[2-4]。牛血清白蛋白(BSA)水凝胶是目前公认的具有良好生物相容性的材料,因自愈合能力佳,使其在组织工程领域的应用非常广泛[5-6],其中银离子交联的BSA水凝胶的抗菌作用可很好地促进伤口愈合[7]。BSA水凝胶的力学性能存在缺陷,使其不能作为上皮组织工程修复的支架材料。羟基磷灰石(HA)为骨组织成分,可用来增加水凝胶的力学强度,已被用于骨组织的组织工程支架构建[8],并取得了良好的修复效果。已有研究[9-12]证实,脂肪干细胞及其外泌体具有促进伤口愈合的作用。本研究通过调控HA含量来改善银离子交联的BSA抗菌水凝胶支架的力学性能,并结合脂肪干细胞构建了适用于尿道的组织工程支架,在体内和体外实验中均取得了令人满意的结果。
1 材料与方法
1.1 实验材料 选取雄性4周龄新西兰兔12只,体重为2.0~2.5 kg。实验动物由上海交通大学医学院附属第六人民医院动物实验中心提供,机构许可证号为SYXK(沪)2016-0020。
1.2 方法
1.2.1 干细胞的提取和培养 取兔腹股沟处皮下脂肪组织,剪碎后与脂肪组织等体积以0.1%Ⅰ型胶原酶消化,520×g离心5 min后经200目滤网过滤多余的未剪碎的组织碎片,收集滤液,再以520×g离心5 min后弃上清液,以含10%胎牛血清的DMEM培养液重悬细胞,计数后种于直径为100 mm的培养皿中,置于37 ℃、体积分数为0.05的CO2培养箱内培养,48 h后首次换液。每3 d更换培养液1次,细胞生长至80%融合时进行传代。
1.2.2 水凝胶的合成 将2 g BSA溶于80 mL 0.05 mol/L的PBS缓冲液中,加入0.116 g EDTA,室温下搅拌均匀;将溶液冷却至0 ℃,加入10.4 mL质量浓度为20%的Traut’s试剂,室温下搅拌3 h。将巯基化后的BSA转移至8 000 Da的透析系统,在pH值为6的透析液中纯化3 d,冷冻干燥后获得BSA-SH。取300 mg BSA-SH溶于pH值为5.2的乙酸钠溶液中,冰浴搅拌过夜;最后加入500 μL 0.05 mol/L的硝酸银溶液搅拌15 s,置于37 ℃温箱中30 min成胶。观察成胶前后水凝胶的性状。
1.2.3 力学性能评估 为探究适用于尿道修复的BSA抗菌水凝胶中HA含量,分别将0、10%、20%的HA混入水凝胶(BSA组、BSA-10%HA组、BSA-20%HA组),以4周龄新西兰兔的尿道黏膜作为对照进行拉力测试,于室温下分别将大小为1.5 cm×1.0 cm×0.1 cm的水凝胶在生物力学测定仪上进行测试,以10 mm/min的速度测量水凝胶和正常尿道黏膜的应力。根据水凝胶从受力牵拉至断裂时所承受的拉力,以及断裂时的长度与初始长度的百分比制作应力应变曲线,通过1/3至2/3应力区间的斜率分别计算得出杨氏模量,比较各组力学性能。
1.2.4 细胞增殖实验 将2×103个脂肪干细胞种于96孔板中,每孔加入100 μL培养液。将BSA水凝胶和BSA-10%HA水凝胶切成大小为3 mm×3 mm×1 mm的块状,放入孔中与细胞共同培养。在培养第1、3、7天取出水凝胶,将每100 μL中含有10 μL CCK-8溶液的工作液加入各孔中,置于37 ℃、体积分数为0.05的CO2培养箱内孵育4 h后,应用酶标仪测定吸光度(A)值以反映细胞的数量和活力。记录空白对照组(不加任何材料的正常状态下的细胞)和BSA、BSA-10%HA组培养第1、3、7天的A值。
1.2.5 体外降解率测定 将BSA水凝胶和BSA-10%HA水凝胶冻干后称重(W0),置于模拟体液中,再分别于1、3、5、7、10、14、21、28 d冻干后称重(Wt),计算降解率,降解率=[1-(Wt/W0)]×100%,根据降解率绘制降解曲线。
1.2.6 动物实验 将实验兔分为空白对照组、BSA组和BSA-10%HA组,每组4只。空白对照组在切除兔尿道黏膜(1 cm×1 cm)后不做任何处理;BSA组在切除兔尿道黏膜(1 cm×1 cm)后,用BSA水凝胶进行修补;BSA-10%HA组在切除兔尿道黏膜(1 cm×1 cm)后,用BSA-10%HA水凝胶进行修补。所有实验兔于术后至取材期间均未发生明显的感染或植入反应,切口皮肤逐渐愈合,且在整个研究过程中均保持良好的健康状况。BSA、BSA-10%HA水凝胶修复尿道后第4周取材,观察伤口愈合情况。

2 结 果
2.1 抗菌BSA-HA水凝胶成胶前后情况比较 巯基化后的BSA在银离子加入前呈流体状,加入银离子后置于37 ℃温箱30 min后呈胶态。见图1。

A 成胶前 B 成胶后
2.2 力学性能评估结果比较 正常尿道黏膜的应力为26.746 kPa,杨氏模量为258.33 kPa;BSA、BSA-10%HA、BSA-20%HA水凝胶的应力分别为14.487、35.167、29.549 kPa,杨氏模量分别为292.65、247.11、981.16 kPa;BSA-10%HA水凝胶的杨氏模量与正常尿道黏膜最为接近。正常尿道黏膜和各水凝胶的应力应变曲线见图2。

图2 正常尿道黏膜和各水凝胶的应力应变曲线
2.3 细胞增殖实验结果比较 空白对照组、BSA组、BAS-10%HA组培养第3、7天的A值均显著高于同组培养第1天(P值均<0.05)。3组间培养第1、3、7天A值的差异均无统计学意义(P值均>0.05)。见表1。

表1 3组在培养第1、3、7天的A值比较
2.4 水凝胶体外降解率比较 BSA水凝胶的体外降解率为(33.66±3.97)%,BSA-10%HA水凝胶的体外降解率为(29.87±1.22)%,两者间的差异无统计学意义(P>0.05)。两种水凝胶的体外降解曲线见图3。
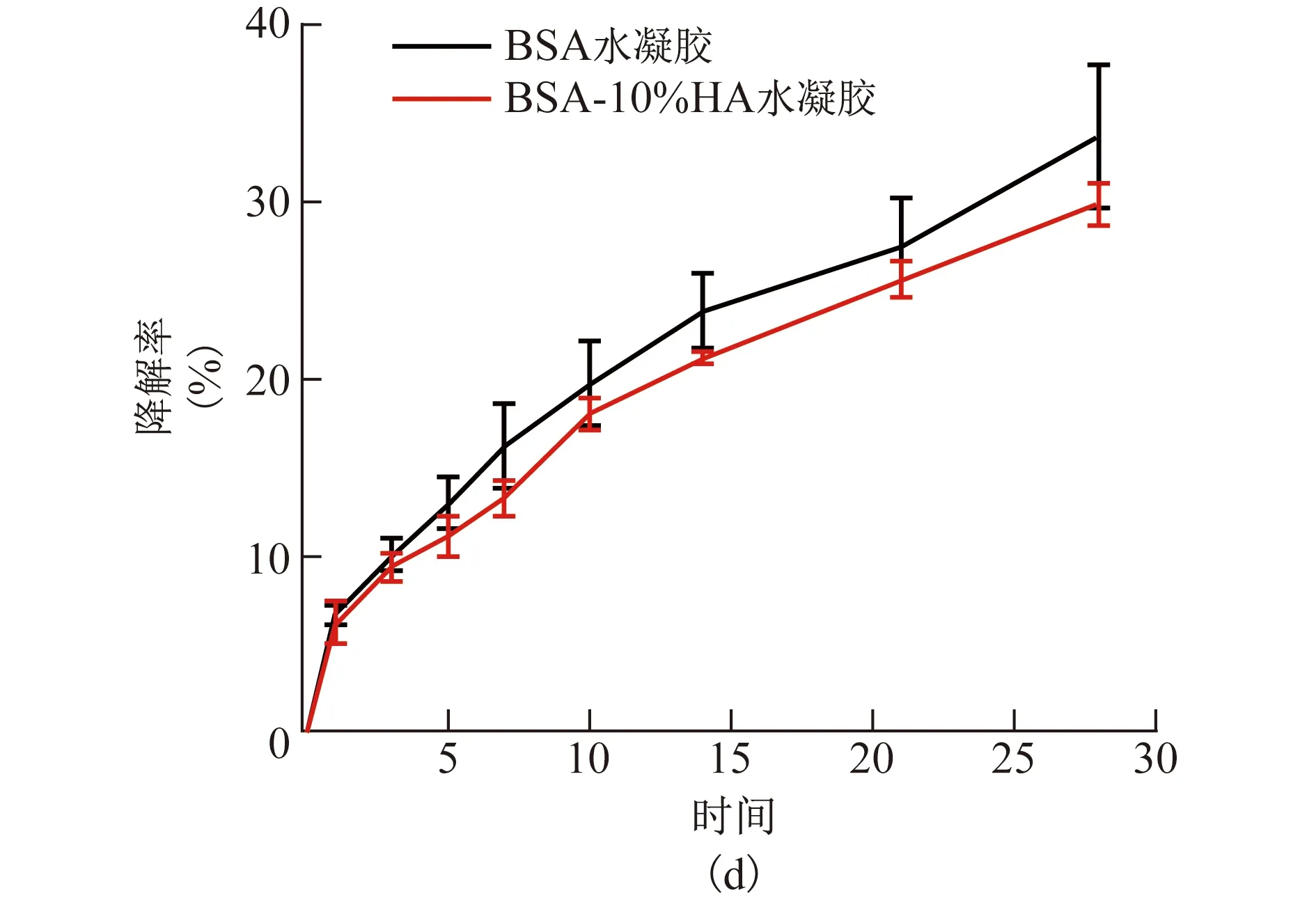
图3 BSA和BSA-10%HA水凝胶的体外降解曲线
2.5 各组实验兔尿道修复情况比较 损伤部位尿道大体观:空白对照组实验兔的伤口愈合不完全,见明显的缺损,伤口中心区域颜色苍白;BSA组见伤口已完全愈合,但损伤部位有明显的瘢痕形成;BSA-10%HA组见伤口愈合好,形成的瘢痕极少,损伤部位表面无明显隆起。见图4A~4C。BSA组瘢痕区域面积占比为(55.70±9.11)%,显著高于BSA-10%HA组的(10.40±1.87)%(P<0.05)。H-E染色和Masson染色见空白对照组伤口部位组织仍未完全被上皮覆盖;BSA组上皮几乎覆盖了伤口表面,但可见明显的胶原纤维沉积;BSA-10%HA组伤口愈合完全,组织结构清晰,未见明显的胶原纤维沉积。见图4D~4I。
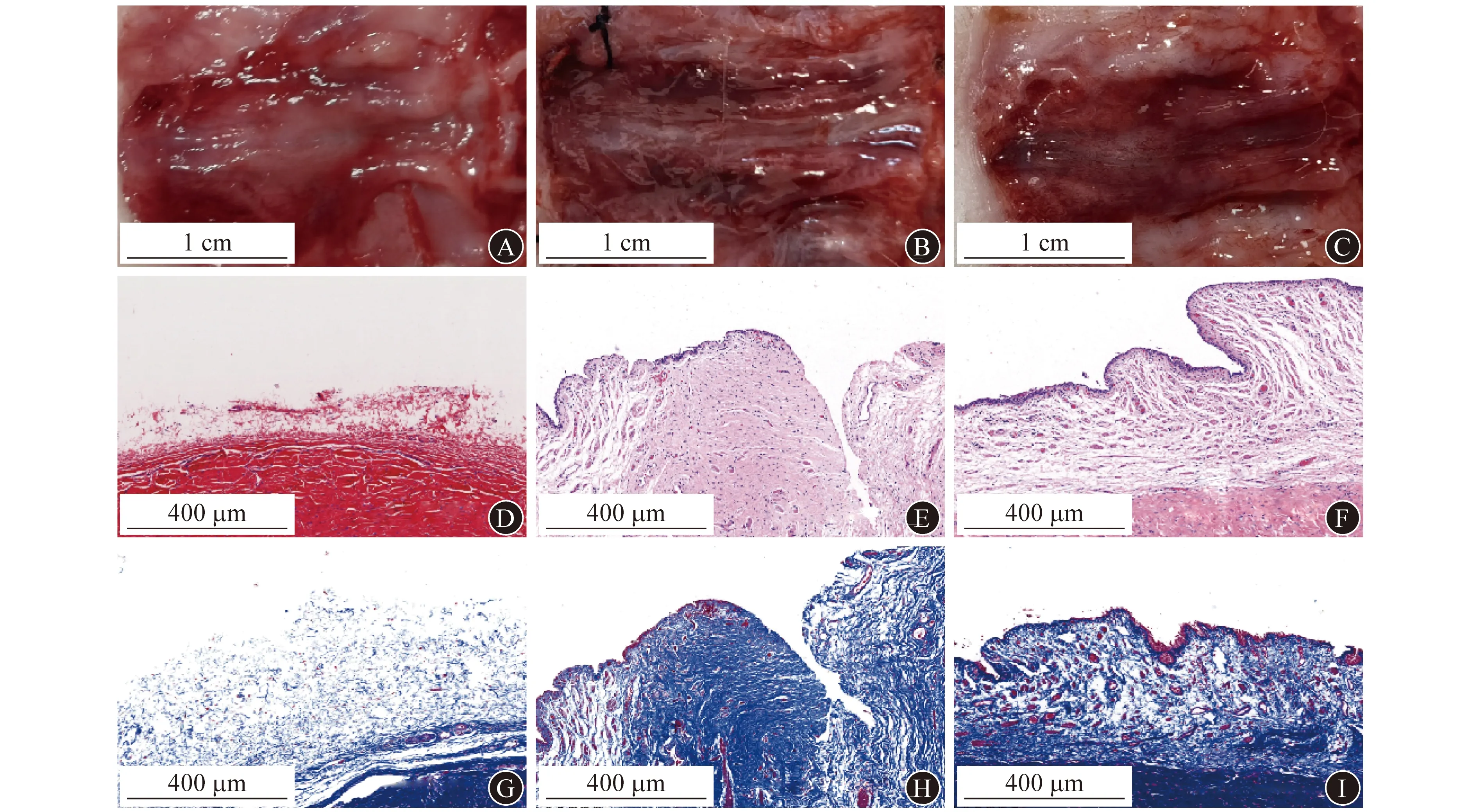
A 空白对照组尿道大体观 B BSA组尿道大体观 C BSA-10%HA组尿道大体观 D 空白对照组H-E染色显示损伤部位上皮未完全覆盖(×100) E BSA组H-E染色显示损伤部位上皮覆盖不全,组织密度增高(×100) F BSA-10%HA组H-E染色显示上皮完全覆盖,组织结构正常(×100) G 空白对照组Masson染色显示损伤部位胶原沉积少(×100) H BSA组Masson染色显示损伤部位胶原过度沉积(×100) I BSA-10%HA组染色显示损伤部位无过多的胶原沉积(×100)
3 讨 论
过多的瘢痕形成是造成创伤后尿道狭窄的主要原因[13-14],损伤范围过大的患者常因无合适的组织替代物需行膀胱造瘘而影响其生活质量,或忍受获取自体组织导致并发症发生带来的痛苦[14]。临床效果较好的自体组织替代物主要为舌黏膜和颊黏膜,其原因为这些部位的组织是单纯的上皮细胞,无多余的附属器,力学性能与尿道黏膜接近,且易获取,但是患者要忍受言语功能受损、疼痛等术后并发症带来的痛苦,还存在需要二次修复时无处取材的难题[2]。目前的组织工程支架中,许多力学性能好的修复材料使用后易引发免疫排斥反应等,且种子细胞多附着在支架表面[15]。
BSA作为具有良好生物相容性的自然提取物,是用作组织工程支架的优秀材料,但本身的力学性能限制了其在临床上的应用。在伤口无瘢痕愈合的过程中,机械转导相关信号通路的激活是导致胶原过度沉积的重要原因。有研究[16-18]结果表明,抑制机械信号转导相关信号通路或降低伤口表面张力,减少牵拉,能够有效地减少瘢痕形成;此外,材料的抗菌特性对伤口愈合十分有益,其原因为银离子作为交联剂,不仅能使得巯基化的BSA交联在一起,还能够有效抑制细菌繁殖[7]。杨氏模量过高的材料会导致修复后的伤口周围组织正常伸缩受限,不具有与黏膜相同的形变能力,导致其不能很好地适应组织动态的形变,从而激活机械转导相关信号通路导致瘢痕形成。单纯的BSA水凝胶的杨氏模量亦接近于正常黏膜,但能承受的应力过小;20%HA的BSA-HA水凝胶最大应力虽高于正常黏膜,其杨氏模量大于正常黏膜。本研究结果显示,BSA-10%HA水凝胶的杨氏模量与正常尿道黏膜最为接近,提示10%HA在一定程度上提升了BSA水凝胶的力学性能;BSA-10%HA水凝胶的应力最大,提示在保证组织工程支架的生物相容性的同时亦提高了力学强度,更好地模拟了生物尿道黏膜的微环境,从而维持组织正常的增殖活动以修复伤口,此外使用具有促进伤口愈合功能的脂肪干细胞作为种子细胞,可加快伤口闭合同时减少尿液刺激[9,19]。本研究细胞增殖实验结果显示,空白对照组、BSA组、BAS-10%HA组培养第3、7天的A值均显著高于同组培养第1天,3组间培养第1、7、9天A值的差异均无统计学意义;该结果表明,培养第3、7天的细胞活力显著提高,反映了细胞增殖情况良好,而BSA水凝胶和BSA-HA水凝胶的加入并不影响细胞的活力。BSA与BSA-10%HA水凝胶体外降解率的差异无统计学意义,且在体内环境中,由于尿液的冲洗,以及周围组织的牵拉,水凝胶的降解速率较体外稍快,故BSA和BSA-10%HA水凝胶均能安全排出,不会因材料在体内残留而引发其他远期并发症。
本研究结果显示,空白对照组伤口愈合不完全,伤口中心区域颜色苍白,表明组织愈合过程慢,且纤维组织开始沉积,血管生成较少,在伤口愈合后期将形成明显的瘢痕组织;BSA组伤口完全愈合,伤口快速修复是由水凝胶中加入的脂肪干细胞所导致的,但是由于支架材料与自体组织并不完全匹配,仍有胶原纤维沉积导致伤口处瘢痕形成而隆起,修复效果并不理想;相比于BSA组,BSA-10%HA组的伤口愈合好,无明显隆起,尿道通畅,组织学可见上皮覆盖完全,无过多的胶原沉积。少量的瘢痕形成可能是由于缝线的牵拉和损伤所导致,因此后续的研究中可考虑设计新的交联方式,将凝胶的交联与伤口覆盖相结合,即将前体凝胶涂抹于伤口处,再对其进行交联使其与伤口紧密结合,从而避免缝线的牵拉,以达到完全无瘢痕愈合的效果。
综上所述,BSA-10%HA抗菌水凝胶作为力学性能适配尿道黏膜的组织工程支架,减少了伤口修复过程中机械转导相关信号通路的激活,从而减少胶原纤维沉积;同时,BSA-10%HA水凝胶拥有良好的生物相容性,不会引发明显的炎症和排异反应,在尿道损伤模型动物中的修复效果较佳,具有一定的临床转化价值。
