子痫前期孕妇胎盘中趋化因子免疫反应性及其与胎盘组织病理学变化、不良妊娠结局关系
2022-06-21王琛琛丁其培章杨韦
王琛琛 陈 薇 丁其培 章杨韦 卢 红
江苏省海安市人民医院(226600)
子痫前期是引起早产、胎儿宫内生长受限、产后持续高血压的重要病因。细胞滋养层未能侵入蜕膜化子宫内膜及子宫肌层,妊娠前3个月螺旋状动脉转变失败可能是造成子痫前期的主要病理因素,以上病理改变可促进胎盘因子大量释放至母体循环,引起全身炎症反应、氧化应激及血管内皮细胞活化[1-2]。fractalkine是趋化因子CX3CL1家族中的重要成员,在调节免疫系统中发挥重要功能[3]。研究胎盘组织内fractalkine免疫性反应强度,及其与子痫前期患者胎盘病理改变间关系,有助于分析fractalkine免疫反应性在子痫前期中的作用机制,进一步了解子痫前期致病机制[4]。基于以上背景开展本次研究。
1 材料与方法
1.1 研究对象
2017年6月-2020年6月本院收治的子痫前期患者68例及正常妊娠孕妇30例分别纳为观察组及对照组。子痫前期诊断参照《妇产科学》相关诊断标准[5],纳入标准:观察组符合子痫前期相关诊断标准,对照组为血压正常健康孕妇;两组既往健康。排除标准:排除合并其他妊娠合并症如糖尿病、甲亢、慢性肾病等,合并严重心血管系统疾病者、代谢性疾病者、多胎妊娠。本研究经医院伦理委员会批准,参与者知情且同意。
1.2 标本采集及处理
1.2.1标本采集各组分娩完毕后,尽量在无菌环境中取5个随机位点,从中央胎盘母体表面中心分离出1cm×1cm×1cm组织块,经生理盐水洗涤后置于10%福尔马林溶液内固定24h,常规步骤石蜡包埋、切片,待用。
1.2.2胎盘形态学及组织学观察各组胎盘组织形态学改变,包括绒毛状水肿、纤维蛋白坏死、合胞体结数量、玻璃样变、钙化、合体滋养层基底膜增厚的等情况;同时在光学显微镜放大20倍下,对胎盘组织末端绒毛血管进行评分:通过图像分析系统在终端绒毛的每个随机选定区域手动勾勒出血管壁,利用计算机软件定量测量血管面积,将血管一部分带回终端绒毛总区域,计算机分析系统进行评分。
1.2.3试验试剂使用抗体包括人单克隆抗人CX3CL1/fractalkine抗体,稀释度为1:1000(sc20730,Santacruz,CA,USA);抗CD34抗体,稀释度1:500(ab81289,Abcam,Cambridge,MA)。
1.2.4免疫组织化学法按照组织切片-脱蜡-抗原修复-清除内源性过氧化物酶-封闭-一抗孵育-二抗孵育-DAB显色-复染-封片等步骤,检测胎盘组织内fractalkine免疫反应性。
1.2.5结果判定由两名经验丰富的组织病理学家对胎盘组织内fractalkine免疫反应性进行判断,评估所需器材有生物纤维镜(日本,奥林巴斯ME2)与图像分析系统(荷兰阿姆斯特丹,Nis Elements)。在细胞质与细胞核中棕色染色强度表示存在fractalkine表达,根据像素反射确定阳性率,检测到抗原表达水平可表示为总图像像素数量百分比,<80像素表示fractalkine反应性弱(+),80~200像素反应性中等(++),>200像素反应性强(+++)。
1.3 统计学方法
2 结果
2.1 各组临床特征及检测指标
观察组中轻度子痫前期26例,重度子痫前期42例。对照组、轻度子痫前期组及重度子痫前期组年龄、妊娠及分娩次数、血浆白蛋白水平无差异(P>0.05)。新生儿出生体重观察组低于对照组且重度子痫前期低于轻度子痫前期(P<0.05);胎儿宫内生长受限及早产者占比重度子痫前期患者均高于对照组及轻度子痫前期者(P<0.05);观察组收缩压和舒张压均高于对照组且重度子痫前期患者高于轻度子痫前期患者(P<0.05);重度子痫前期患者24h尿蛋白水平高于轻度子痫前期患者(P<0.05)。见表1、表2。

表1 各组临床特征比较

表2 各组临床检测指标比较
2.2 各组胎盘病理改变情况比较
对照组与观察组脐带插入位置、绒毛水肿、玻璃样变情况无差异(P>0.05)。发生胎盘组织内合体滋养层基底膜增厚、合胞体结、纤维蛋白样坏死的患者占比对照组、轻度子痫前期组、重度子痫前期组依次升高(均P<0.05),末端绒毛血管化评分对照组(26.66±3.65分)、轻度子痫前期组(33.37±4.03分)、重度子痫前期组依次升高(37.74±5.14分)(F=54.892,P=0.000)。见表3。
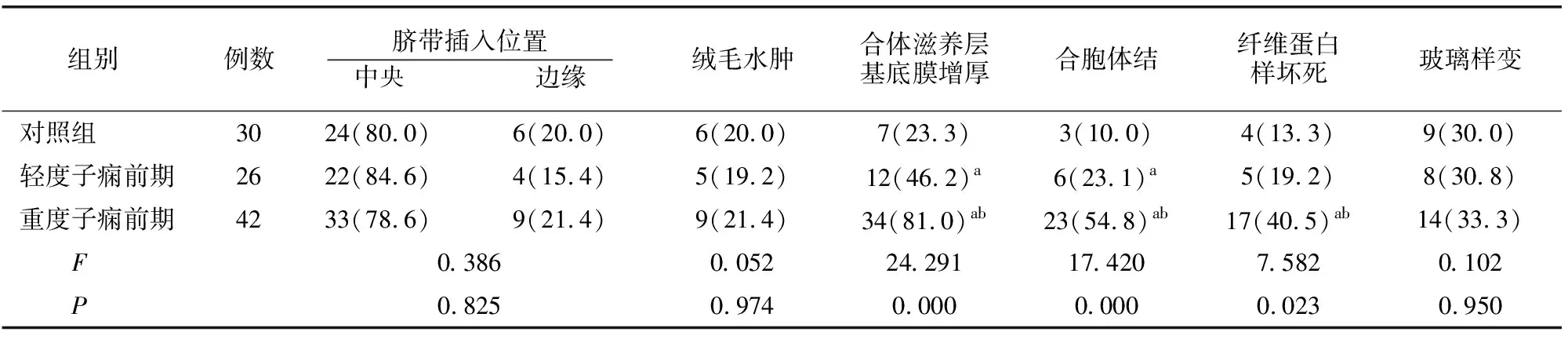
表3 各组胎盘病理改变情况比较[例(%)]
2.3 各组胎盘组织内fractalkine免疫反应性比较
对照组、轻度及重度子痫前期患者胎盘滋养层细胞及毛细血管内皮中fractalkine免疫反应性强度分级存在差异(P<0.05)。见表4。
2.4 观察组胎盘组织fractalkine免疫反应性与胎盘病理改变及不良妊娠结局相关性
相关性分析提示,观察组胎盘组织fractalkine免疫反应性与胎儿宫内生长受限(r=0.465)、早产(r=0.388),及合体滋养层基底膜增厚(r=0.511)、合胞体结(r=0.463)、纤维蛋白样坏死(r=0.386)、末端绒毛血管化(r=0.415)等病理改变均存在一定相关性(均P<0.05);与新生儿体重(r=-0.241)、分娩时胎龄(r=-0.304)、收缩压(r=0.241)、舒张压(r=0.211)、24h尿蛋白(r=0.224)均无相关性(均P>0.05)。
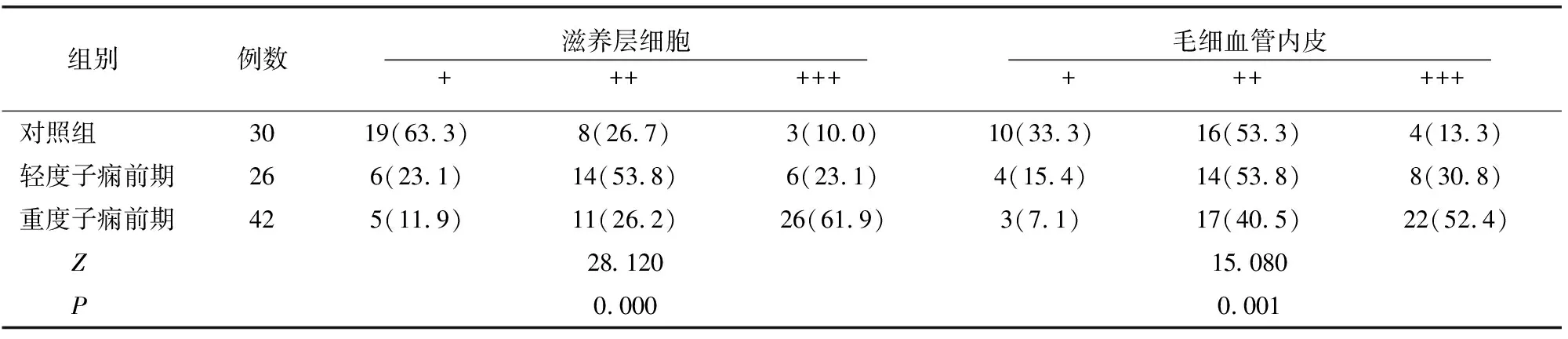
表4 各组胎盘组织内fractalkine免疫反应性比较[例(%)]
3 讨论
趋化因子在炎症反应性疾病中具有重要作用,fractalkine是趋化因子家族中重要的成员,作为趋化因子及粘附因子,fractalkine在协调炎症部位细胞定植与募集中起着关键作用[6]。多项研究表明,合并多种炎性疾病者病灶组织内fractalkine免疫组化表达异常升高[7-9]。朱锐等[10]研究发现,急性冠脉综合征患者外周血中fractalkine释放增加,并可与白细胞表面受体相结合,激活FAK-PI3K/PKB信号通路,参与急性冠脉综合征炎症反应。张洪生等[11]研究发现,fractalkine可通过上调Bax蛋白表达,下调Bcl-2蛋白表达,促进心肌细胞凋亡并参与心肌细胞炎症反应。
以往研究表明,炎症状态下fractalkine可作为自分泌及旁分泌因子,加剧氧化应激及炎症反应[12];而子痫前期孕妇机体处于炎症状态,存在循环细胞因子水平升高、淋巴细胞、粒细胞、单核细胞活化等特征,母体促炎症细胞因子处于高水平[13]。
本研究免疫组化法检测发现,子痫前期患者胎盘组织内合体滋养层细胞及毛细血管内皮的fractalkine免疫反应性强度高于正常妊娠者,提示子痫前期炎症状况可能上调了胎盘组织内fractalkine表达。此外,本研究发现,子痫前期患者胎盘组织发生了合体滋养层基底膜增厚、合胞体结数量增加、纤维蛋白样坏死、末端绒毛血管化等病理改变。相关性分析显示,子痫前期患者胎盘组织内fractalkine免疫反应性强度与胎盘病理改变存在相关性,提示fractalkine表达水平可能与胎盘病理病因有关。
子痫前期的主要病理原因可能是细胞滋养层未能侵入蜕膜化子宫内膜及子宫肌层,以及妊娠前3个月螺旋状动脉转变失败。随着孕周的增加,胎盘灌注减少,最终导致胎盘缺血缺氧,影响胎儿发育[14-15]。本文分析发现,与正常妊娠孕妇相比,子痫前期患者并发早产、胎儿宫内窘迫等不良妊娠结局占比升高,且重度子痫前期者更高。相关性分析发现,子痫前期患者胎盘组织内fractalkine免疫反应性强度与不良妊娠结局存在相关性。说明胎盘组织内fractalkine表达水平上升可能增加不良妊娠结局风险。
综上所述,与正常妊娠孕妇相比,子痫前期患者胎盘组织中fractalkine免疫反应性增强,且与患者胎盘组织病理改变及不良妊娠结局存在相关性,提示fractalkine及其相关通路可能与子痫前期发病机制有关。
