fFN、NF-κB、HMGB1联合预测早产价值及与神经发育关系探究
2022-06-21牟莹莹侯玉娇
牟莹莹 侯玉娇 王 伟
山东省潍坊市妇幼保健院(261011)
早产是致围产儿死亡首要原因之一[1]。目前临床主要根据孕28~36+6周孕妇是否出现宫缩、阴道出血或有血性分泌物等典型症状判断早产,缺乏超早期预警机制,多数孕妇保胎失败[2]。临床普遍认为促炎、免疫调控过程参与早产发生发展[3-4]。胎儿纤维连接蛋白(fFN)是绒毛滋养细胞生成的糖蛋白,分娩前胎盘或羊膜炎性或机械性损伤可致fFN外泄。有研究提出,fFN阳性利于评价早产风险[5]。高迁移率族蛋白B1(HMGB1)是高度保守核蛋白,外周血水平升高多与神经发育异常有关,但近年深入研究显示,HMGB1还具有促炎作用,可能介导早产中炎性反应过程[6]。核转录因子(NF-κB)具有炎症及免疫调节多重作用[7]。本研究联合检测fFN及血清NF-κB、HMGB1水平,分析其预测早产价值及与新生儿神经发育的关系。
1 资料与方法
1.1 研究对象
回顾性收集2019年1月-2020年4月本院收治的有早产危险因素孕妇195例临床资料,根据妊娠结局分为早产组和足月分娩组。纳入标准:①明确有早产史、妊娠间隔≤18个月或≥5年、孕期高强度劳动或营养不良等早产危险因素;②24 h内无同房史、无阴道检查史;③单胎妊娠。排除标准:①伴慢性肾炎、病毒性肝炎;②存在前置胎盘、心脏病、妊娠期高血压疾病;③合并阴道炎。本研究经伦理委员会审批,孕妇均签署知情同意书。
1.2 检测方法
①fFN:常规处理消毒后,无菌拭子置阴道后穹窿处采集分泌物标本,以全自动生化分析仪(北京普朗新技术有限公司)检测fFN,fFN<50 ng/ml为阴性,否则为阳性。②血清NF-κB、HMGB1:取孕妇晨空腹静脉血、新生儿头皮静脉血,离心取上清,以珠海丽珠生物科技有限公司酶联免疫试剂盒检测NF-κB、HMGB1水平。
1.3 评估标准
采用新生儿行为神经测定(NBNA)评估新生儿神经发育,包含对光习惯、声音、拥抱、吮吸、意识、肌张力等反应,评分范围0~40,≤35分为神经发育不良,>35分为神经发育良好。
1.4 观察指标
比较两组出现先兆早产症状3 d内、7 d内、14 d内fFN、血清NF-κB、HMGB1水平。先兆早产判断:妊娠28~<37周,出现不规律宫缩,且伴腹痛、阴道流血等症状。分析fFN、血清NF-κB、HMGB1预测早产价值。比较早产组新生儿神经发育良好及不良血清NF-κB、HMGB1水平。分析新生儿神经发育与NF-κB、HMGB1水平相关性。
1.5 统计学处理

2 结果
2.1 两组一般情况比较
早产组51例,足月分娩组144例。两组年龄、体质指数、保胎孕周、流产史、孕史、保胎时间等比较无差异(P>0.05)。见表1。

表1 两组一般情况比较
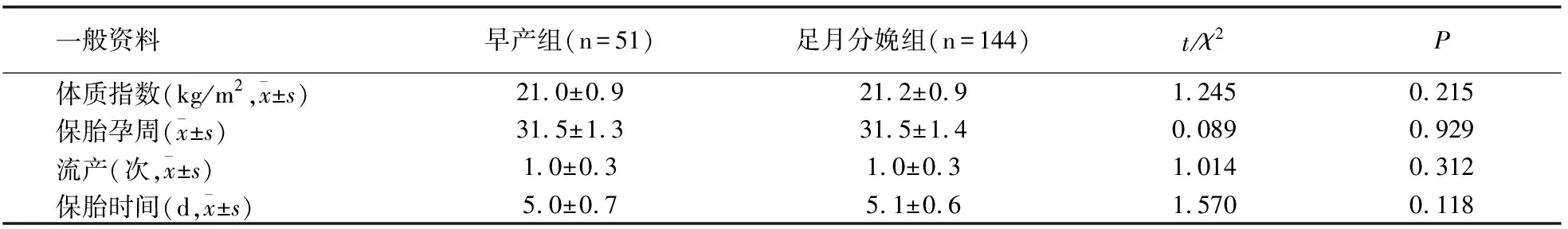
一般资料 早产组(n=51)足月分娩组(n=144)t/χ2P体质指数(kg/m2,x±s)21.0±0.921.2±0.91.2450.215保胎孕周(x±s)31.5±1.331.5±1.40.0890.929流产(次,x±s)1.0±0.31.0±0.31.0140.312保胎时间(d,x±s)5.0±0.75.1±0.61.5700.118
2.2 两组各检测指标比较
出现先兆早产症状3 d内、7 d内、14 d内,早产组fFN及血清NF-κB、HMGB1水平均高于足月分娩组(P<0.05)。见表2。

表2 两组出现先兆早产不同时间内各检测指标比较
2.3 ROC分析预测价值
ROC显示,预测在出现先兆早产症状14 d内早产价值的AUC fFN>NF-κB>HMGB1,7 d内NF-κB>HMGB1>fFN,3 d内fFN>NF-κB>HMGB1。14 d内fFN联合血清NF-κB、HMGB1水平预测价值最高。见表3。

表3 ROC分析出现先兆流产症状不同时间各指标预测价值
2.4 早产组新生儿神经发育与NF-κB、HMGB1水平
娩出后、生后第3 d、第7 d早产组神经发育不良新生儿血清NF-κB、HMGB1水平高于神经发育良好新生儿(P<0.05)。见表4。

表4 早产组新生儿神经发育与出生后不同时期NF-κB、HMGB1水平比较
2.5 新生儿神经发育与NF-κB、HMGB1水平相关性
新生儿神经发育与血清NF-κB、HMGB1水平均呈正相关(r=0.634、0.651,均P<0.001)。
3 讨论
早产是妊娠常见并发症,是导致新生儿死亡及神经发育异常等近远期并发症高发的主要原因[8]。目前早产具体发病机制尚未明确,但临床普遍认为炎症及免疫调控是早产发生的主要病理生理基础[9]。因此,从炎症及免疫调控分子层面探讨早产病理性改变对早期防治具有重要意义。
fFN是一种可连接并黏附绒毛、蜕膜的糖蛋白,有研究显示,早产孕妇机体中绒毛膜、蜕膜蛋白水解酶活性较正常孕妇略高,孕妇fFN外溢造成宫颈、黏液内fFN水平升高[10]。本研究结果显示,出现先兆流产症状3 d内、7 d内、14 d内早产组fFN水平高于足月分娩组。fFN作为细胞外基质糖蛋白,主要分布在蜕膜、胎盘胎膜组织、羊水内,可确保子宫蜕膜、胎盘间互相黏附而起到对应保护效果。正常情况临产前,绒毛膜自子宫蜕膜上剥离,fFN漏入宫颈,宫颈阴道分泌物内fFN水平可反映宫颈成熟度[11]。但早产孕妇受机体异常炎性反应或机械性损害等作用,绒毛膜、蜕膜、胎盘胎膜异常水解可大量释放fFN进入阴道分泌物[12]。因此,阴道分泌物fFN可反映早产孕妇胎盘组织受炎性损害程度。另外,有研究显示,与Bishop评分对比,fFN>50 ng/ml时预测分娩启动的灵敏度较高,且更具客观性[13]。本研究ROC曲线分析显示,出现先兆早产症状14 d内fFN预测早产的AUC值为0.819,可为临床提供预测信息。但fFN检测结果易受宫颈阴道炎等影响,造成假阳性率偏高,取材时应注意。
NF-κB是近年新发现的核转入因子,参与启动并调节人体炎症及免疫反应、细胞增殖分化及凋亡等相关基因转录过程[14]。研究显示,宫内感染可通过激活NF-κB相关通路介导促炎-抗炎系统紊乱而诱发早产,NF-κB阻滞剂可应用于早产预防[15]。HMGB1是新发现与炎症反应相关的核蛋白,与C反应蛋白、白介素-6等早期炎性因子对比持续存在时间更久,可能在炎症反应发生、维持过程中发挥更重要作用[16]。据报道HMGB1与Toll样受体-2、4、9或晚期糖基化终产物受体结合可经NF-κB所介导信号通路激活机体炎症反应[17]。本研究,出现先兆流产症状3 d内、7 d内、14 d内早产组血清NF-κB、HMGB1水平均高于足月分娩组,说明在发生早产孕妇中存在血清NF-κB、HMGB1异常表达情况,此表达特征与上述研究病理生理过程相符。ROC曲线分析显示,出现先兆早产症状14 d内 fFN联合血清NF-κB、HMGB1预测早产的AUC值最高。基于上述研究本研究得出以下结论:NF-κB、HMGB1可能在早产发生中发挥重要作用,机体异常表达HMGB1并经NF-κB过程激活下游炎症反应;胎盘组织受炎性影响,组织细胞损害、凋亡释放fFN进入宫颈分泌物。因此,NF-κB、HMGB1联合检测更能全面反映早产早期病理生理变化,为临床早期干预提供参考。
此外,早产易造成新生儿神经发育异常[18]。本研究发现,早产神经发育不良新生儿血清NF-κB、HMGB1水平高于神经发育良好早产新生儿。HMGB1主要在脑内表达,当缺氧缺血引起脑神经损害后,受损星型胶质细胞或神经元可被动释放HMGB1入血,启动并维持炎症瀑式反应,放大缺血再灌注神经炎性反应,延长炎性病理过程,加重神经损害。而有研究已表明HMGB1主要通过NF-κB所介导信号通路发挥炎性作用,故二者水平越高提示脑神经发育不良越严重[19-20]。另外,临床研究已证实,早产儿各项生理发育均未完善,其中以肺功能缺陷最为显著,因此,早产儿难以为机体组织正常代谢供给血氧,而脑神经组织作为高代谢器官易受缺氧影响,是炎性反应的最早启动者[21-22]。上述研究结果说明,NF-κB、HMGB1表达异常可能参与了早产新生儿神经发育发展的病理过程。相关分析显示,新生儿神经发育与血清NF-κB、HMGB1水平呈正相关,进一步证实NF-κB、HMGB1水平与神经发育关系密切,提示早产儿出生后需及时检测上述因子水平以指导临床治疗。但脑神经发育受多种病理生理过程调节,如NF-κB、HMGB1所介导炎症损害过程是否与其受体活性有关,仍需进一步探究。
综上所述,fFN联合NF-κB、HMGB1检测对早产有较高预测价值,且血清NF-κB、HMGB1水平与新生儿神经发育关系密切。临床可针对早产儿联合检测上述血清因子以评价神经发育情况,进行早期干预治疗。
