不同浓度葡聚糖硫酸钠诱导小鼠炎症性肠病模型的实验研究
2022-06-13董若曦蒋笑影陆金根潘一滨王佳雯
董若曦,蒋笑影,陆金根,潘一滨,王佳雯
1.上海中医药大学,上海 201203;2.上海中医药大学附属龙华医院肛肠科,上海 200032
炎症性肠病(inflammatory bowel disease,IBD)是1 组原因不明的慢性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD),临床症状可见腹痛、腹泻和黏液脓血便等[1]。近年来IBD 的发病率和患病率呈逐年上升态势。我国IBD 发病率逐年上升,预计2025年可达150万人[2],患病数居亚洲之首[3]。IBD 多发于青壮年人群,但近年来随着人口老龄化的加速,老年IBD 的患病数逐年上涨。老年IBD 患者一般病程较长,易反复发作,其治疗也受到基础疾病、服用多种药物、运动及认知功能受限等原因的制约[4],严重影响患者的生活质量。因此,研究IBD 的发病机制及药物治疗至关重要。目前,传统IBD 模型动物多使用小鼠,可采用葡聚糖硫酸钠(dextran sulfate sodium,DSS)饮水法进行造模,但DSS 的浓度缺乏统一的标准。因此,本实验旨在尝试采取不同浓度的DSS 诱导合适的IBD 小鼠模型,为相关研究提供依据。
1 材料与方法
1.1 实验动物
健康的SPF 级雌性C57BL6 小鼠40 只,9 周龄,体质量(20 ±2)g,购自上海灵畅生物科技有限公司「SCXK(沪)2018-0003」,饲养于上海中医药大学附属龙华医院动物房「SCXK(沪)2008-0036」。所有动物实验均经过上海中医药大学附属龙华医院动物伦理委员会批准,按照实验动物处理指南给予动物福利并进行相关处理。
1.2 主要试剂和仪器
DSS(分子量36 000 ~50 000,规格:100g/罐,CAS#9011-18-1 M.W.)购自美国MP Biomedicals 公司;小鼠粪便隐血试剂组(双联法)BA-2020E,购自珠海贝索生物技术有限公司;小鼠白细胞介素-6(interleukin-6,IL-6)ELISA 试剂盒(EK206/3—96),购自上海联科生物有限公司。微量移液器(美国Eppendorf公司);Synergy H1MF 酶标仪,购自美国BioTek 公司;Leica EG1150 包埋机、Leica RM2235 切片机、Leica HI1210 摊片机、Leica HI1220 烘片机均购自德国Leica Biosystems Nussloch GmbH 公司;Olympus BX43 显微镜购自日本Olympus 公司。
1.3 动物实验分组
40 只小鼠予全价营养饲料,恒温恒湿适应性饲养1 周后,采用数字表法随机分为5 组:A 组(n=8)自由饮用2.0%DSS,每2 d 换水;B 组(n=8)自由饮用2.5%DSS,每2 d 换水;C 组(n=8),自由饮用3.0%DSS,每2 d 换水;D 组(n=8)自由饮用3.5%DSS,每2 d 换水;E 组(对照组,n=8),自由饮用灭菌蒸馏水。5 组处理均连续7 d。
1.4 样本采集
处理到期后,小鼠禁食不禁水6 h,异氟烷吸入麻醉下摘眼球取血,室温下静置1 h 后,3 000 转/min、4 ℃离心10 min,取上清,保存于-80 ℃;取小鼠全结直肠组织,使用4% 中性甲醛固定,常规石蜡包埋切片。
1.5 指标检测
自DSS 给药后每天进行小鼠的疾病活动指数(disease activity index,DAI)[5]评分,评分标准见表1。使用酶联免疫吸附法(enzyme-linked immunosorbnent assay,ELISA)检测小鼠血清IL-6 水平。取小鼠肠道蜡块,制作小鼠肠道组织石蜡切片(厚度约5 μm),经脱蜡、苏木素-伊红染色、脱水、透明后进行后续病理学指标检测。
1.6 统计学分析
所有数据均采用统计软件SPSS 21.0 进行分析。符合正态分布的计量资料采用均数±标准差(±s)表示,组间比较行t检验或Mann-Whitney U 检验,组内比较予配对t检验。所有检验均采用双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况比较
实验前后对比,对照组小鼠进食量、饮水量无明显变化,活动敏捷,毛发光滑;DSS 饮用的各组小鼠,随着饮用时间的加长,绝大部分进食、水量逐渐减少,形体逐渐消瘦,反应迟钝不喜动,对外界反应淡漠,至给药结束时,D 组小鼠死亡2 只,其他组小鼠未见死亡。
2.2 各组小鼠体质量比较
造模前各组小鼠间体质量值差异均无统计学意义(P>0.05)。造模后,与对照组相比,除A 组外(P<0.05),其他组小鼠间体质量均显著下降(P<0.01)。DSS 饮用的各组间比较,B、C 组之间体质量差异无统计学意义(P>0.05),D 组体质量较B 组下降显著(P<0.01)。见表2。
表2 各组小鼠体质量比较(±s,g)
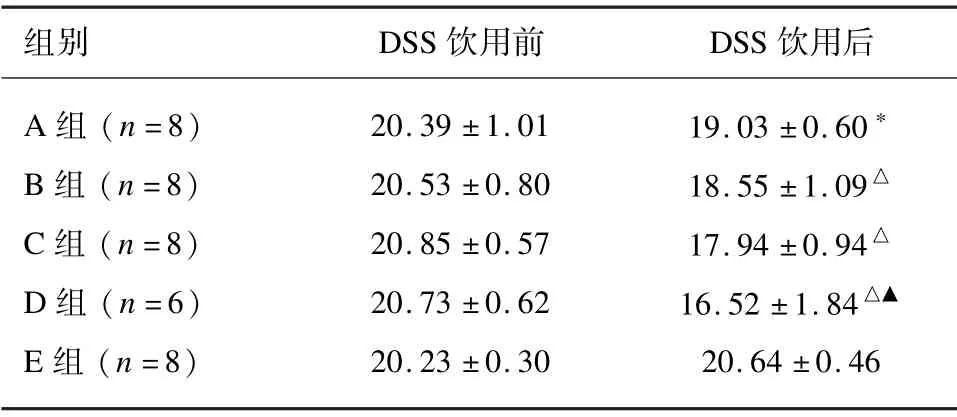
表2 各组小鼠体质量比较(±s,g)
注:与E 组比较,*P <0.05、△P <0.01;与B 组比较,▲P <0.01。
组别 DSS 饮用前 DSS 饮用后A 组(n=8) 20.39 ±1.01 19.03 ±0.60*B 组(n=8) 20.53 ±0.80 18.55 ±1.09△C 组(n=8) 20.85 ±0.57 17.94 ±0.94△D 组(n=6) 20.73 ±0.62 16.52 ±1.84△▲E 组(n=8) 20.23 ±0.30 20.64 ±0.46
2.3 各组小鼠DAI 评分比较
各组小鼠自造模之日起到取材日,每日行DAI 评分。第8 天,与对照组相比,DSS 饮用的各组DAI 评分均显著升高(P<0.01)。DSS 饮用的各组间比较,B、C 组之间DAI 评分差异无统计学意义(P>0.05),D 组DAI 评分较B 组升高(P<0.05),B 组DAI 评分较A 组显著升高(P<0.01)。见表3。
表3 各组小鼠DAI 评分比较(±s,分)
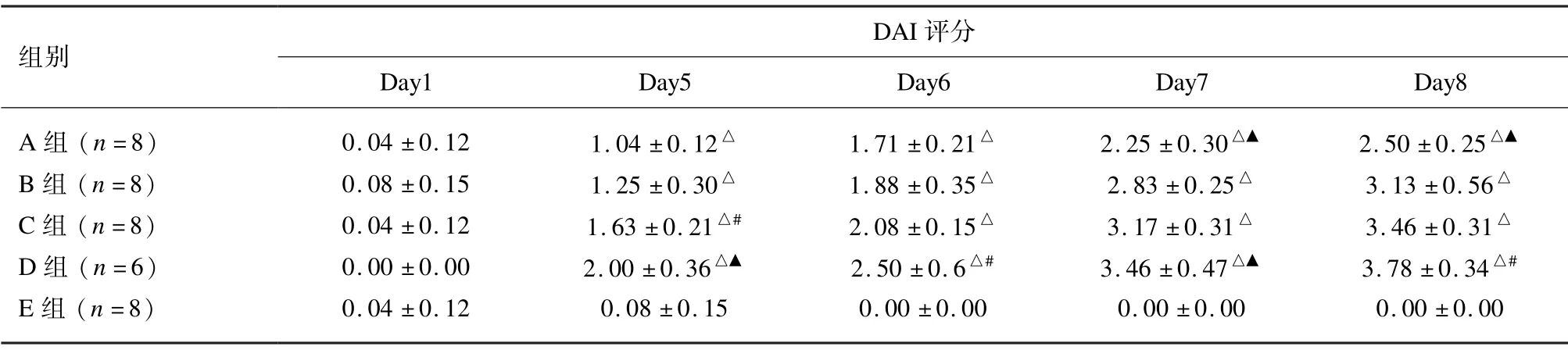
表3 各组小鼠DAI 评分比较(±s,分)
注:与E 组比较,△P <0.01,与B 组比较,#P <0.05,▲P <0.01。
组别DAI 评分Day1 Day5 Day6 Day7 Day8 A 组(n=8) 0.04 ±0.12 1.04 ±0.12△ 1.71 ±0.21△ 2.25 ±0.30△▲ 2.50 ±0.25△▲B 组(n=8) 0.08 ±0.15 1.25 ±0.30△ 1.88 ±0.35△ 2.83 ±0.25△ 3.13 ±0.56△C 组(n=8) 0.04 ±0.12 1.63 ±0.21△# 2.08 ±0.15△ 3.17 ±0.31△ 3.46 ±0.31△D 组(n=6) 0.00 ±0.00 2.00 ±0.36△▲ 2.50 ±0.6△# 3.46 ±0.47△▲ 3.78 ±0.34△#E 组(n=8) 0.04 ±0.12 0.08 ±0.15 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00
2.4 各组小鼠结直肠长度比较
与对照组相比,DSS 饮用的各组结直肠长度均显著缩短(P<0.01)。DSS 饮用的各组间比较,B 组小鼠结直肠长度较A 组缩短明显(P<0.05),B 组与C、D 组小鼠结直肠长度差异均无统计学意义(P>0.05)。见表4。
2.5 各组小鼠血清IL-6 水平比较
与对照组比较,DSS 饮用的各组小鼠血清白介素6(Interleukin-6,IL-6)水平均显著升高(P<0.01)。DSS 饮用的各组间比较,B 组小鼠血清IL-6 水平显著高于A 组(P<0.01),C 组小鼠血清IL-6 水平明显高于B 组(P<0.05),D 组小鼠血清IL-6 水平显著高于B 组(P<0.01)。小鼠血清IL-6 水平与DSS 浓度呈正相关。
2.6 各组小鼠肠道病理学指标值变化情况
2.6.1 结直肠组织大体肉眼观 正常对照组小鼠结直肠黏膜呈淡红色,光滑完整,皱襞清晰,无出血点。肠道外壁周围可见少量肠系膜及脂肪组织包绕,无明显异常改变;DSS 饮用的各组小鼠肠道长度可见明显缩短,肠壁增厚,黏膜呈不同程度的充血、水肿,散在出血点,甚至可见溃疡形成,结肠组织粘连明显。
2.6.2 各组结直肠组织病理学改变 光镜下见:正常组小鼠结直肠黏膜上皮结构清晰,排列整齐、紧密,隐窝结构正常,以杯状细胞为主,偶见炎细胞浸润。DSS 饮用的各组小鼠结直肠黏膜均出现不同程度的病变,且随着浓度增高而逐渐加重。A 组小鼠结肠组织黏膜上皮结构排列欠整齐,隐窝结构拉长,黏膜下层可见炎性细胞浸润。B、C 和D 组小鼠均出现黏膜上皮不同程度的缺损,部分腺体及隐窝结构变形破坏、丢失,可见不同程度的肉芽肿,黏膜及黏膜下层有大量炎性细胞浸润。见图1。
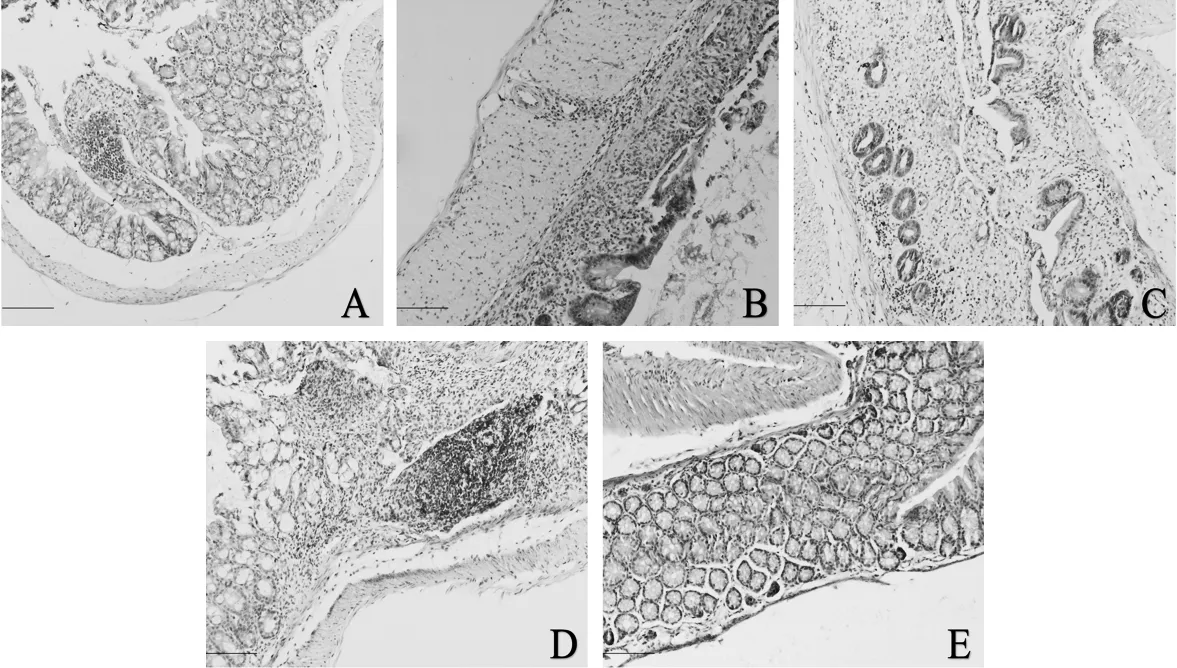
图1 各组小鼠肠道组织病理学改变(HE×200)
2.6.3 肠道组织病理学评分比较 与对照组相比,DSS 饮用的各组小鼠的结肠组织病理学评分均显著升高(P<0.01)。A 组小鼠的结肠组织黏膜上皮基本完整,可见部分腺体及隐窝结构变形破坏,黏膜下层可见较多炎性细胞浸润。DSS 饮用的各组间比较,B、C 组肠道组织病理学评分差异无统计学意义(P>0.05),B 组肠道组织病理学评分显著高于A组,D 组肠道组织病理学评分显著高于B 组(P<0.01)。见表4。

表4 各组小鼠结直肠长度、血清IL-6 水平和肠道组织病理学评分比较
3 讨论
IBD 由遗传、环境、免疫、肠屏障功能和肠道微生物等多种因素共同作用所致[6-7]。动物模型的合理运用,在探索IBD 的发病机制及筛选临床用药中都具有重大意义。以化学方式诱导的小鼠结肠炎模型是研究IBD 最主要的造模方法,常用的诱导药物有2,4,6-三硝基苯磺酸、DSS、噁唑酮、乙酸和碘乙酰胺等,其各有特点[8]。其中,动物口服DSS 诱导,由于其造模形成的炎症程度主要与给药浓度有关,而与动物摄入量关系不大[9],在造模过程中相对容易控制,可行性较强,被广泛应用。其诱导的结肠炎的原理是通过硫酸基团造成高负电荷破坏肠屏障的完整性,使结肠上皮通透性增加,导致炎症[10]。此外,DSS 的抗凝血性能加重肠道出血;该模型的病变局限于大肠,尤其是远端结肠,这与UC 相似[11]。该模型是研究肠道环境,评估预防和改善疾病的干预措施以及药物筛选的有力工具;为研究宿主遗传、肠道先天免疫、微生物、饮食和其他环境因素之间的相互作用与机制提供支持。但各小鼠对水的吸收不一致,导致小鼠不一致地暴露在不同的DSS 浓度中。
IL-6 是一种多效型细胞因子[12],可以调节多种细胞的生长与分化,参与调节免疫应答,在机体的抗感染免疫反应中发挥重要作用[13]。临床研究发现,IBD患者体内IL-6 水平明显升高,炎症部位的IL-6 水平也明显升高[14],通过循证医学研究进一步明确了IL-6 与炎症的关系[15]。IL-6 主要调节肠道肿瘤细胞及血管内皮因子,促进其增殖,其结合可溶性IL-6 受体(soluble interleukin-6 receptor,sIL-6R) 形成IL-6/SIL-6R复合物,继而活化细胞膜表面的gpl30,诱导STAT3 转录因子活化促进炎症进展[16]。因此可以选用IL-6 作为衡量IBD 发病及进展的重要指标。
本实验通过小鼠饮用不同浓度的DSS 后,观察其一般情况和结直肠病理学改变,记录结直肠长度及体质量变化,进行DAI 评分和肠道组织病理学评分,采用ELISA 检测血清IL-6 水平,为模拟IBD 提供了详细的小鼠动物造模参考。结果表明,不同浓度的DSS 饮用后,各组小鼠体质量明显下降,呈不同程度的蜷缩不喜动、进食量下降和体毛晦暗无光泽等,整体状态相对较差。与对照组相比,DSS 饮用的各组小鼠体质量下降,结直肠长度缩短,DAI 评分和肠道组织病理学评分均升高,血清IL-6 水平上升且与DSS 浓度呈正相关。2.5%、3.0%、3.5% DSS 组表现更为显著,其中3.5% DSS 组小鼠虽然体质量下降、血清IL-6 水平及肠道病理变化最为明显,但相对死亡率较高,此浓度不适宜用于诱导造模。2.5%DSS 组和3.0%DSS 组小鼠出现体质量下降,血清IL-6 水平升高,结直肠病理学改变及病理学评分均明显升高,且病理学改变更加均衡,肠道病理学改变与IBD 临床病理学改变较为贴近,可被认为是适宜本研究的IBD 造模方法。出于经济成本考虑,建议针对雌性C57 小鼠,2.5%浓度的DSS 是诱导IBD 模型的较佳选择。
