缺血性肠病并门静脉积气二例
2022-04-05王志蕊郑海陈锦皇姚天赐何依明
王志蕊 郑海 陈锦皇 姚天赐 何依明
例1,病人,女,75岁,2021年3月9日无明显诱因突发下腹痛半天入院,伴腹胀,肛门有排气,无其他不适,症状加重致全腹痛,伴腹胀明显,恶心、呕吐,呕吐白色黏液样物质,大便稀,无畏寒发热。既往有高血压、冠心病(未行特殊治疗)、2型糖尿病、右髋关节置换术等病史,平时血压、血糖控制可。体格检查:T 36.6 ℃,BP 112/78 mmHg,HR 72次/分钟,R 20次/分钟,SPO298%,心律齐,双肺呼吸音清,未闻及干湿性啰音,急性痛苦面容,腹部稍膨隆,肠鸣音正常,无气过水声,全腹肌紧张、压痛及反跳痛。血常规:白细胞6.70×109/L,中性粒细胞0.92。血生化:钙1.89 mmol/L,钾3.91 mmol/L,钠136.5 mmol/L,尿素氮10.1 mmol/L,肌酐65.7 μmol/L,总二氧化碳20.6 mmol/L,凝血功能:纤维蛋白原7.86 g/L,D-二聚体4.74 mg/L FEU;血脂肪酶<4 U/L,血淀粉酶23 U/L。影像学检查:腹部CT提示右腹部小肠系膜混浊,小肠系膜缘见梳齿征,肠壁多发积气,并门静脉属支、肝内门静脉积气(hepatic portal venous gas,HPVG),提示小肠缺血坏死;小肠扩张,较宽处2.6 cm,不全梗阻可能;腹盆腔可见积液,未见明显游离气体;全主动脉CTA提示主动脉粥样硬化改变,可见多发非钙化斑块、钙化斑块及小溃疡;左颈总动脉起始部轻度狭窄,双侧肾动脉及肠系膜上动脉起始部轻度狭窄(图1a),肠系膜上、下动脉分支形态可,主要分支未见显著狭窄或闭塞;双侧髂内动脉多发狭窄,以右侧为著。术前诊断:肠坏死。急诊剖腹探查发现,腹腔内大量黄色积液,小肠坏死约70 cm,远端距回盲部1 m,切除病变肠管,行小肠造口,残端封闭,丝线闭合破裂小肠系膜(图1b)。术后2天排气、排便,4天开始肠内营养乳剂,术后当天予以低分子量肝素钠注射液5 000 IU皮下注射,1天后予以阿加曲班20 mg+生理盐水10 ml,以2 ml/h速度微量泵入,术后4~9天予以依诺肝素钠注射液皮下注射。术后病理:镜下肠壁各层结构存在,肠黏膜变性坏死,肠壁全层水肿伴急慢性炎症细胞浸润,符合小肠坏死改变。予以抗凝、抗感染、护胃、营养支持等治疗,术后第7天复查腹部CT,提示腹腔内肠管未见明显梗阻征象,门静脉系统未见明显积气(图1c)。于术后第12天出院。术后3个月随访,无恶心、呕吐、腹痛等消化道症状,小肠造口通畅,排泄物正常。
例2,男,49岁。2021年3月15日因上腹部胀痛不适半个月,呃逆伴呕血1天余入院,呕吐物为咖啡样物质,伴烧心、发热、头晕,大便未解。既往有肠系膜下动脉血管瘤,未行特殊治疗。体格检查:T 36.5 ℃,BP 100/54 mmHg,HR 90次/分钟,R 18次/分钟,SPO2100%,急性病容,肠鸣音正常,无气过水声,全腹紧张,上腹部见压痛、反跳痛。实验室检查:血常规白细胞11.38×109/L,中性粒细胞88.7%,超敏C反应蛋白13.25 mg/L。血生化:尿素氮16.7 mmol/L,肌酐93.1 μmol/L,总二氧化碳24.1 mmol/L,凝血功能:D-二聚体2.34 mg/L FEU。
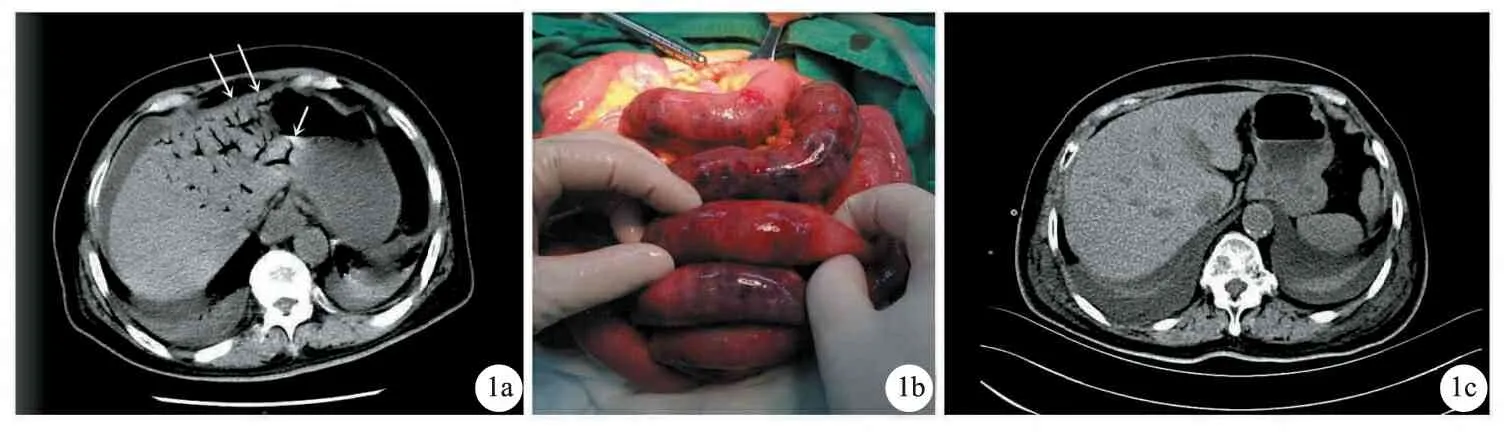
a.图中箭头示HPVG征;b.图示坏死肠道组织;c.对比积气较前消失
影像学检查:腹部CT检查,提示食管下段、胃壁、十二指肠水平部及升部管壁明显水肿增厚,胃及十二指肠壁黏膜下见多发积气,另见肝内沿Glisson鞘分布气体影,怀疑胃及十二指肠肠壁积气进入门静脉系统(图2a、b、c)。腹主动脉CTA检查,提示腹腔干起始段明显变扁、狭窄,多为正中弓状韧带压迫所致。诊断为消化道出血,由于未提示有肠坏死征象,予以保守治疗,禁食水6天。在入院第4天复查腹部CT检查,提示食管下段、胃壁水肿增厚,较前减轻,胃壁黏膜下积气较前减少(图2d、e)。7天后好转出院。出院后3个月,未再有消化道症状,门诊胃肠镜检查无异常。
讨论HPVG通常是伴随消化道疾病而出现的一种征象,由Wolfe等[1]于1955年在婴儿坏死性肠炎中首次报道,国内多是个案报道[2]。
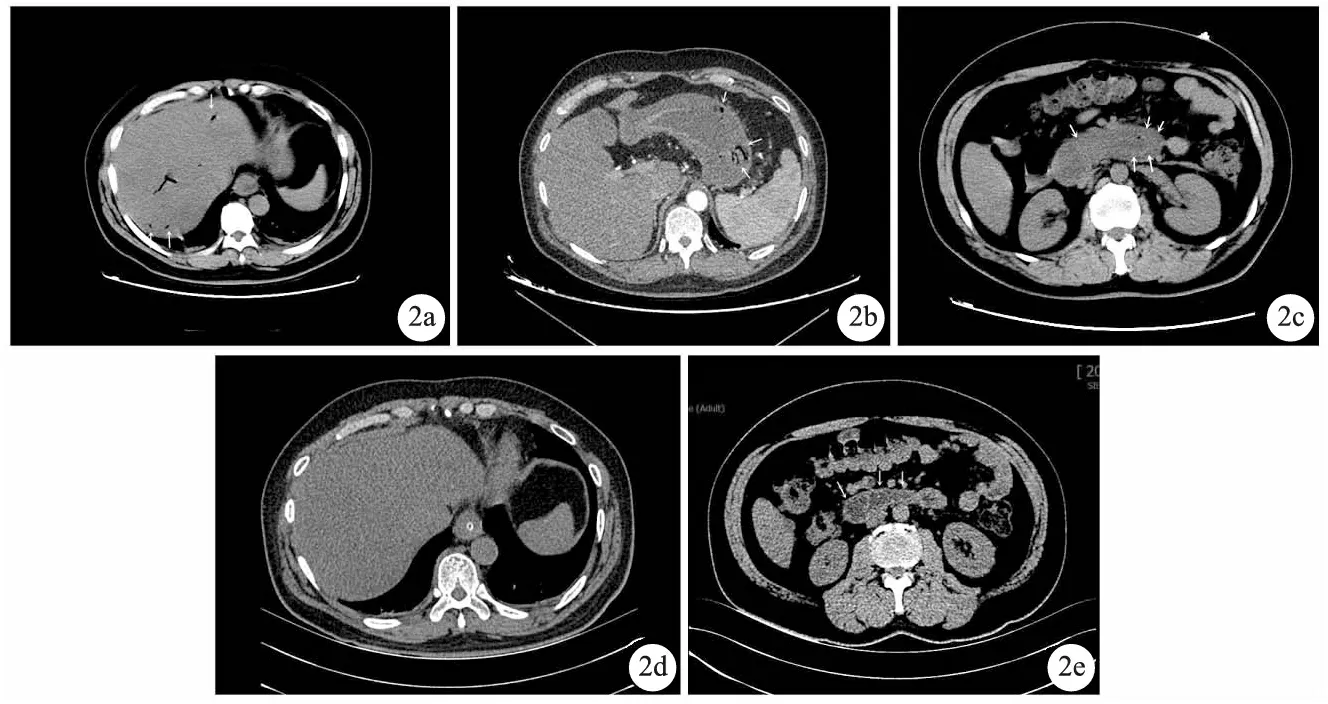
a.箭头示HPVG(肝包膜下2 cm内);b.箭头示胃壁积气;c.箭头示十二指肠水平部水肿增厚;d.对比前片,积气减少;e.图中箭头示十二指肠壁水肿增厚较前减轻图2 例2腹部CT
近年来随着CT以及彩色多普勒的应用,提高了HPVG检出率,同时也发现了一些非急症疾病所导致的HPVG。在此,需要与肝内胆管积气相鉴别,HPVG在CT上表现为肝包膜下2 cm以内的分支透亮影,这是由于门静脉血流的离心性流动,将门静脉中的气体带向了外周边缘。相应地,由于胆管的解剖走形及其内胆汁的向心流动,肝内胆管积气大多聚集在肝门中心地带[3]。
形成HPVG的病因尚不十分明确,主要有以下2种假说:(1)肠腔或脓肿里的产气细菌产生的气体通过肠系膜血管迁移至肝脏;(2)黏膜受损、机械性原因导致肠腔压力过高,产气细菌直接侵入血管[3]。肠坏死是最危重的合并症,通常需要急诊手术,当与非缺血性疾病相关时,HPVG并不提示不良预后。
病例1,年龄>60岁,合并慢性疾病,免疫力低下,导致肠道菌群易位。临床体征上有腹膜炎征象,CT检查提示有肠缺血坏死,因此我们实行了急诊手术治疗。病人全身多处血管粥样硬化斑形成、血管狭窄及闭塞、冠心病,提示此次肠坏死是由于动脉粥样硬化引起的肠系膜上动脉血栓形成。病例2,虽然CT也提示有HPVG合并肠壁积气,但病人年轻,无慢性基础病,总二氧化碳>20 mmol/L,D-二聚体2.34 mg/L FEU,考虑为缺血性肠病肠道黏膜损伤引起的消化道出血,未提示有肠坏死及动力性肠梗阻征象,决定保守治疗[4]。2例均好转出院。目前较少有报道保守治疗好转的案例,当合并缺血性肠病时,多主张手术探查,保守治疗的死亡风险高。
HPVG是否需要急诊手术治疗取决于体格检查、生命体征及实验室检查,CT影像学上HPVG的发现提示肠坏死缺血并不可靠。有回顾性分析表明,急诊手术中也存在未发生透壁性肠坏死并未肠切除的情况,导致不必要的开腹手术[5]。针对HPVG的单一治疗方案难以统一,需根据病人状况个体化治疗。
HPVG并非急诊手术探查的指征,是否急诊手术取决于原发病及其进展程度,当出现肠缺血坏死、肠梗阻时需行手术探查。原发病治疗好转,HPVG随之消失。
