中心型肥胖对腹腔镜远端胃癌D2根治术临床疗效的影响
2022-04-05沈荐李敏哲杜燕夫
沈荐 李敏哲 杜燕夫
胃癌的发病率连年增长,给全球公共卫生体系带来了巨大的冲击[1]。目前,手术切除仍是治疗非转移性胃癌的标准方案[2]。随着微创技术的发展,腹腔镜远端胃癌D2根治手术的临床疗效已经不劣于传统的开腹手术[3]。肥胖是妨碍腹腔镜手术顺利完成的的重要因素[4-5],本研究收集行腹腔镜远端胃癌D2根治术病人的临床及病理资料,评估中心型肥胖对腹腔镜手术疗效的影响。
对象与方法
一、对象
2013年4月~2021年1月间,于首都医科大学附属北京朝阳医院完成的腹腔镜远端胃癌D2根治手术的病人。纳入标准:(1)年龄≥20岁;(2)肿瘤位于胃下1/3;(3)病理为腺癌;(4)行腹腔镜远端胃癌D2根治术。排除标准:美国麻醉师协会(American Society of Anesthesiologists,ASA)麻醉危险度评分Ⅳ、Ⅴ级;残胃癌及胃癌复发;因胃穿孔行急诊手术治疗;胃癌远处转移;胃癌侵犯邻近器官,联合脏器切除;腹腔内广泛粘连;术后病理淋巴结检出少于15枚;术后病理分期为TisN0M0;围手术期化疗方案非SOX方案(替吉奥联合奥沙利铂)及未行规范化疗。按以上标准共收集168例病例,依据卫健委颁布的《中国成年人超重和肥胖症预防控制指南》[6],选择男性腰围≥85 cm、女性腰围≥80 cm为中心型肥胖进行分组。肥胖组共64例;非肥胖组共104例。本研究方案通过首都医科大学附属北京朝阳医院伦理委员会审批,伦理批号:2021-科-278。所有病人均知情同意,并签署相关协议。
二、方法
1.手术方法:由同一组医生团队实施腹腔镜远端胃癌D2根治术。病人平卧分腿,采用五孔法置入Trocar,术者站于病人左侧,助手站于病人右侧,扶镜手站于病人两腿间;按中华医学会外科学分会制订的《腹腔镜胃癌手术操作指南(2016版)》进行手术[7],廓清第1、3、4sb、4d、5、6、7、8a、9、11p、12a组淋巴结;以腔镜下切割闭合器于幽门远端3 cm切断十二指肠球部;取上腹部正中辅助小切口,距肿瘤近端5cm离断胃,取出标本;采用Roux-en-Y方式重建消化道。
术前曾行SOX方案新辅助化疗者,术后继续原方案化疗,围手术期共8疗程;术前未行新辅助化疗者,除ⅠA期外,术后予SOX方案化疗8疗程。
2.观察指标:手术相关指标,包括手术时间、术中出血量、术后胃肠功能恢复时间及术后住院时间;术后并发症发生情况,诊断及分级依据Clavien-Dindo评分系统[8];术后病理指标,包括淋巴结清扫数、淋巴结转移率、阳性淋巴结数及术后pTNM分期;预后生存指标。
3.术后随访:两组病人出院后门诊随访至术后5年,术后未满5年者,随访至2021年4月(3~60个月)。随访时间为术后1个月第一次;术后1年内,每3个月一次;术后1~5年,每6个月一次。随访内容包括病史和体格检查,血常规、肝肾功能和肿瘤标志物,胸、腹影像学检查,胃镜。
三、统计学方法
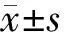
结果
1.匹配前后两组基础资料比较见表1。匹配前肥胖组64例与非肥胖组104例基础资料(除BMI及腰围)比较,年龄和ASA评分差异有统计学意义(P<0.05)。1∶1匹配后,肥胖组与非肥胖组各有61例病例匹配成功,两组基础资料比较(除BMI及腰围),差异无统计学意义(P>0.05)。
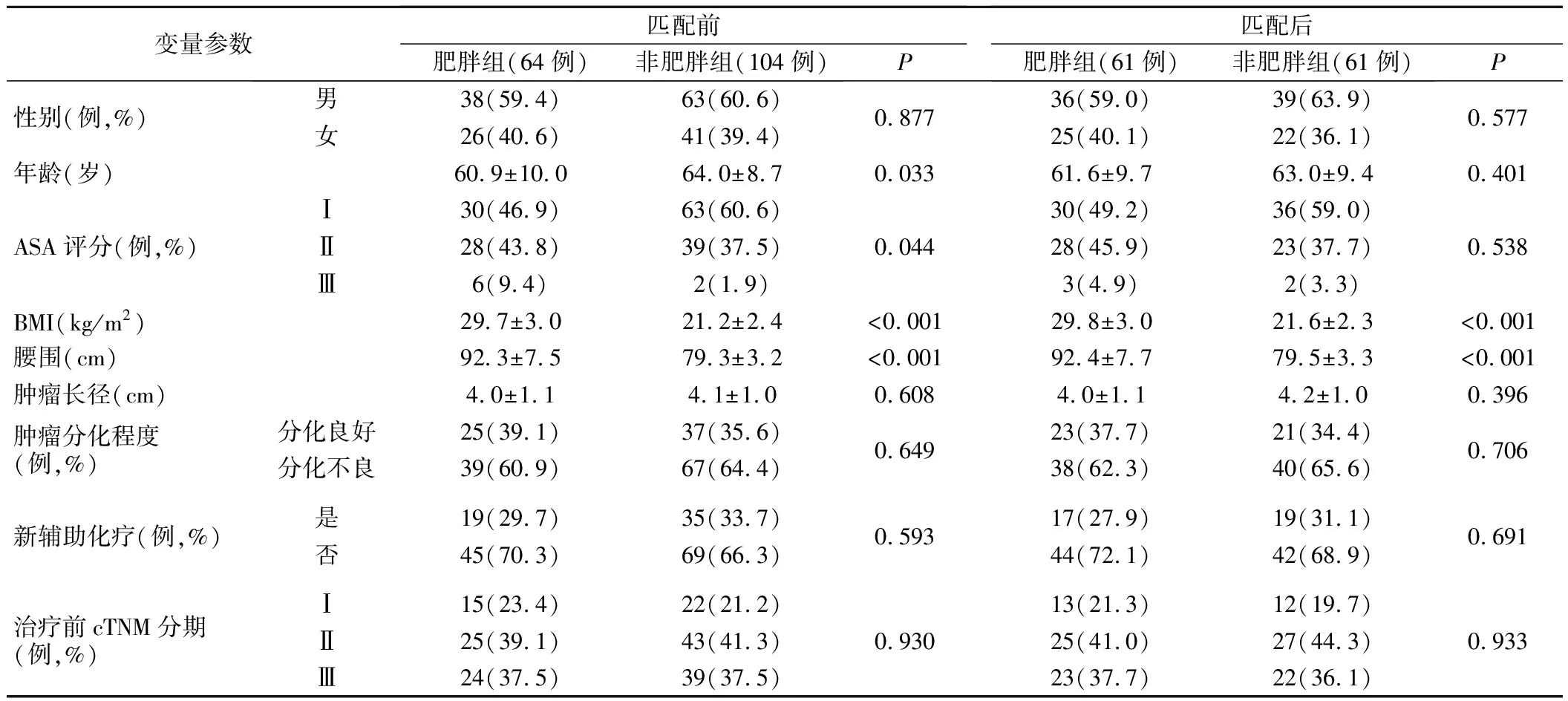
表1 匹配前后两组病人基础资料比较
2.两组手术相关指标比较见表2。肥胖组手术时间、术中出血量及术后住院时间均长于多于非肥胖组,差异有统计学意义(P<0.05);两组术后胃肠功能恢复时间差异无统计学意义(P>0.05)。
表2 两组病人手术相关指标比较
3.两组术后并发症指标比较见表3。肥胖组术后共有15例病人出现22例次并发症,非肥胖组术后共有13例病人出现18例次并发症,差异无统计学意义(χ2=0.185,P=0.667)。
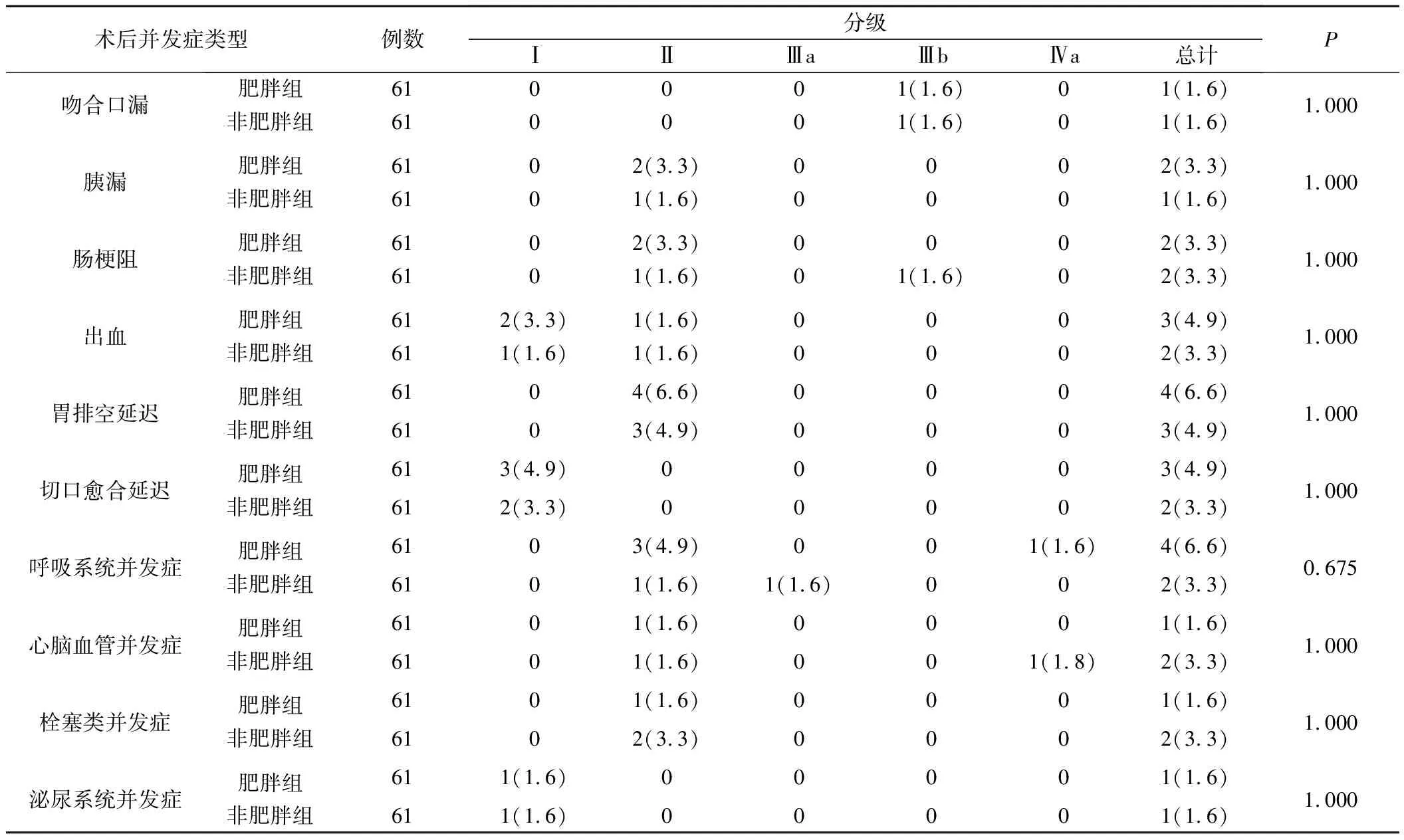
表3 两组病人术后并发症比较(例,%)
4.两组术后病理指标比较见表4。两组淋巴结清扫数、淋巴结转移率、阳性淋巴结数及术后pTNM分期差异无统计学意义(P>0.05)。

表4 两组病人术后病理指标比较
5.两组预后生存指标比较:肥胖组术后有16例因肿瘤复发及转移死亡,非肥胖组术后有14例因肿瘤复发及转移死亡,两组总体生存期差异无统计学意义(Log-rank χ2=0.074,P=0.786)。见图1。

图1 两组病人术后总生存期比较
讨论
腹腔镜手术通过其视觉放大效应,能更好地暴露手术视野,进行更为精细的操作,较之开放手术有一定优势。经历三十余年的发展,腹腔镜技术在胃肠疾病治疗领域取得了长足进步,已广泛应用于各类手术中[10-11]。关于腹腔镜胃癌手术的报道最早源于1994年,Kitano等[12]为早期胃癌病人实施了腹腔镜远端胃大部切除术,由此拉开了腹腔镜手术治疗胃部肿瘤的序幕。近年来,随着腹腔镜相关仪器设备的不断更新,以及腹腔镜手术技巧的发展与完善,越来越多的外科医生在努力尝试进行腹腔镜胃癌手术的临床实践。
近年来,随着人们饮食结构的改变,肥胖已成为全球性问题。在发达国家及发展中国家,肥胖都很普遍,而且无论儿童还是成人,男性还是女性,肥胖率都有所增加[17]。肥胖是是2型糖尿病、血脂异常、高血压、脂肪肝和心血管疾病等的危险因素[14],并与癌症发病率和死亡率的增加有关[15]。据估计,在全世界30岁以上的成年人中,3.6%的新诊断癌症病例可归因于高BMI[16]。
BMI是最常用的界定肥胖与否的标准,但其仅能反映机体脂肪蓄积的程度,不能明确脂肪在身体内的分布状况;较之BMI,以腰围为指标的中心型肥胖更能有效反映腹部脂肪堆积情况[17]。中心型肥胖病人腹腔内脂肪组织过度填充,空间狭小,会增大腹部手术的操作难度,尤其对腹腔镜手术影响更大[4-5,8]。在本研究中,中心型肥胖的胃癌病人占38.1%(64/168),由于肥胖组与非肥胖组病人基线资料存在不均衡性,故通过倾向性评分匹配,较大程度消除了相关混杂因素对结果的影响。匹配后进行分析,肥胖组的手术时间及术中出血量明显长于大于非肥胖组。肥胖病人本身会合并代谢综合征[18],对手术的应激反应能力较差,再叠加过度的手术创伤,使得肥胖组病人术后恢复更慢,术后住院时间明显长于非肥胖组;但两组术后并发症的发生率无显著差异。术后病理结果显示,肥胖组病人并没有因为手术操作难度的增加而减少胃周淋巴结的清扫数目。术后随访,肥胖组病人总体生存期也与非肥胖组无显著差异。
综上所述,中心型肥胖增加了腹腔镜远端胃癌D2根治术的操作难度,较之非肥胖病人,中心型肥胖病人术后恢复更慢,但预后并不受影响。本研究存在一定的局限性,仅为单中心、小样本、回顾性研究,研究结果将为后续进一步开展多中心、大样本、前瞻性研究奠定前期理论基础。
