Vitek MS快速检测产碳青霉烯酶肠杆菌目细菌的效果评估
2022-03-30刘璐温海楠李婧王惠谢守军梁悦怡刘焱超孙启玉承德医学院附属医院检验科河北承德067000
刘璐,温海楠,李婧,王惠,谢守军,梁悦怡,刘焱超,孙启玉(承德医学院附属医院检验科,河北承德 067000)
碳青霉烯类耐药肠杆菌目细菌(carbapenem-resistant Enterobacterales,CRE)检出率不断上升,已成为当前公共健康领域严峻的挑战之一。CRE主要的耐药机制是产碳青霉烯酶,产碳青霉烯酶也是引起CRE流行和暴发的主要机制[1]。同时,产碳青霉烯酶的CRE(carbapenemase producing carbapenem-resistant Enterobacterales,CP-CRE)感染患者的病死率比非产碳青霉烯酶CRE(non-carbapenemase producing carbapenem-resistant Enterobacterales,non-CP-CRE)感染患者的病死率高[2],两类患者用药也明显不同[3]。因此,快速精准地检测出占主导地位的CP-CRE,对临床用药及治疗至关重要。近年来,基质辅助激光解吸电离飞行时间质谱( matrix-assisted laser desorption /ionization time-of-flight mass spectrometry,MALDI-TOF MS)广泛用于临床微生物实验室,其通过分析细菌核糖体蛋白能够快速、准确、低成本地鉴定细菌[4]。而其在细菌耐药性检测中的应用尚在研究中[5],如何使用质谱检测CRE是一个新的挑战。目前研究者们正深入探索如何将MALDI-TOF MS快速、准确的鉴定能力应用于检测碳青霉烯酶[4]。本研究拟通过亚胺培南与待测菌株共孵育,利用Vitek 质谱(Vitek mass spectrometry,Vitek MS)仪分析亚胺培南及其水解产物的变化,建立一种快速检测CP-CRE的方法,并用前瞻性研究验证此方法检测效果。
1 材料与方法
1.1材料
1.1.1菌株来源 收集承德医学院附属医院2018年12月至2020年10月临床微生物室分离的52株非重复CRE菌株和36株碳青霉烯类敏感肠杆菌目细菌(CSE),共88株;收集同期承德市中心医院分离的40株非重复CRE菌株。阳性对照菌株3株,分别为blaKPC-2基因阳性的肺炎克雷伯菌、blaKPC-2和blaNDM基因阳性的大肠埃希菌、blaNDM基因阳性的大肠埃希菌,均为上海抗生素研究所赠送,并经PCR测序验证;阴性对照菌株2株,分别为大肠埃希菌 ATCC 8739、大肠埃希菌ATCC 25922,购于美国菌种保藏中心。
将承德医学院附属医院88株试验菌株和承德市中心医院40株试验菌株分为2组:A组包括承德医学院附属医院CRE菌株1~52号、CSE菌株K1~K20号和E1~E10号,共82株,用于建立基于酶水解法的Vitek MS检测CP-CRE的方法;B组包括承德市中心医院CRE菌株53~92号和我院CSE菌株K21~K23号、E11~E13号,共46株,用于前瞻性研究验证上述方法的检测效果。
1.1.2主要试剂与仪器 亚胺培南和美罗培南药敏纸片(英国Oxoid公司),2×Taq PCR Master mix(北京天根公司),Vitek MS CHCA Matrix(法国Biomerieux公司);注射用亚胺培南-西司他丁钠(美国Merck Sharp&Dohme公司),亚胺培南标准品(北京索莱宝公司)。Vitek 2.0全自动微生物鉴定及药敏分析系统、Vitek MS基质辅助激光解吸电离飞行时间质谱仪(法国Biomerieux公司),DNA Engine Peltier热循环仪(美国MJ Research公司),细胞电泳仪(北京六一仪器厂),紫外凝胶透射仪(北京市新技术应用研究所)。
1.1.3引物序列 碳青霉烯酶基因blaKPC、blaNDM、blaVIM、blaIMP和blaOXA-48引物序列参考文献[6],见表1。引物由上海生工生物公司合成。

表1 碳青霉烯酶基因检测引物及其产物大小
1.2方法
1.2.1菌株复苏及药敏复核 将保存于-80 ℃的试验菌株取出,置室温下恢复15 min后接种于血平板,35 ℃温育过夜。取复苏后的新鲜单菌落,用纸片扩散法复核亚胺培南和美罗培南的药敏结果,抑菌圈的判读标准参照2021年CLSI M100-S31文件。
1.2.2Vitek MS鉴定 以大肠埃希菌ATCC 8739作为质控菌株,通过Vitek MS对试验菌株进行鉴定。鉴定操作参考Vitek MS标准操作规程。
1.2.3碳青霉烯酶基因检测 采用PCR方法对A组和B组菌株进行blaKPC、blaVIM、blaIMP、blaNDM和blaOXA-48碳青霉烯酶基因扩增,其中A组先进行PCR基因检测,后进行酶水解试验。B组先进行酶水解试验,后进行PCR基因检测。煮沸法提取试验菌株DNA。PCR反应体系共25 μL:2×Taq PCR Master mix 12.5 μL,10 mmol/L正向引物和反向引物各1 μL,DNA模板1 μL,ddH2O 9.5 μL。blaKPC、blaVIM和blaIMPPCR扩增条件为:94 ℃预变性3 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸10 min。blaNDM和blaOXA-48PCR扩增条件为:94 ℃预变性3 min;94 ℃变性30 s,64 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸10 min。PCR产物经20 g/L琼脂糖凝胶电泳(110 V,45 min)后,于紫外凝胶透射仪下观察结果并记录。
1.2.4基于酶水解法的Vitek MS检测CP-CRE 参考文献[7-11]并通过预实验最终设计酶水解法过程为:取血平板上过夜温育的新鲜单菌落,加4.5 g/L NaCl配制成0.5 McFarland菌悬液,吸取配制好的菌悬液1 mL加入EP管中,12 000×g离心3 min,弃上清液,留菌沉淀备用。将亚胺培南-西司他丁钠粉剂加缓冲液[NH4HCO350 mmol/L,Tris-HCl 20 mmol/L(pH 6.8),4.5 g/L NaCl,pH 7.0]配制成0.5 mg/mL的亚胺培南溶液,取50 μL亚胺培南溶液加入上述菌沉淀中混匀,35 ℃振荡温育,时间分别为5 min、10 min、20 min和30 min。温育结束后立即12 000×g离心3 min。取1 μL上清液加入靶板点位,再加入1 μL基质液混匀,待自然干燥后用Vitek MS的RUO系统进行检测。质谱仪采用正线性离子模式在200~600 m/z的质量范围内记录光谱。Vitek MS RUO系统参数设置如下:离子源20 kV,离子源透镜6 kV,脉冲离子引出时间210 ns,激光频率62 Hz。检测采用手动模式,在一个光谱的5个不同位置上共获取500张图片。采用α-氰基-4-羟基肉桂酸([M+Na]+=212.032 m/z,[2M+H]+=379.093 m/z)和亚胺培南标准品([M+H]+=300.4 m/z)进行校准。质谱图像经过基线校正、去平滑。
设定A组菌株为酶水解法实验组,3株阳性对照菌为阳性对照,2株阴性对照菌为阴性对照,另设不加菌悬液的亚胺培南空白对照。以上每份样本均加样3个点位,亚胺培南水解产物峰强度和亚胺培南峰强度值取平均值,建立检测CP-CRE的筛选标准。
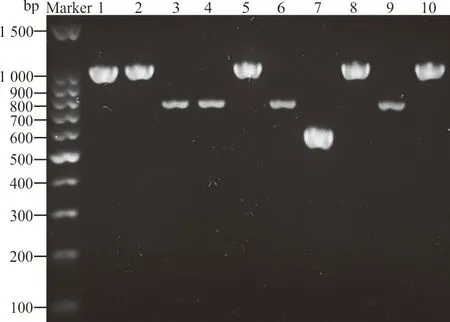
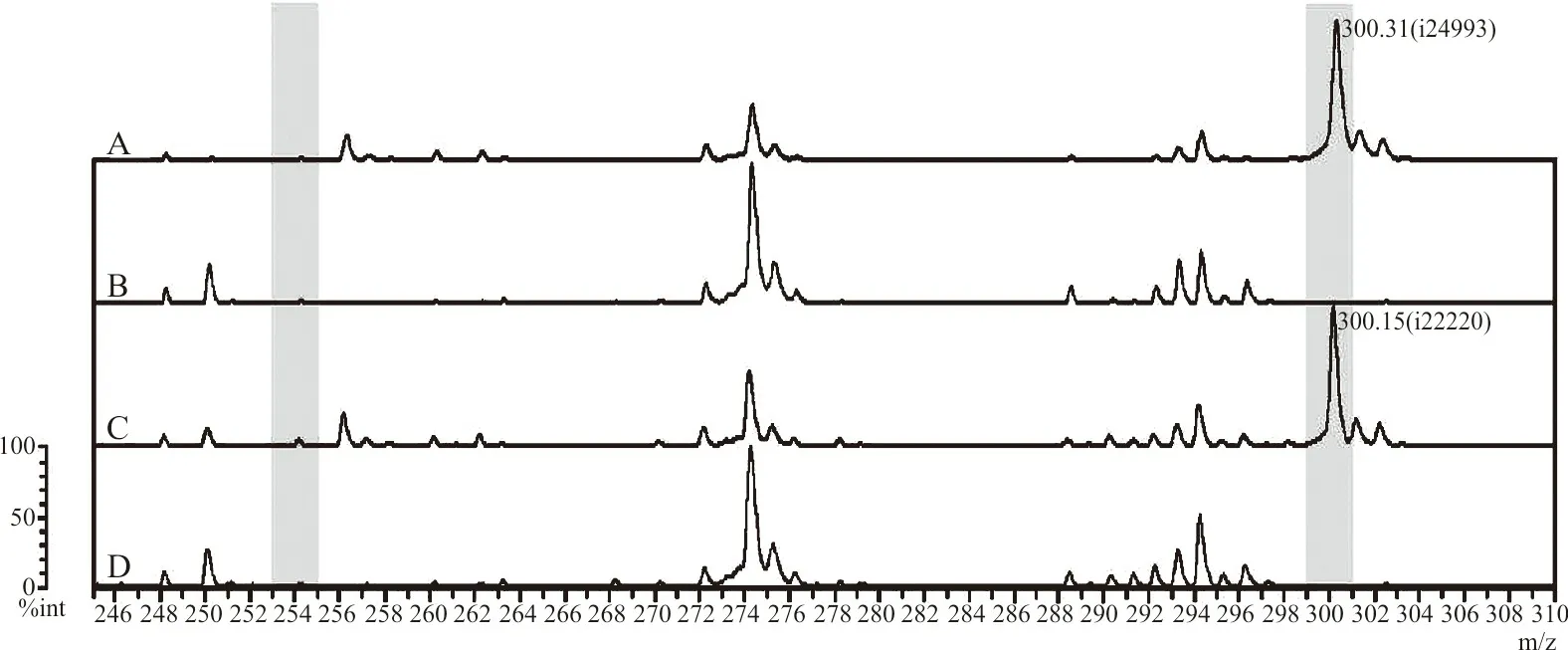
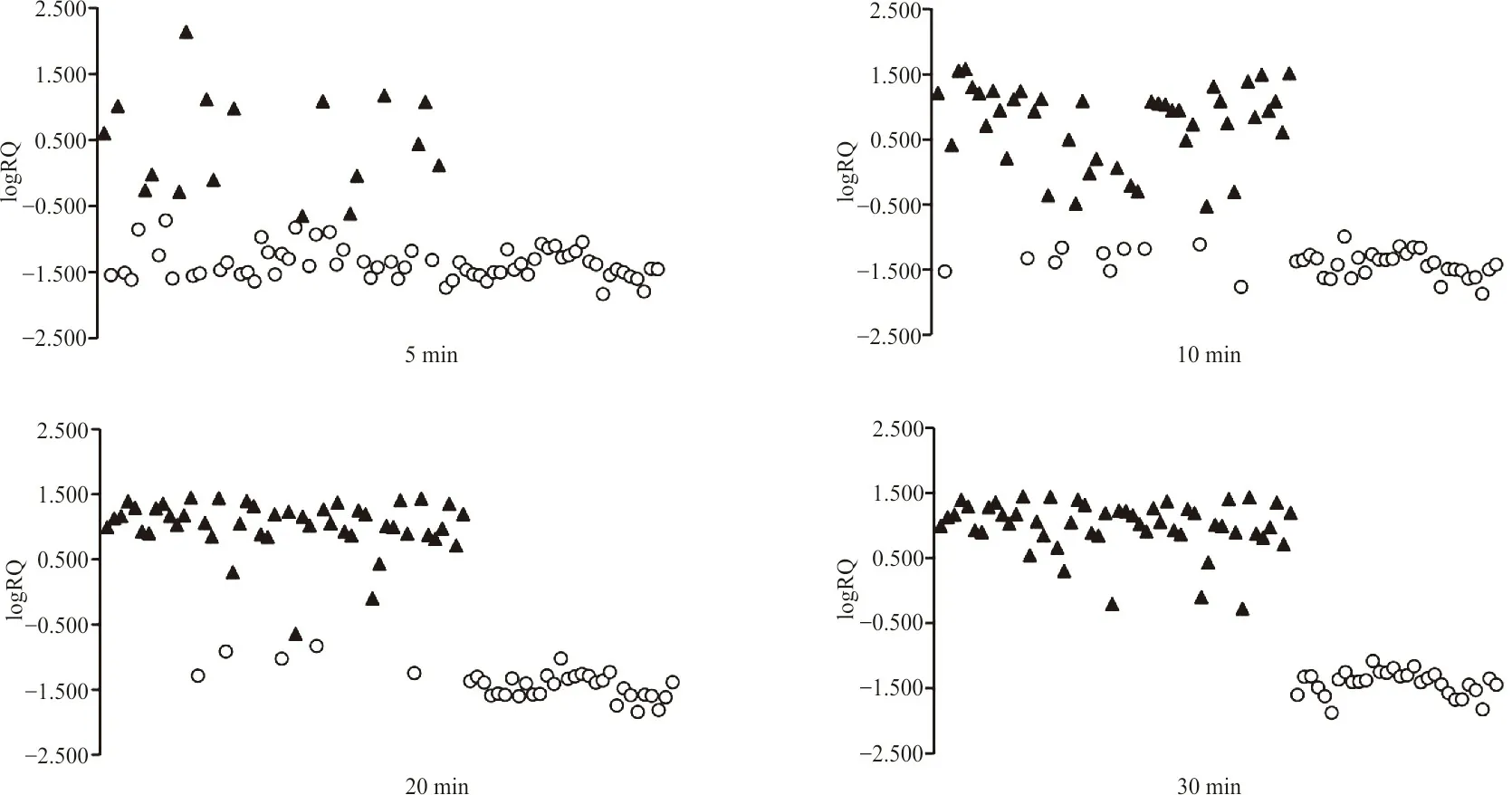
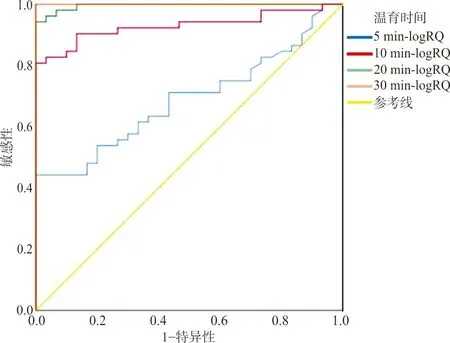
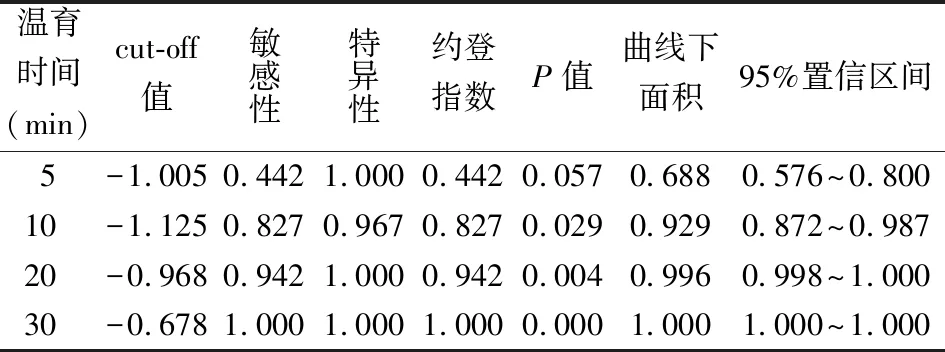
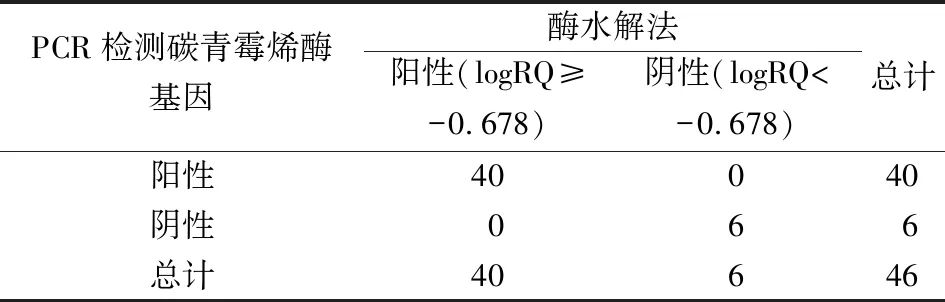
1.2.5LogRQ值的计算和cut-off值的设置 本试验采用logRQ值[7]和cut-off值判断亚胺培南是否被碳青霉烯酶水解。logRQ=log(亚胺培南水解产物峰强度/亚胺培南峰强度)。将PCR检测结果作为金标准,结合logRQ值绘制不同温育时间的受试者工作曲线(ROC曲线),选择曲线下面积(AUC)最大的ROC曲线计算相应的cut-off值作为结果判断标准。若logRQ值≥cut-off值,则水解试验阳性,说明试验菌株产碳青霉烯酶,为CP-CRE菌株;反之,若logRQ值 1.2.6前瞻性研究对酶水解法的验证 选取B组菌株作为前瞻性研究样本。根据单盲原则,采用“1.2.4”中基于酶水解法的Vitek MS检测B组试验菌株,每份样本加样1个点位,并结合“1.2.5”中选择的诊断界值(cut-off值)判断标本是否为CP-CRE菌株。最后采用PCR检测试验菌株的blaKPC、blaVIM、blaIMP、blaNDM和blaOXA-48碳青霉烯酶基因,Vitek MS结果和PCR结果作一致性检验。 2.1Vitek MS鉴定结果和药敏试验结果 Vitek MS鉴定结果显示,承德医学院附属医院52株CRE包括肺炎克雷伯菌37株、大肠埃希菌9株、阴沟肠杆菌阴沟亚种4株、产酸克雷伯菌2株,36株CSE菌株包括23株肺炎克雷伯菌和13株大肠埃希菌;承德市中心医院40株CRE菌株均为肺炎克雷伯菌。药敏复核结果显示,保存的所有CRE菌株均对亚胺培南和(或)美罗培南耐药,CSE菌株均对亚胺培南和美罗培南敏感。 2.2碳青霉烯酶基因检测结果 承德医学院附属医院52株CRE均检测出1种或1种以上的碳青霉烯酶基因,其中单blaKPC阳性32株、blaKPC和blaNDM同时阳性的菌株1株、单blaNDM阳性18株、单blaIMP阳性1株;36株CSE均未检出碳青霉烯酶基因。承德市中心医院40株CRE菌株均检测出1种或1种以上的碳青霉烯酶基因,其中blaKPC阳性39株,blaKPC和blaVIM同时阳性的菌株1株。部分菌株PCR扩增产物的琼脂糖凝胶电泳结果见图1。 注:1~4为阳性对照菌株,5~6为试验菌株。1,肺炎克雷伯菌blaKPC-2阳性(菌株:阳性对照1);2,大肠埃希菌blaKPC-2阳性(菌株:阳性对照2);3,大肠埃希菌blaNDM阳性(菌株:阳性对照2);4,大肠埃希菌blaNDM阳性(菌株:阳性对照3),5,肺炎克雷伯菌blaKPC-2阳性;6,大肠埃希菌blaKPC-2阳性;7,肺炎克雷伯菌blaIMP阳性;8,肺炎克雷伯菌blaKPC-2阳性;9,肺炎克雷伯菌blaNDM阳性;10,肺炎克雷伯菌blaKPC-2阳性。 2.3亚胺培南及其水解产物特征峰 亚胺培南空白对照在(300±0.55)m/z处有此药的特征峰,并伴有微小的亚胺培南水解产物特征峰(254±0.1)m/z;52株CRE经过与亚胺培南共同温育后,均显示亚胺培南特征峰(300±0.55)m/z消失且亚胺培南水解产物特征峰(254±0.1)m/z无明显增长,与3株阳性对照的图谱一致,说明菌株产碳青霉烯酶,为CP-CRE;30株CSE图谱显示在(300±0.55)m/z处的亚胺培南特征峰仍存在,且峰强度无明显改变,同时亚胺培南水解产物特征峰(254±0.1)m/z也未出现明显变化,与阴性对照菌株的图谱一致,说明菌株不产碳青霉烯酶,为non-CP-CRE或CSE。见图2。 注:A,不加菌悬液的亚胺培南空白对照;B,阳性对照菌;C,碳青霉烯酶阴性;D,碳青霉烯酶阳性。图中标灰位置为亚胺培南水解产物[C11H17N3O2S,(254±0.1) m/z]对应的质谱峰和亚胺培南[C12H17N3O4S,(300±0.55) m/z]对应的质谱峰。 2.4LogRQ值的计算和cut-off值的设置 计算82株试验菌株与亚胺培南共温育5 min、10 min、20 min和30 min后的logRQ值,绘制散点图,见图3。绘制不同温育时间logRQ值的ROC曲线,见图4。观察图4可知在温育30 min时,曲线下面积(AUC)最大,为1.000(95%CI:1.000~1.000,P<0.001),相应cut-off值为-0.678,此时检测出CP-CRE菌株52株,其logRQ值为0.996±0.184;non-CP-CRE或CSE 30株,其logRQ值为-1.419±0.187;检测敏感性和特异性最高,均为100%,见表2。在cut-off值为-0.678时判断不同温育时间下亚胺培南的水解情况:logRQ值≥-0.678时亚胺培南已被细菌水解,logRQ值<-0.678时亚胺培南未被细菌水解,见图3,因此可知菌株与亚胺培南经5 min、10 min、20 min和30 min共温育后,细菌水解亚胺培南的敏感性分别为32.69%(17/52)、80.77%(42/52)、90.38%(47/52)、100%(52/52),特异性均为100%。 注:▲,亚胺培南已被细菌水解;○,亚胺培南未被细菌水解;logRQ=log(亚胺培南水解产物峰强度/亚胺培南峰强度)。 图4 利用logRQ值检测CP-CRE的受试者工作特征(ROC)曲线 表2 不同孵育时间logRQ值的受试者工作特征(ROC)曲线统计学分析 2.5前瞻性研究结果 使用已建立的基于酶水解法的Vitek MS对B组菌株进行检测,结果显示46株细菌中有40株细菌其logRQ值>-0.678,为CP-CRE;6株细菌其logRQ值<-0.678,为non-CP-CRE或CSE。与PCR检测结果相比,Kappa系数为1.0,差异有统计学意义(P<0.05),说明2种方式检测一致性极强,2种检测方式的符合率为100%。见表3。 表3 酶水解法与PCR检测结果比较 目前,MALDI-TOF MS技术广泛应用于细菌鉴定,而利用MALDI-TOF MS技术检测CRE尚在探索阶段。2011年,Hrabák等[12]发现利用MALDI-TOF MS技术与酶水解法结合可以有效地检测肠杆菌科和铜绿假单胞菌中产生的碳青霉烯酶。自此,MALDI-TOF MS与酶水解法联合检测碳青霉烯酶的相关研究不断增多。目前该类研究主要集中在布鲁克公司的Microflex LT质谱仪[7,9]等,应用梅里埃Vitek质谱仪的研究较少[13],国内更是罕见。而本研究将Vitek质谱仪与酶水解法结合,检测碳青霉烯酶。 相关研究表明亚胺培南特征峰为(300±0.55) m/z,且亚胺培南水解产物只有1个特征峰(254±0.1) m/z[10]。因此,本研究通过对比纯亚胺培南的质谱图和细菌与亚胺培南共温育5 min、10 min、20 min、30 min后获得的质谱图,建立logRQ值对亚胺培南和其水解产物的特征峰强度变化进行量化,并得出当细菌与亚胺培南共温育30 min后,logRQ值≥-0.678时待测菌产碳青霉烯酶,此方法的敏感性和特异性均为100%。经前瞻性研究表明,本研究结果与PCR结果符合率100%。相比PCR技术,本研究的检测方法成本更低也更加快速(总流程约45 min),而且可检测出少见的碳青霉烯酶类型。 目前酶水解法检测碳青霉烯酶常见的温育时间为1~2.5 h[14-15]。本研究亚胺培南与细菌共温育20 min时有47株细菌的logRQ值≥-0.678,仅5株需延长温育时间到30 min,当温育30 min时Vitek MS检测CP-CRE的敏感性与特异性均达100%。本方法不仅缩短了温育时间,而且改进了细菌的取样方式。相比Lasserre等[10]和谢小芳等[15]取1 μL接种环菌落或用接种针直接挑取菌落的取样方式,本研究选择0.5 McFarland菌悬液使标本的选取更加标准化。此外,相比冯丽娜等[11]、Knox等[16]用“肉眼观察亚胺培南特征峰的完全消失”来主观判断菌株是否产碳青霉烯酶,计算logRQ值以定量的形式分析特征峰强度的变化,使结果的判读更客观。“药物特征峰消失且药物水解产物峰出现”表示发生水解反应,即细菌产生能水解药物的酶。本试验与Knox等[16]的研究结果显示:细菌与亚胺培南共温育后亚胺培南特征峰[(300±0.55) m/z]消失,未出现亚胺培南水解产物特征峰[(254±0.1) m/z]的显著增加。但Kempf等[17]可以观察到亚胺培南水解脱羧产物特征峰的增加。可能原因是缓冲液成分和pH的不同,导致亚胺培南脱羧产物(C11H17N3O2S)分子基团稳定性出现差异,脱羧产物与钠离子结合的稳定性亦出现差异。不过,因为本研究logRQ值的设定,所以即使有亚胺培南水解产物峰增加,也不影响本研究方法中Vitek MS检测CP-CRE的可行性。因为水解产物峰增大,logRQ值也相应增大,logRQ值≥-0.678的趋势不会改变,所以并不影响结果判断。 本研究的不足之处在于,检测CRE时该方法仅能检测碳青霉烯酶活性,而不能检测其他机制所导致的细菌耐药,容易使CRE中占比例较少的non-CP-CRE误判为CSE。另外,菌株选择时未涵盖例如枸橼酸杆菌、沙雷菌属等常见肠杆菌目细菌。此外,Microflex LT质谱仪可自动计算logRQ值[7],而本试验所用Vitek MS尚需其他辅助软件。在本研究中发现blaKPC阳性的菌株可更快地(10 min)水解亚胺培南,而blaNDM阳性菌株最多需30 min才能水解亚胺培南,猜测酶水解法的温育时间与酶的基因型和细菌种属可能有关。但由于样本较少,不能准确判断酶型和细菌种属对水解时间的影响。后续将进一步扩大菌种范围,增加样本量,研究水解时间与酶型、细菌种属的关系。 MALDI-TOF MS联合酶水解法快速检测CP-CRE应用前景广泛,本研究进一步深入探索使其操作和结果判断更加标准化,体现该方法检测碳青霉烯酶快速、准确的潜力。基于酶水解法的Vitek MS有助于医生精准用药,也有助于防止CRE的流行和传播。
2 结果
3 讨论
