尿液分离万古霉素耐药屎肠球菌耐药机制及毒力基因分析*
2022-03-30高硕朱宏周辉周万青沈瀚南京大学医学院附属鼓楼医院检验科南京210008
高硕,朱宏,周辉,周万青,沈瀚(南京大学医学院附属鼓楼医院检验科,南京 210008)
肠球菌属细菌为院内感染的重要条件病原菌之一,可引起临床尿路感染、菌血症、软组织及外科感染等[1]。临床检出的肠球菌以粪肠球菌和屎肠球菌为主,以尿液标本分离为主[2]。万古霉素耐药、利奈唑胺耐药肠球菌不断检出[3-4]。尽管国内万古霉素耐药肠球菌(vancomycin resistantEnterococci,VRE)菌株的临床检出率近几年有下降的趋势[5],但其致病强度、多重耐药及院内传播等问题仍给临床治疗带来挑战。肠球菌所携带的多种毒力基因(esp、gelE、asa1、cylA、hyl等)决定了菌株的致病性,同时也与生物膜形成有关[6]。为探讨万古霉素耐药屎肠球菌(vancomycin resistantEnterococcusfaecium,VREfm)耐药机制及毒力基因的携带情况,本研究对临床尿液样本分离屎肠球菌携带的耐药基因及毒力基因进行检测,并与敏感菌株进行毒力基因携带差异分析,为肠球菌感染的治疗提供依据。
1 材料与方法
1.1菌株来源 收集南京大学医学院附属鼓楼医院2013—2019年临床分离的中段尿来源非重复屎肠球菌株88株,使用Vitek 2 Compact全自动微生物分析仪进行菌种鉴定并经Vitek MS复核。依据菌株对万古霉素最低抑菌浓度(minimum inhibitory concentration, MIC)分为万古霉素耐药菌株(MIC≥32 μg/mL)和敏感菌株(MIC≤4 μg/mL),分别为37株和51株。
1.2主要仪器和试剂 Vitek 2 Compact全自动鉴定药敏分析仪及配套GP鉴定卡、GP67药敏卡、Vitek MS及配套试剂(法国生物梅里埃公司);万古霉素、替考拉宁E-test条(郑州安图生物公司);2×Taq Mix(上海近岸公司);2720 Thermal Cycler PCR扩增仪(ABI公司);蛋白酶K(Merck公司);2 000 bp DNA marker(北京擎科生物公司);Gelrad染色液(美国BIOTIUM公司);电泳仪及GelDoc XR型凝胶成像分析系统(美国Bio-Rad公司);PCR引物合成由上海生工生物公司完成。
1.3药敏试验 采用Vitek 2 Compact及配套GP67卡进行常规药物敏感性检测;采用E-test法复核万古霉素和替考拉宁MIC值。结果判读依据CLSI 2019标准[7]进行。
1.4耐药基因扩增及序列分析 采用加热煮沸法提取细菌DNA[8],挑取纯培养菌落加入含200 ng/mL蛋白酶K溶液的1.5 mL离心管内,56 ℃ 水浴2 h后置95 ℃ 水浴10 min,13 000×g离心30 s,取上清液即为DNA模板。参照文献[9]合成介导万古霉素耐药决定基因vanA、vanB、vanD及vanM引物,见表1。采用多重PCR法进行基因扩增分析。反应体系为50 μL,包括2×Taq Mix 25 μL,DNA模板2 μL,上游引物(10 μmol/L)4 μL,下游引物(10 μmol/L)各1 μL,ddH2O 15 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 7 min。扩增产物经15 g/L琼脂糖凝胶电泳,Gelrad染色后经GelDoc XR型凝胶成像分析系统观察结果。选取部分阳性检出菌株,采用单独引物运用上述条件扩增,并由上海生工生物公司采用ABI 3730XL基因测序仪进行单向测序,结果经BLAST与GenBank比对。

表1 本文所用的引物序列
1.5毒力基因PCR扩增 参照文献[10-11]合成肠球菌毒力基因cylA、esp、asal、hyl、gelE和agg扩增引物,引物序列见表1。采用PCR法进行目的基因检测。cylA、esp、asa1、hyl和gelE反应体系为50 μL多重体系,包括2×Taq Mix 25 μL,DNA模板2 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 13 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 1 min,56 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 7 min。agg反应体系为20 μL,包括2×Taq Mix 10 μL,DNA模板2 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 6 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 7 min。PCR扩增产物经15 g/L琼脂糖凝胶电泳,Gelrad染色后经GelDoc XR型凝胶成像分析系统观察结果。
1.6统计学分析 用SPSS 22.0统计软件进行数据分析,率的比较采用卡方检验或Fisher检验。以P<0.05为差异有统计学意义。
2 结果
2.1药敏结果 37株初筛万古霉素耐药菌对万古霉素MIC均≥256 μg/mL。其中,27株对替考拉宁MIC≥256 μg/mL(73.0%,27/37),9株MIC为8 μg/mL,1株MIC为24 μg/mL。VREfm菌株对青霉素、氨苄西林、左氧氟沙星及高水平庆大霉素的耐药率分别为100%(37/37)、97.3%(36/37)、100%(37/37)和59.5%(22/37),对利奈唑胺均敏感。
2.2耐药基因结果 37株VREfm中35株检出vanA基因,其余2株检出vanM基因;9株对替考拉宁敏感的VREfm均为vanA基因型。所有耐药菌株均未检出vanB、vanD基因。部分菌株耐药基因扩增结果见图1。
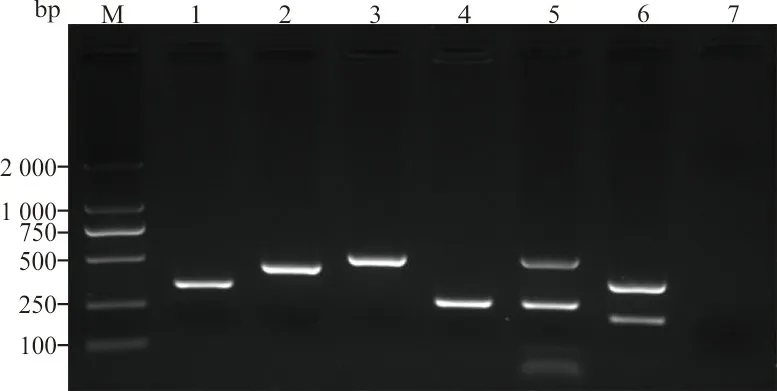
注:M,2 000 bp DNA marker;1,vanA基因;2,vanM基因;3,esp基因;4,hyl基因;5,esp-hyl双基因携带;6,asa1-gelE双基因携带;7,空白对照。
2.3毒力基因结果 88株屎肠球菌检出asa11株、esp71株、hyl18株、gelE1株,未检出cylA和agg基因。37株VREfm菌株以esp基因检出率最高(89.2%),其次为hyl(8.1%),其中esp-hyl双基因携带菌株2株,asa1-gelE双基因携带1株。51株万古霉素敏感菌株中,esp基因检出率最高(74.5%),其次为hyl基因(29.4%),未检出其余4种毒力基因。部分菌株毒力基因扩增结果见图1。VREfm菌株中hyl基因检出率低于敏感菌株,差异有统计学意义(P<0.05)。
3 讨论
介导肠球菌耐糖肽类抗菌药物的决定基因包括vanA、vanB、vanC、vanD、vanE、vanG、vanL、vanM和vanN,不同基因型对万古霉素和替考拉宁耐药性有所不同,耐药基因型在不同的地域、人群及环境中存在差异[12]。vanA、vanB基因可介导细菌产生含D-丙氨酸-D-乳酸(D-Ala-D-Lac)末端的新的细胞壁前体,使万古霉素与结合靶位的亲和力下降从而产生耐药性。VanA型对万古霉素和替考拉宁均耐药,VanB型基因簇的编码蛋白VanS仅能被万古霉素激活,因此VanB型对万古霉素耐药而对替考拉宁敏感[13]。本调查分析发现,37株VREfm具有多重耐药表型,其中35株检出vanA基因,另2株检出vanM基因。由此可见,本院尿液分离VREfm主要由vanA介导,表现为对万古霉素和替考拉宁高水平耐药,与国内报道较为一致[14]。检出2株VREfm携带vanM基因,该基因最先于2006年在上海发现并具有地区分布性[15]。vanM基因耐药性表型与vanA基因型相似,为万古霉素和替考拉宁均高水平耐药。但目前经典的vanA基因型与VanA表型已发生变化。本研究中检出的vanA基因型VREfm中存在9株对替考拉宁敏感,即存在VanB表型-vanA基因型菌株。有研究表明Tn1546转座子vanY和vanZ缺失伴随vanX-vanY间插入IS1216V或orf2-vanR间插入ISEfa4是导致VanB表型-vanA基因型中替考拉宁抗性受损的可能原因[16],是否van基因簇中其他位点发生一些插入及缺失变异使得细菌对替考拉宁敏感性变化还有待进一步研究。本研究中VanB表型-vanA基因型耐药屎肠球菌比例较高,今后也将对此类菌株的vanA基因周围序列进行进一步分析,以揭示表型和基因型不一致菌株的序列特征。
肠球菌所携带的毒力因子在其致病过程中发挥重要作用,主要基因有肠球菌表面蛋白基因esp、透明质酸酶基因hyl、胶原蛋白黏附素基因ace、明胶酶基因gelE、 溶细胞素基因cyl、聚集物质基因asa1及胶原黏附蛋白基因agg等[17]。本文对尿路分离屎肠球菌携带毒力基因的调查分析发现,esp单基因和esp-hyl双基因为主要携带模式。以esp的携带率最高,其次为hyl。VREfm菌株esp和hyl的携带率分别为89.2%和8.1%。与北京地区医院数据存在差异,尿路来源VREfm菌株esp和hyl的携带率为76.2% 和66.7%[14]。国外对于尿路感染VREfm研究中发现,esp的携带率达到91.1%,表明esp毒力基因在肠球菌所致尿路感染过程中的关键作用[18]。此外,检出1株同时携带asa1和gelE基因的VREfm。与万古霉素敏感菌株相比,发现VREfm菌株hyl基因携带率显著低于敏感菌株,而esp基因携带率在两者间差异无统计学意义。这一结果提示,敏感菌株与耐药菌株相比所携带的毒力基因更多,其致病性可能更强。研究发现,临床多种来源样本及医院环境中分离的VREfm菌株hyl携带率高于敏感株(28.7% vs 5%)[19],这与本研究分析结果不一致。一方面可能由于样本来源的不同和地域差异,另一方面尿液来源的VREfm菌株在获得万古霉素耐药的同时,可能丢失部分的毒力基因导致菌株致病性减弱。当然对于这一发现,本调查分析仍存在菌株数量较少的局限,具体的机制还有待深入研究。
综上所述,本文尿路分离屎肠球菌对万古霉素耐药主要由vanA基因介导;VREfm菌株携带的毒力基因主要为esp和hyl,其中hyl基因携带率低于敏感菌株。临床上应加强对万古霉素等糖肽类抗菌药物的使用管理,以期对VRE的传播进行早期预防。对VRE产生的分子机制和致病性的深入研究,也将为临床感染的有效治疗提供依据。
