Graves’病病人外周血B细胞内PTEN表达及其意义
2022-03-13蔚芳芳谷钰峰周瑾王静崔孝敏姚文杰
蔚芳芳 谷钰峰 周瑾 王静 崔孝敏 姚文杰


[摘要] 目的 分析磷酸酶和张力蛋白同源物(PTEN)在Graves’病(GD)病人外周血B细胞中的表达,并探讨其在GD发生、发展中可能的机制。方法 选取诊断明确的GD病人21例作为GD组,同期选取体检正常的健康人21例作为正常对照组(HC组)。采用流式细胞术检测两组外周血B细胞及其亚群PTEN的表达,并分析GD病人PTEN表达与促甲状腺激素(TSH)、游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)、抗甲状腺过氧化物酶抗体(Anti-TPO)、抗甲状腺球蛋白抗体(TGAb)、促甲状腺素受体抗体(TRAb)等指标的相关性。采用实时荧光定量PCR(RT-PCR)方法检测两组外周血CD19+B细胞PTEN mRNA的表达水平。结果 与HC组相比较,GD组CD19+B細胞的比例显著升高,CD19+B细胞、幼稚性B细胞(CD19+IgD+CD27-)、未类型转换的记忆B细胞(CD19+IgD+CD27+)、类型转换的记忆B细胞(CD19+IgD-CD27+)、总的记忆细胞(CD19+CD27+)以及双阴性B细胞(CD19+IgD-CD27-)PTEN表达明显升高,差异均有统计学意义(Z=-3.536~-2.252,P<0.05)。GD组CD19+B细胞PTEN mRNA表达较HC组明显升高,差异有统计学意义(Z=-2.763,P<0.05)。相关性分析显示,PTEN与TRAb呈正相关(r=0.490,P<0.05)。结论 PTEN在GD病人外周血B细胞中高表达,可抑制PI3K/AKT信号通路,使磷脂酰肌醇3磷酸 (PIP3)水解为磷脂酰肌醇2磷酸(PIP2)增加,可能通过磷脂酶A2途径在GD中发挥生理学效应。
[关键词] 格雷夫斯病;B-淋巴细胞;PTEN磷酸水解酶
[中图分类号] R581.1
[文献标志码] A
[文章编号] 2096-5532(2021)01-0100-05
doi:10.11712/jms.2096-5532.2022.58.030
Graves’病(GD)是一种影响甲状腺的自身免疫性疾病,发病率为1.0%~1.5%[1],女性发病率明显高于男性[2]。GD的临床表现主要为甲状腺功能亢进产生的高代谢症候群,如烦躁、心慌、容易激动等,有时伴有甲状腺大、胫前黏液水肿以及眼征等[3-4]。有研究认为,遗传和环境等因素的相互作用使病人B细胞的活化阈值降低,导致其产生了针对促甲状腺激素受体(TSHR)的刺激性抗体(TSAb),该抗体是GD的致病性抗体,由B细胞分泌[5]。B细胞内的磷脂酰肌醇3-激酶(PI3K)信号通路参与了其功能和稳态性的维持[6-11]。磷酸酶和张力蛋白同源物(PTEN)是PI3K/蛋白激酶B(AKT)信号通路的重要负调控因子,可拮抗PI3K激酶的功能[12-13]。本实验主要以GD病人外周血B细胞为研究对象,通过流式细胞术和实时荧光定量PCR(RT-PCR)技术对B细胞及其亚群PTEN的表达进行分析,以明确PTEN在GD病人免疫调节中的作用,探究其与甲状腺功能指标的关系。现将结果报告如下。
1 对象与方法
1.1 研究对象
选取2019年5月—2020年3月于青岛大学附属烟台毓璜顶医院内分泌科诊断明确的GD初发病人21例(GD组),其中男性6例,女性15例;年龄31~64岁,平均(46.3±10.3)岁。同期选取体检正常的健康人21例作为正常对照组(HC组),男7例,女14例;年龄29~64岁,平均(45.5±11.9)岁。
对照组病人血清促甲状腺激素(TSH)水平正常,无甲状腺大、无甲状腺疾病及家族史。两组受检者的性别和年龄差异无统计学意义(P>0.05)。
1.2 试剂和仪器
人外周血淋巴细胞分离液(天津市灏洋生物制品有限责任公司);流式荧光标记抗体及其同型对照、溶血素、破膜液Perm/Wash和固定液Cytofix/Cytoperm(美国BD公司);RNA提取用Trizol(美国Ambion公司生产);反转录试剂盒First Strand cDNA Synthesis Kit(赛默飞世尔科技公司);RT-PCR试剂盒Power SYBR Green PCR Master Mix(美国生命技术公司);RNAase Free water(天根生化科技有限公司)。FACSAriaⅢ流式细胞分析仪(美国BD公司);RT-PCR仪(美国伯乐公司)。甲状腺功能检测仪器Cobas E601电化学发光免疫分析仪及其试剂(罗氏诊断有限公司)。
1.3 实验方法
1.3.1 标本采集及外周血单个核细胞(PBMC)分离 采取受检者早晨空腹静脉全血标本,EDTA抗凝,颠倒混匀后转入无菌离心管中,2 000 r/min离心10 min,吸出血浆保存,血细胞用1×PBS按照1∶1稀释,并充分混匀;将人外周血淋巴细胞分离液12.5 mL加入到50 mL PBMC无菌管,离心待用;将混匀稀释后的血液用移液器缓慢贴壁加入到离心好的淋巴细胞分离液液面上,保持界面清晰,离心管隔断以上为血细胞,隔断以下为淋巴细胞分离液;25 ℃、2 000 r/min离心25 min,不设置刹车制动;离心后,离心管内液体分为3层,上层和中间层之间为以PBMC为主的白色不透明带,小心吸取白色不透明带细胞至无菌离心管中;加5倍以上的PBS,4 ℃、1 632 r/min离心5 min,洗涤细胞2次。
1.3.2 甲状腺功能检测 应用电化学发光法,分别检测受检者血清标本TSH、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、抗甲状腺过氧化物酶抗体(Anti-TPO)、抗甲状腺球蛋白抗体(TGAb)和促甲状腺素受体抗体(TRAb)水平,操作严格按照试剂盒说明书进行。
1.3.3 外周血CD19+B细胞的比例及其各亚群PTEN表达检测 采用流式细胞术进行检测。将上述分离出的PBMC定容,每个样品管大约106个细胞,剩余细胞加入APC-CY7 anti-human CD19,用于分选B细胞。样品管依次加入APC-CY7 anti-human CD19、PE anti-human IgD、Percp-cy5.5、anti-human CD38、PE-CY7 anti-human CD27抗体各5 μL,涡旋混匀,4 ℃避光孵育30 min;加入PBS 1 mL,4 ℃、1 632 r/min离心5 min,弃去上清,重复2次。将各样品管分别加入250 μL Cytofix/Cytoperm,涡旋混匀,4 ℃避光孵育30 min;加入1×BD Perm/Wash 500 μL,1 632 r/min离心5 min,弃去上清,重复2次;然后加入100 μL BD Perm/Wash和20 μL APC Mouse anti-human PTEN,涡旋混匀,4 ℃避光孵育30 min;加入1×BD Perm/Wash 500 μL,1 632 r/min离心5 min,弃去上清,重复2次;将上述各管加入500 μL Cell Staining Buffer,用流式细胞分析仪上机检测、分选。根据CD19、IgD、CD27、CD38染色情况,将B细胞分为幼稚性B细胞(CD19+IgD+CD27-)、未类型转换的记忆B细胞(CD19+IgD+CD27+)、类型转换的记忆B细胞(CD19+IgD-CD27+)、总的记忆细胞(CD19+CD27+)、浆母细胞(CD19+IgD-CD38+CD27+)、过渡性B细胞(CD19 + IgDdim CD38+)及双阴性B细胞(CD19+IgD-CD27-)[14]。
1.3.4 外周血CD19+B细胞PTEN mRNA表达检测 采用RT-PCR方法检测。将外周血分选出的CD19+B细胞用Trizol法提取RNA,应用First Strand cDNA Synthesis Kit试剂盒将RNA反转录为cDNA ,调整cDNA浓度,以cDNA为模板进行PCR反应。PCR反应体系50 μL,内含:cDNA 模板4 μL,SYBR Green 25 μL,上下游引物(10 μmol/L)各1 μL, RNAase Free water 19 μL。扩增条件:95 ℃、10 min, 95 ℃、15 s, 60 ℃、1 min,共进行40个循环。计数达到阈值所需要的循环数(CT值),采用2-ΔΔCt值表示PTEN mRNA的相对表达量。PTEN和GAPDH基因(内参照)引物序列见表1。
1.4 统计学方法
应用SPSS 17.0软件进行统计分析。首先通过Kolmogorov-Smirnov检验或Shapira-Wilk检验进行数据正态分布检验,非正态分布计量资料结果以P50(P25~P75)表示,两组数据比较采用非参数检验;相关性分析采用秩相关。以P<0.05表示差异具有统计学意义。
2 结 果
2.1 两组外周血CD19+B细胞占淋巴细胞的百分比比较
HC组、GD组病人外周血CD19+B细胞占淋巴细胞的百分比分别为5.80(4.05~9.85)%、12.70(6.65~21.55)%,两组比较差异具有统计学意义 (Z=-3.006,P<0.05)。
2.2 两组外周血CD19+B细胞及其亚群PTEN表达比较
HC组和GD组外周血B细胞及其亚群上均有PTEN表达,以浆母细胞和过渡性B细胞上PTEN的荧光强度最高。与HC组相比,GD组CD19+B细胞、幼稚性B细胞、未类型转换的记忆B细胞、类型转换的记忆B细胞、总的记忆细胞以及双阴性B细胞PTEN表达均增高,差异均有统计学意义(Z=-3.536~-2.252,P<0.05);两组浆母细胞和过渡性B细胞PTEN表达的差异无显著性(P>0.05)。见表2。
2.3 两组外周血CD19+B细胞PTEN mRNA表达比较
HC组、GD组外周血CD19+B细胞的PTEN mRNA表达分别为0.527(0.325~1.438)、2.638(0.789~3.544),两组比较差异有统计学意义(Z=-2.763,P<0.05)。
2.4 GD组CD19+B 细胞PTEN的表达与甲状腺功能指标的相关性
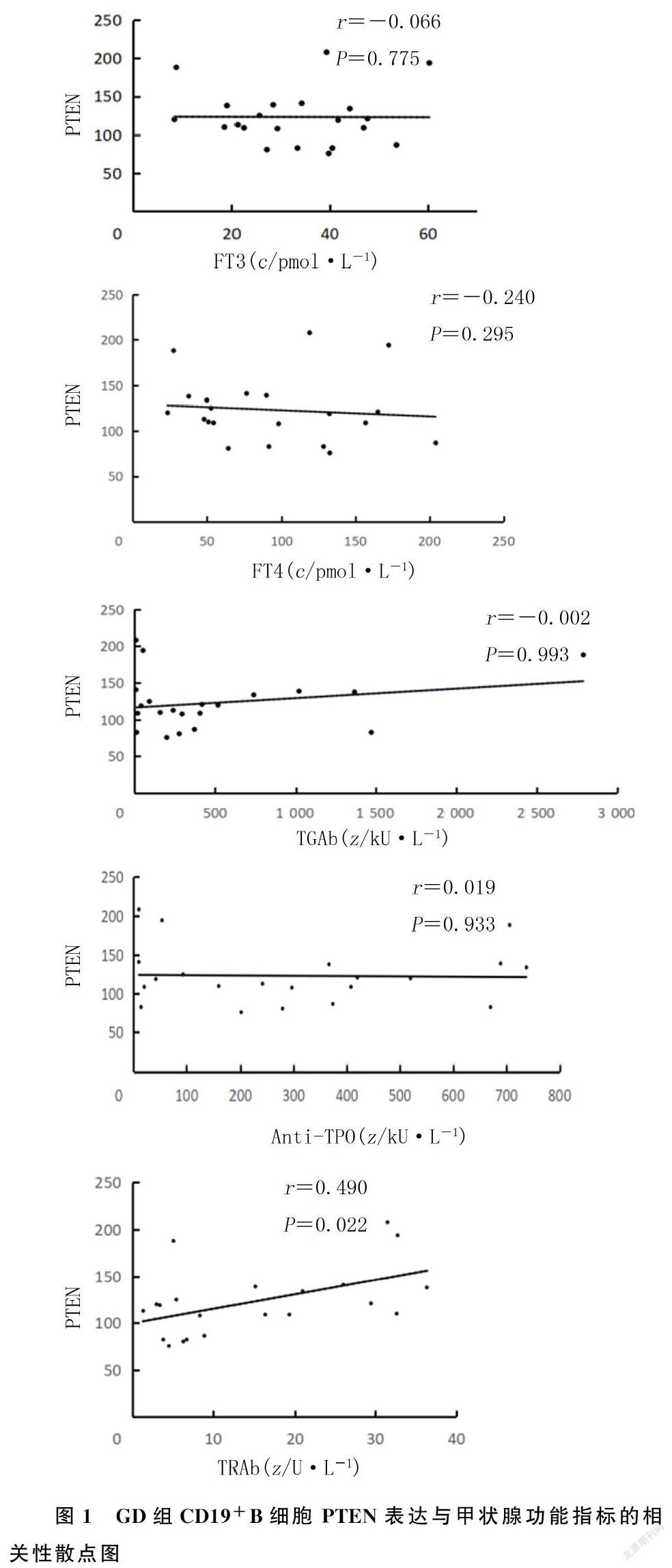
秩相关分析显示,GD组CD19+B 细胞PTEN与FT4、FT3、Anti-TPO、TGAb水平均无相关性(r=-0.240~0.019,P>0.05),与TRAb呈正相关(r=0.490,P<0.05)。见图1。
3 讨 论
产生自身抗体的B细胞是GD发病机制的重要贡献者,在机体的体液免疫中B细胞发挥作用的途径有多种,常见的主要有提呈抗原、分泌抗体、产生免疫调节因子和炎症因子等;B细胞还可以调节甲状腺细胞的生长、分化和分泌,与自身免疫性GD的发生发展密切相关。B细胞数量发生变化或者功能出现异常對自身免疫性疾病来说都是非常有研究意义的。有研究表明,自身抗体参与了GD的发生发展,在病程中还发现了器官特异性的免疫损伤[15]。梁金明等[16]对GD不同发展过程中CD19+B细胞含量的变化研究显示,初发组CD19+B细胞含量明显高于HC组,本研究结果与其一致。因此,初步推测GD病人外周血中增加的B细胞是导致体液免疫反应增强的基础,可以促进GD的发生。
GD的发病机制与病人血清中存在的TSHR抗体有密切关系。TRAb是一种非常关键的致病因子,该抗体由B淋巴细胞分泌,在GD病人中的检出率高达80%~100%,TRAb与TSH竞争结合到甲状腺细胞膜表面的TSHR,进而激活TSH受体,通过3条途径促进甲状腺细胞分裂、增殖,从而使病人产生类似于甲状腺功能亢进的临床症状,导致GD的发生[17-18]。①环磷酸腺苷(cAMP)/腺苷酸环化酶(AC)级联反应:TRAb与TSH受体结合后借助G蛋白的偶联作用来激活AC,细胞内cAMP水平受到AC调节后引起反应[19-20];②磷酸肌醇-Ca2+级联反应:TRAb与TSH受体结合后可以激活磷脂-Ca2+,引起三磷酸肌醇(IP3)增加伴随着细胞内钙动员增加,Ca2+发挥第二信使的作用导致甲状腺功能发生变化,这些变化包括甲状腺球蛋白的碘化、碘的有机化、甲状腺素的合成[21];③磷脂酶A2途径:通过该途径PIP2被磷脂酶C激活水解生成二酰基甘油与IP3,生成的两种产物均可作为第二信使来发挥生物学效应[22]。
B細胞的调控需要许多种信号通路,其中非常重要的一条就是PI3K/AKT信号通路,PTEN是该信号通路的一个负调控因子,能将激活的PIP3重新水解成为PIP2。本文研究结果显示,PTEN在外周血B细胞及其亚群中均有表达,GD病人CD19+B细胞以及幼稚性B细胞、未类型转换的记忆B细胞、类型转换的记忆B细胞、总的记忆细胞和双阴性B细胞PTEN表达均明显高于HC组。在这些B细胞内表达上调的PTEN使PIP3重新水解为PIP2,进而通过磷脂酶A2途径发挥作用,而该途径产生的PIP2的水解产物IP3又可以启动磷酸肌醇-Ca2+级联反应发挥作用,因此GD病人外周血B细胞内PTEN升高可能通过磷酸肌醇-Ca2+级联反应和磷脂酶A2途径使TRAb发挥生物学效应,进而调节甲状腺细胞的功能和生长,触发GD的发生,其详细的致病机制还需要更深一步的研究。
本文相关性分析显示,GD病人体内CD19+B细胞升高,其PTEN表达与TRAb呈正相关。有研究显示,GD病人TRAb产生量的多少与甲状腺体积的大小呈正相关[23];GD病人血清中的TRAb滴度与GD的病程有密切关系[24],由此推测CD19+B细胞内PTEN的表达可能成为GD诊断的辅助指标。B淋巴细胞在淋巴细胞中占比较少,通过流式细胞术分选B细胞来进行RT-PCR检测需要大量的血液,由于实验条件局限性,本文仅应用RT-PCR方法研究了CD19+B细胞内PTEN mRNA表达水平,未对各亚群的PTEN mRNA表达进行研究。
综上所述,PTEN在GD病人B细胞中高表达,通过多种途径参与GD的发生、发展;CD19+B细胞内的PTEN表达与TRAb呈正相关,为GD的辅助诊断和治疗开辟了新途径。由于本研究样本量有限,本文结论还需要更大的样本量进行验证。
[参考文献]
[1]CHEN P L, SHIH S R, WANG P W, et al. Genetic determinants of antithyroid drug-induced agranulocytosis by human leukocyte antigen genotyping and genome-wide association study[J]. Nature Communications, 2015,6:7633.
[2]CARL A, PEDERSEN I B, KNUDSEN N, et al. Epidemio-logy of subtypes of hyperthyroidism in Denmark: a population-based study[J]. European Journal of Endocrinology, 2011,164(5):801-809.
[3]RAPOPORT B, CHAZENBALK G D, JAUME J C, et al. The thyrotropin (TSH) receptor: interaction with TSH and autoantibodies[J]. Endocrine Reviews, 1998,19(6):673-716.
[4]PRABHAKAR B S, BAHN R S, SMITH T J. Current perspective on the pathogenesis of Graves’ disease and ophthalmopathy[J]. Endocrine Reviews, 2003,24(6):802-835.
[5]DOUGLAS R S, NAIK V, HWANG C J, et al. B cells from patients with Graves’ disease aberrantly express the IGF-1 receptor: implications for disease pathogenesis[J]. Journal of Immunology (Baltimore, Md: 1950), 2008,181(8):5768-5774.
[6]INABE K, ISHIAI M, SCHARENBERG A M, et al. Vav3 modulates B cell receptor responses by regulating phosphoinositide 3-kinase activation[J]. The Journal of Experimental Medicine, 2002,195(2):189-200.
[7]AIBA Y, KAMEYAMA M, YAMAZAKI T, et al. Regulation of B-cell development by BCAP and CD19 through their binding to phosphoinositide 3-kinase[J]. Blood, 2008,111(3):1497-1503.
[8]CLAYTON E, BARDI G, BELL S E, et al. A crucial role for the p110delta subunit of phosphatidylinositol 3-kinase in B cell development and activation[J]. The Journal of Experimental Medicine, 2002,196(6):753-763.
[9]YAMAZAKI T, TAKEDA K, GOTOH K, et al. Essential immunoregulatory role for BCAP in B cell development and function[J]. The Journal of Experimental Medicine, 2002,195(5):535-545.
[10]SRINIVASAN L, SASAKI Y, CALADO D P, et al. PI3 kinase signals BCR-dependent mature B cell survival[J]. Cell, 2009,139(3):573-586.
[11]DAVIDSON A, DIAMOND B. Autoimmune diseases[J]. New England Journal of Medicine, 2001,345(5):340-350.
[12]SESHACHARYULU P, RACHAGANI S, MUNIYAN S, et al. FDPS cooperates with PTEN loss to promote prostate can-cer progression through modulation of small GTPases/AKT axis[J]. Oncogene, 2019,38(26):5265-5280.
[13]ZHAO C J, TAO T, YANG L Y, et al. Loss of PDZK1 expression activates PI3K/AKT signaling via PTEN phosphory-lation in gastric cancer[J]. Cancer Letters, 2019,453:107-121.
[14]WANG X, LIANG K D, ZHANG J A, et al. Increased B cell activating factor is associated with B cell class switching in patients with tuberculous pleural effusion[J]. Molecular Medicine Reports, 2018,18(2):1704-1709.
[15]ISHII N, TAKAHASHI T, SOROOSH P, et al. OX40-OX40 ligand interaction in T-cell-mediated immunity and immunopathology[J]. Advances in Immunology, 2010,105:63-98.
[16]梁金明,欧志莲,陈聪等. Graves病不同阶段病程中CD3-CD19+B细胞含量变化[J]. 分子诊断与治疗杂志, 2013,5(5):315-318.
[17]BROKKEN L J, WIERSINGA W M, PRUMMEL M F. Thyrotropin receptor autoantibodies are associated with continued thyrotropin suppression in treated euthyroid Graves’ disease patients[J]. The Journal of Clinical Endocrinology and Meta-bolism, 2003,88(9):4135-4138.
[18]ARAO T, MORIMOTO I, KAKINUMA A, et al. Thyrocyte proliferation by cellular adhesion to infiltrating lymphocytes through the intercellular adhesion molecule-1/lymphocyte function-associated antigen-1 pathway in Graves’ disease[J]. The Journal of Clinical Endocrinology and Metabolism, 2000,85(1):382-389.
[19]ALLGEIER A, OFFERMANNS S, VAN SANDE J, et al. The human thyrotropin receptor activates G-proteins Gs and Gq/11[J]. The Journal of Biological Chemistry, 1994,269(19):13733-13735.
[20]SANDE J V, LEJEUNE C, LUDGATE M, et al. Thyroid stimulating immunoglobulins, like thyrotropin activate both the cyclic AMP and the PIP2 cascades in CHO cells expressing the TSH receptor[J]. Molecular and Cellular Endocrinology, 1992,88(1/3):R1-R5.
[21]SHODA Y, KONDO Y, KOBAYASHI I. Graves’ immunoglobulin G stimulates iodide efflux in FRTL-5 thyroid cells[J]. The Journal of Clinical Endocrinology and Metabolism, 1993,77(1):94-97.
[22]ATWA M A, SMALLRIDGE R C, BURCH H B, et al. Immunoglobulins from Graves’ disease patients stimulate phospholipase A2 and C systems in FRTL-5 and human thyroid cells[J]. European Journal of Endocrinology, 1996,135(3):322-327.
[23]BOJARSKA-SZMYGIN A, JANICKI K, PIETURA R, et al. The usefulness of thyroid size and TSH receptor antibody (TRAb) determinations in predicting the effectiveness of tia-mazole and I-131 treatment for Graves-Basedow’s disease[J]. Annales Universitatis Mariae Curie-Sklodowska Sectio D: Medicina, 2003,58(1):242-247.
[24]SHYAMASUNDER A H, ABRAHAM P. Measuring TSH receptor antibody to influence treatment choices in Graves’di-sease[J]. Clinical Endocrinology, 2017,86(5):652-657.
(本文編辑 黄建乡)
3183500338204
