犬急性胰腺炎病程与血液指标变化相关性研究
2017-03-30王明月田欣欣周东海
王明月++田欣欣++周东海

摘要:探究犬急性胰腺炎病程中相关血液指標的变化和病程发展的关系,以利于更好的评估急性胰腺炎患犬病程发展。对12只本地杂种犬构建急性胰腺炎模型,对照组A组4只,水肿组B组4只,出血坏死组C组4只。术后第1、2、3、4、5天各采血,进行血常规、血液生化检查,同时收集临床急性胰腺炎病犬血液指标及临床资料,进行分析。结果表明,水肿型和出血坏死型急性胰腺炎犬的白细胞在术后12 h开始上升,在15~40 h之间水平较高,在36~40 h开始下降;淀粉酶在术后12 h开始高于正常范围,水肿型急性胰腺炎患犬比出血坏死型急性胰腺炎患犬淀粉酶维持在高于正常范围的时间更久;淋巴细胞于急性胰腺炎初期明显降低,术后第3天回复正常范围。三个血液指标联合诊断,更能有效的评估犬急性胰腺炎的病程发展阶段。
关键词:犬;急性胰腺炎;白细胞;淀粉酶;淋巴细胞
中图分类号:S858.292 文献标识码:A 文章编号:1007-273X(2017)01-0005-03
犬急性胰腺炎(Acute pancreatitis)是由高浓度游离脂肪酸、毒素、病原等诱发胰腺内一系列的酶被激活,造成胰腺本身及周围组织损伤的疾病[1]。该病发病迅速,临床上分为水肿型胰腺炎和坏死型胰腺炎,后者预后不良[2]。现阶段临床兽医工作者对犬急性胰腺炎的诊断仅能做到确诊,未能对犬病情发展进行准确评估。因此,寻找能辅助评估犬急性胰腺炎病程发展的指标对临床犬急性胰腺炎的治疗具有重要的指导意义。
本研究对临床急性胰腺炎病例和12例犬急性胰腺炎模型的白细胞、淋巴细胞和血清淀粉酶指标进行检测,比较分析其阶段性诊断的意义。
1 材料与方法
1.1 试验药物和材料
5%牛磺胆酸钠;2 500 U/mg胰蛋白酶;盐酸塞拉嗪注射液;丙泊酚注射液;硫酸阿托品注射液;酚磺乙胺注射液;生理盐水;淀粉酶生化试剂板;3 mL 肝素钠抗凝管,2 mL EDTAK2抗凝管;留置针;20 G平口点胶枪头;PGA可吸收缝合线。
1.2 主要仪器
SYSMEX pocH-100iV Diff全自动动物血液分析仪;FUJI DRI-CHEM4000ie全自动干式生化分析仪;i-STAT1 300便携式血气分析仪;爱德仕公司生产的SN急性胰腺炎CPL犬胰腺特异性脂肪酶试剂板;恒诺2-16R台式冷冻高速离心机。
1.3 试验动物
选取体重在5~15 kg的本地健康杂种犬12只,雌雄不限,对照组4只,编号A1、A1、A3、A4;水肿型急性胰腺炎组4只,编号B1、B2、B3、B4;出血坏死性急性胰腺炎组4只,编号C1、C2、C3、C4。2015年9月至2016年12月于华中农业大学动物医院门诊收集26例犬急性胰腺炎临床病例。
1.4 造模方法
1.4.1 构建犬急性胰腺炎模型 ①术前禁食24 h,禁水12 h;术前阿托品0.015 mg/kg、酚磺乙胺25 mg/kg皮下注射,盐酸赛拉嗪1.2 mg/kg肌肉注射,丙泊酚静脉维持麻醉。②将试验犬仰卧保定于手术台上,剑状软骨后10~15 cm范围内剃毛、消毒,于脐孔上腹正中切口,切口长5~8 cm,逐层切入打开腹腔。于右侧最后一肋弓处找寻十二指肠,看到犬胰腺组织为粉红色,质软,呈扁平长带状,右叶游离。找到胰体处,切开一长度为2~3 cm的切口。③可于肠腔内壁黏膜面看到一白色脐孔样凹陷,即为十二指肠小乳头,为犬主胰管开口处。④将20 G平口点胶枪头插入主胰管内2 cm(小乳头直径与犬体格差异不大),用手固定。⑤点胶枪头连接1个1 mL注射器,向主胰管内以0.5 mL/min的速度推注5%牛磺胆酸钠0.5 mL/kg,制成水肿型急性胰腺炎模型;将5%牛磺胆酸钠和2 500 U胰蛋白酶混合,前者用量0.5 mL/kg,后者用量3 000 U/kg,以1 mL/min的速度向主胰管内推注,制成出血坏死型急性胰腺炎模型[3]。⑥依次缝合肠壁、腹膜、肌肉、皮肤。切口处碘伏消毒。一切操作均在无菌条件下进行。⑦术后每天禁食禁水,静脉注射200~400 mL的生理盐水,碘伏处理伤口。⑧空白对照组除手术外,作同样处理。
1.4.2 血液指标检测及症状变化资料收集 术前1 h,记录试验犬体温、体重,采血检测血常规数值,检测淀粉酶含量。于术后第1天,收集试验犬静脉血清,用爱德仕公司生产的SN急性胰腺炎CPL犬胰腺特异性脂肪酶试剂板检测;并于术后第1、2、3、4、5天,记录试验犬体温、体重、精神状态变化,采血检测血常规数值和淀粉酶数值变化情况。
1.5 临床病例来源
2015年9月至2016年7月在华中农业大学附属动物医院门诊确诊的26例急性胰腺炎患犬作为自然发病组。
2 结果与分析
2.1 临床病例调查结果
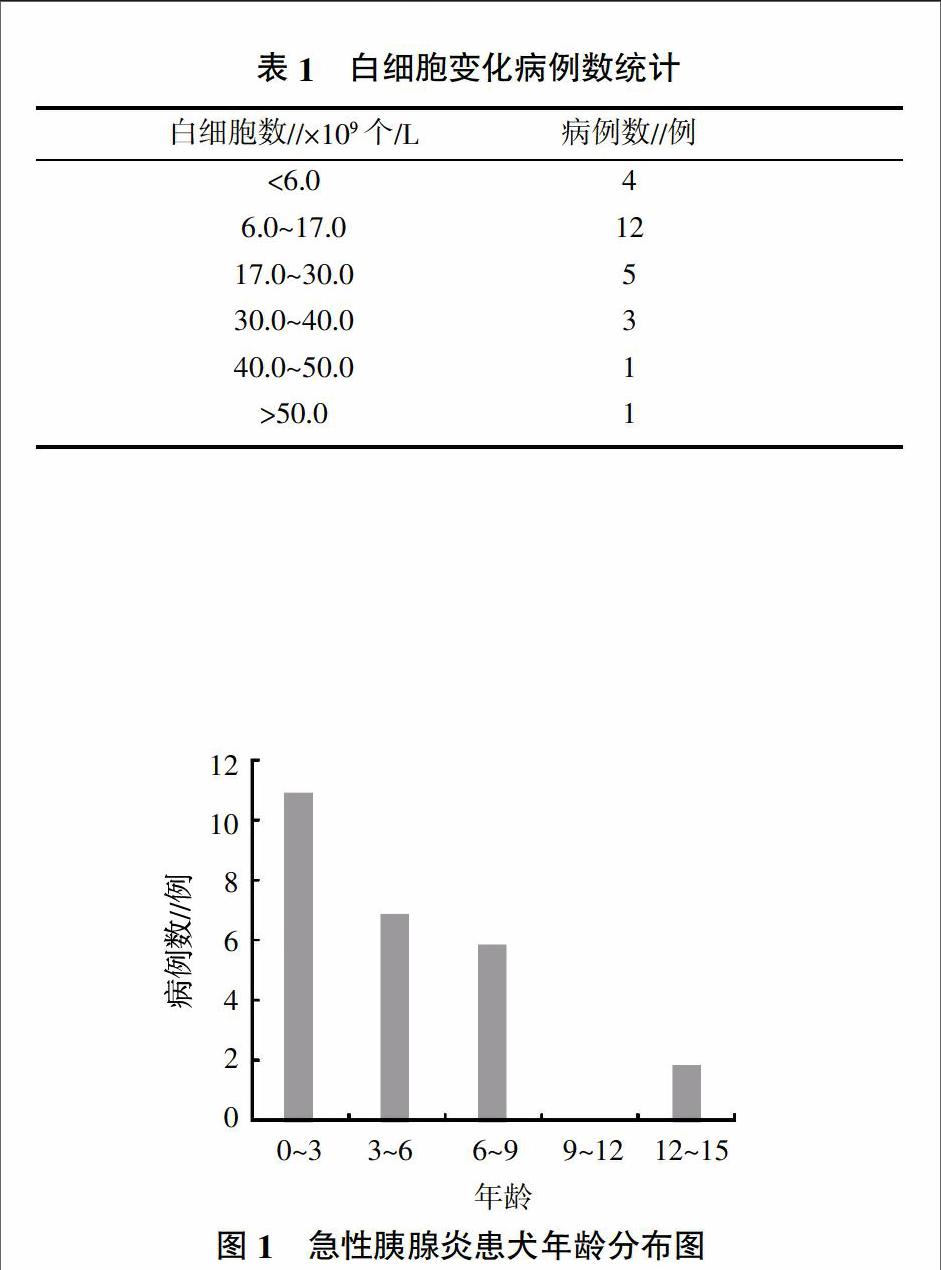
由表1可见,白细胞数处于正常范围内[(6.0~17.0)×109个/L]的犬有12例,低于正常值的有4例,高于正常值的有10例。
由图1可见,急性胰腺炎患犬0~3岁的有11例,3~6岁的有7例,6~9岁的有6例,12~15岁的有2例。由图2可见,急性胰腺炎患犬雌性占34.6%,雄性占65.4%。
2.2 造模结果
向主胰管注入5%牛磺胆酸钠5~10 min,胰腺组织出现叶间隙明显增宽,组织水肿体积增大现象。且术后第1~2天内,犬右腹部明显增大。于术后第1天采取静脉血检测CPL,结果呈阳性。表明成功制备水肿胰腺炎模型。
向主胰管注入5%牛磺胆酸钠和2 500 U胰蛋白酶混合物5~10 min,胰腺组织出现明显水肿、充血、出血现象。于术后第1天采取静脉血检测CPL,结果呈阳性。表明成功制备出血坏死型胰腺炎模型。
2.3 症状变化及血液检测结果
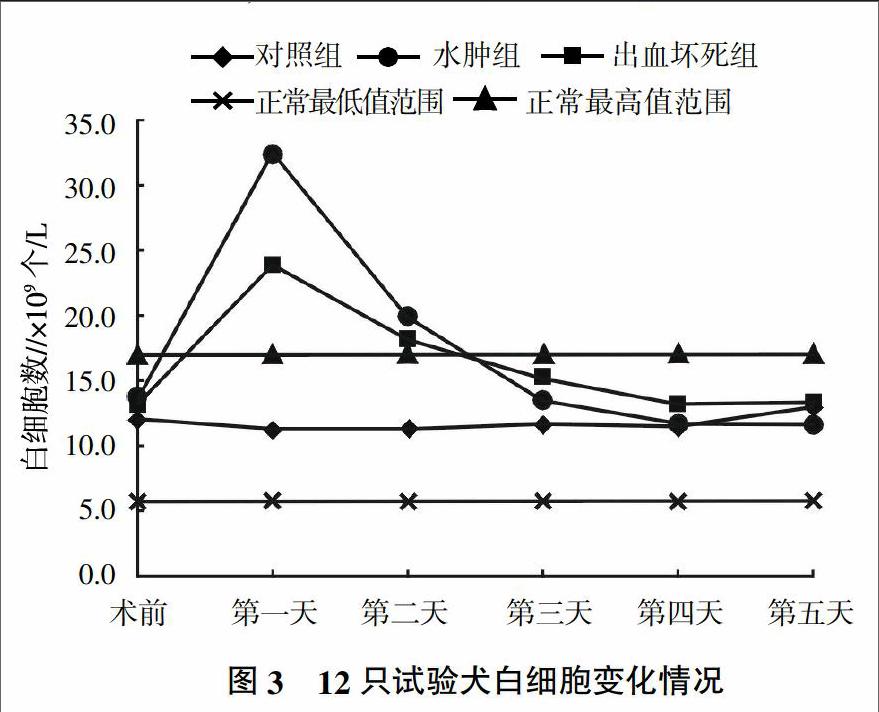
由图3可见,B组和C组在术后第一天白细胞都有不同程度的升高,在術后第二天、第三天均有不同程度的降低。通过采血检测白细胞值,发现水肿型和出血坏死型胰腺炎犬白细胞在术后12 h开始上升[正常范围(6~17)×109个/L],在15~40 h之间水平较高[(20~50)×109个/L],在36~40 h开始下降。这表明白细胞往往在急性胰腺炎发生后12 h才表现明显的升高,持续30 h左右高于正常值。
从图4中可见,两个试验组中,犬的淋巴细胞于术后第1天均明显降低,术后第3天回复正常范围(术前范围)。
由图5可见,试验组犬的淀粉酶水平在术后均有不同程度的升高。
2.4 肉眼观察病理变化
于造模后第7天,分别处死对照组、水肿组、出血坏死组犬各一只,取胰腺组织。健康犬胰腺组织质地粉红色,体积大小无变化,无坏死结节,无肉眼可见病理变化;水肿型胰腺炎犬胰腺组织体积大小无变化,无坏死结节,但有30%胰腺组织叶间隙轻微增宽,胰腺小叶界限明显;出血坏死型胰腺炎犬胰腺组织体积整体缩小,有60%肉眼可见坏死灶,为白色钙化灶,胰腺小叶萎缩。
3 讨论
3.1 临床病例
调查结果显示,急性胰腺炎患犬中雄性占65.4%,雌性占34.6%,这和相关报道相一致[4]。从图1中可以看出,虽然中老年犬仍是急性胰腺炎的高发犬,但是和以往相关统计[4、5]相比,犬急性胰腺炎发生的年龄有明显的提前趋势。
表1显示,26例临床病例中,有12例白细胞处于正常范围内。且这12例病例经过治疗均预后良好。4例白细胞小于正常范围的犬中,有3例死亡。2例白细胞大于40×109个/L的病犬均死亡。而白细胞介于(17~40)×109个/L范围之间的病犬,治疗时间较长,最后均以痊愈为转归。这说明病程发展过程中,白细胞高于40×109个/L的病犬和低于6×109个/L的病犬,均处于病程的危险期。若病犬白细胞一直处于高于40×109个/L或低于6×109个/L的水平,则预后不良。
3.2 造模动物
犬急性胰腺炎是一种临床上较为复杂的疾病,且当前研究还未发现特异性的指标能动态指示病程变化,兽医工作者仅能通过对炎症细胞变化、淀粉酶变化和病犬的整体精神状态来粗略评估犬急性胰腺炎的病程发展[6]。本次试验结果能给评估犬急性胰腺炎病程发展提供一些参考。
在犬急性胰腺炎发生时,白细胞会明显升高,但尚未精确到具体时间。由图3可见,水肿型和出血坏死型胰腺炎犬白细胞在术后12 h开始上升[正常范围(6~17)×109个/L],在15~40 h之间水平较高[(20~50)×109个/L],在36~40 h开始下降。这表明白细胞往往在急性胰腺炎发生后12 h才表现明显的数值升高,持续30 h左右高于正常值。且当白细胞恢复至正常值,并不代表病犬已经自愈,可能胰腺组织已造成不可逆的损坏。
在临床诊断中,兽医工作者往往未把淋巴细胞作为评估犬急性胰腺炎病情发展的参考指标。笔者通过试验发现,淋巴细胞数值变化也能从一定程度上反映犬急性胰腺炎的病程发展。由图4中可以看出,两个试验组犬的淋巴细胞于术后第1天均明显降低,术后第3天回复正常范围(术前范围)。这表明,淋巴细胞参与了急性胰腺炎的炎症反应,这与杨斌[7]报道的情况相一致。但是对于淋巴细胞的免疫调节在急性胰腺炎中的具体作用还需进一步研究。
由图5可见,试验组犬的淀粉酶水平在术后均有不同程度的升高。笔者通过采血检测淀粉酶值,发现淀粉酶在术后12 h开始高于1 500 U/L[正常范围(500~1 500)U/L],水肿型急性胰腺炎病犬于术后18~50 h达到一个高峰,术后70~90 h开始降至接近1 500 U/L,术后第4天回到正常范围;坏死型急性胰腺炎病犬于术后18~98 h达到一个高峰,术后120 h开始接近1 500 U/L,术后一周部分回到正常值。这表明,水肿型胰腺炎病犬的淀粉酶水平比出血坏死型急性胰腺炎病犬的淀粉酶水平更早恢复至正常范围。但由于正常情况下检测到的血清淀粉酶只有少部分是胰淀粉酶,淀粉酶浓度与急性胰腺炎严重程度不成正相关,所以淀粉酶浓度降至正常范围并不能表明患犬痊愈[8]。
4 小结
通过结合临床病例和造模试验可以得出结论:当急性胰腺炎病犬的白细胞处于一个高水平,且维持时间超过40 h时,病程处于危险期,且消化系统造成了一定程度上的不可逆的损伤,且有预后不良的可能;淋巴细胞在急性胰腺炎初期会明显降低;当淀粉酶高于1 500 U/L时,据发病时间已有12 h,当CPL检验结果呈阳性,且淀粉酶在正常范围内时,据发病已有90 h。
总结以上三个指标对评估急性胰腺炎病程发展的意义可以发现,各个指标有各自的作用,但又有一定的限制。血清淀粉酶对于诊断急性胰腺炎具有一定意义,但由于该指标在病程发展过程中先升高后降低,所以单独依据此指标并不能判断急性胰腺炎病程发展,应结合CPL阳性结果来判断病程发展。白细胞在急性胰腺炎前期会一直处于高于正常范围的水平,而淋巴细胞仅在发病24 h内明显降低,两者相结合,能评估急性胰腺炎的病程是否在初期。三者联合应用于临床诊断治疗中,能帮助兽医工作者对急性胰腺炎病程发展做出更准确有效的判断。
参考文献:
[1] 谷武阳,谭 敏,彭广能,等.犬急性胰腺炎的模型构建及清开灵治疗试验[J].中国兽医杂志,2015,51(2):68-70.
[2] 张卫宪,马立新,杨 丽,等.犬胰腺炎的诊断和防治研究进展[J].河南畜牧兽医,2011,32(12):9-10.
[3] 谭 敏.犬急性胰腺炎病理模型的构建及临床治疗研究[D].四川雅安:四川农业大学,2008.
[4] 李泽盛,郭亚楠,陈柏良,等.犬急性胰腺炎并发急性肾衰竭临床病例分析[J].动物医学进展,2015,36(12):182-184.
[5] 朱 国,师福山,张海彬.犬急性胰腺炎流行病学调查[J].浙江畜牧兽医,2016,41(3):35-38.
[6] 陈宇驰.cPL双抗体夹心ELISA检测犬急性胰腺炎方法的建立与应用[D].南京:南京农业大学,2011.
[7] 杨 斌.T、B淋巴细胞对急性胰腺炎的作用及其免疫治疗[D]. 西安:第四军医大学,2013.
[8] 田学昌,刘吉盛,曲 畅,等.联合检验血清淀粉酶、脂肪酶与C反应蛋白在急性胰腺炎早期诊断中价值[J].现代仪器与医疗,2015,21(2):76-78.
