缝隙连接蛋白43的表达与胃癌患者临床病理特征及预后的相关性
2022-03-10顾慧杰李卓群孙启棣徐海荣韩保卫王云帅
顾慧杰 李卓群 孙启棣 徐海荣 韩保卫 王云帅 寇 玉
胃癌起源于胃黏膜上皮,在我国各种恶性肿瘤中发病率居首位。胃癌发病有明显的地域性差别,并受到不同基因的影响。因此,有必要研究能准确反映胃癌生物学特性的标志物,为胃癌提供新的分子诊断和预后标志,并为靶向治疗胃癌提供新的方向。
近年来,连接蛋白的失调和通过缝隙连接的细胞间通讯被证明与癌症的发病机制有关[1]。缝隙连接存在于人体的所有细胞中,是细胞通讯的重要组成部分,由6个连接蛋白形成的2个相对的半细胞膜组成,是2个细胞之间小分子、多肽、离子、内源性核酸和其他细胞代谢物传递和交换的重要通道。因此,异常的缝隙连接表达可以改变细胞代谢,促进癌症的迁移和侵袭[2]。Cx43是研究最为丰富和广泛的结合蛋白,根据其分子量43 kDa而命名。在各种类型的癌症中CX43的表达常常下调,同时缝隙连接功能也被抑制,因此cx43常被认为是一种抑癌因子[1]。有研究发现CX43表达可作为喉鳞状细胞癌预后的一种有用的检测指标[3]。此外,Maria等经研究发现高表达Cx43的乳腺癌患者生存率高于低表达患者,低表达Cx43与患者的预后不良相关[4]。然而目前Cx43表达水平与胃癌患者预后相关性的报道较少,所以探讨Cx43在胃癌组织中的表达与临床病理特征和预后的相关性,可能为胃癌患者的临床诊断和预后提供新的依据。
1 材料与方法
1.1 病例及标本
收集2015年2月至2017年1月于郑州大学附属洛阳中心医院胃肠外科行手术治疗的68例胃癌患者的癌组织和癌旁正常组织(离肿瘤切缘>5 cm)。患者中男性54名、女性14名,随访至2020年8月。术后对晚期胃癌患者进行常规化疗,未对患者进行放疗。本研究病例纳入标准包括:①组织学证实的腺癌;②无胃切除术史或其他恶性肿瘤病史;③无其他病理类型的胃肿瘤,如胃间质瘤;④有完整的临床病理和生存资料;⑤患者未接受新辅助化疗;⑥无远处转移。本研究经洛阳市中心医院人文学科机构委员会批准。所有研究参与者或其法定监护人在研究入组前都签署了知情同意书。
临床病理资料:前瞻性地记录临床病理资料,以便进行回顾性分析。 68例胃癌患者的临床病理资料包括年龄、性别、原发肿瘤的大小、肿瘤浸润深度、淋巴结转移、远处转移、TNM分期、分化程度。对照组由68个石蜡包埋组织块的癌旁胃正常组织(>5厘米肿瘤切缘)组成。
1.2 免疫组织化学
用获得的标本进行了Cx43的免疫组化染色,标本由10%福尔马林固定的石蜡包埋组织的连续4 μm厚切片组成。脱蜡并复水后将石蜡切片组织置于3%过氧化氢(H2O2)中10 min以灭活内源性过氧化物酶,接着在微波炉高火煮沸3 min以降低非特异性结合的活性。 然后用5%BSA孵育30 min以封闭非特异性结合,用兔源Cx43抗体(#3512S;CST生物技术公司,美国,最终稀释1∶500)在4 ℃孵育过夜。缓冲液冲洗3次,二抗是生物素化羊抗兔IgG(SA1022,博士德生物技术有限公司,美国),接着用链霉亲和素-生物素结合酶室温孵育30 min,缓冲液冲洗后用DAB(AR1022,博士德生物技术有限公司,美国)显色并用苏木精复染,最后脱水并用中性树脂封片。
1.3 免疫组化分析与评价
在光镜下细胞质被染色为深棕色的肿瘤细胞被认为是Cx43IHC染色阳性。通过染色强度和染色细胞百分比定量Cx43的表达。未染色细胞评分为0分,1分为弱染色强度,2分为中等染色强度,3分代表较强的染色强度。通过ImageJ软件评估了染色阳性细胞的百分比(0~100)。Cx43表达的最终分数等于两种类型分数相乘(0~300)。根据患者生存状态绘制ROC曲线发现Cx43表达水平在5.43时约登指数最大,见图1。以5.43为截点将68例患者Cx43表达分为阳性组(n=35)及阴性组(n=33)。

图1 ROC曲线
1.4 统计分析
采用SPSS19.0软件进行统计分析。通过卡方检验分析Cx43表达与临床病理特征的相关性。采用Kaplan-Meier分析构建患者的无病生存曲线和总生存曲线。运用Cox回归分析评价胃癌患者预后的独立影响因素。P<0.05被认为具有统计学意义。
2 结果
2.1 胃癌组织中Cx43的表达情况
免疫组化结果显示,癌旁胃正常组织Cx43染色较深,而胃癌组织的Cx43染色则较浅,见图2。此外,根据免疫组化评分,68例胃癌患者组织中35例患者Cx43的表达为阳性,阳性率为51.47%;癌旁胃正常组织则有65例Cx43表达为阳性,阳性率为95.58%,两者Cx43表达差异有统计学意义(χ2=-11.799,P<0.001)。
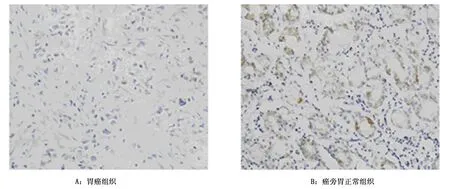
图2 Cx43在胃癌组织及癌旁胃正常组织中的表达(DAB X200)
2.2 胃癌患者Cx43的表达与临床病理特征的相关性
对68例肿瘤标本的免疫组化染色结果分析表明,Cx43表达水平与肿瘤最大直径(P=0.004)、肿瘤浸润深度存在显著相关(P=0.012),而与其他临床病理特征之间没有明显的相关性,包括患者的年龄、性别、肿瘤的分化程度及淋巴结转移或远处转移、TNM分期等,见表1。
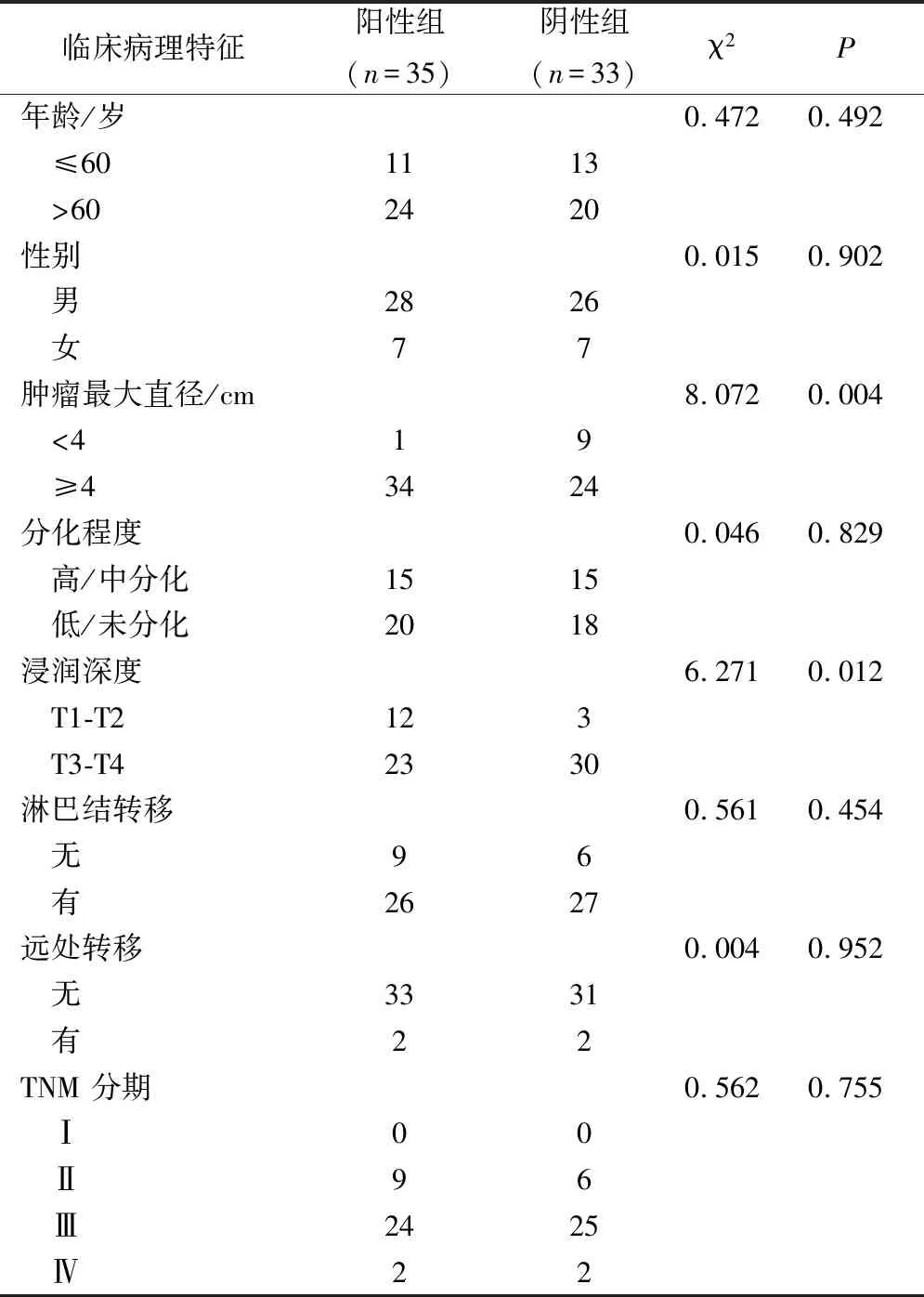
表1 68例胃癌患者Cx43表达与临床病理变量的相关性分析/例
2.3 Cx43表达与胃癌患者预后的关系
通过Kaplan- Meier分析评价Cx43表达和临床病理特征对无病生存期及总生存期的影响。结果表明,Cx43低表达组5年生存率为3%,Cx43高表达组为25.7%,低表达Cx43提示更差的预后(P<0.001,见图3)。
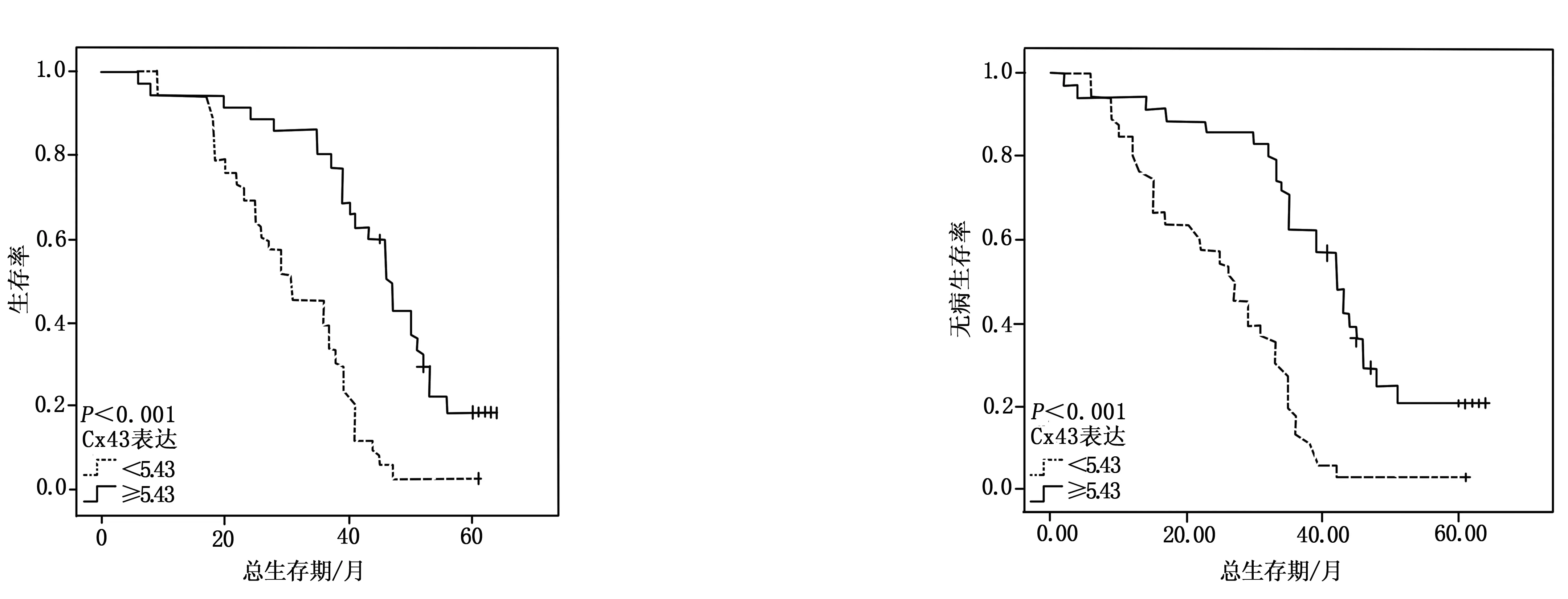
图3 Cx43表达与患者预后的关系
2.4 胃癌患者预后相关影响因素分析
对68例患者无病生存期及总生存期的单因素分析发现,Cx43表达、肿瘤最大直径、分化程度、肿瘤浸润深度、TNM分期、淋巴结转移及远处转移与患者的无病生存期及总生存期相关(P均<0.05,见表2)。进一步Cox回归分析表明,Cx43表达、肿瘤最大直径、肿瘤分化程度及浸润深度与无病生存期及总生存期密切相关,见表3。这提示,Cx43的表达、肿瘤最大直径、肿瘤分化程度及浸润深度可作为胃癌患者的独立预后指标。
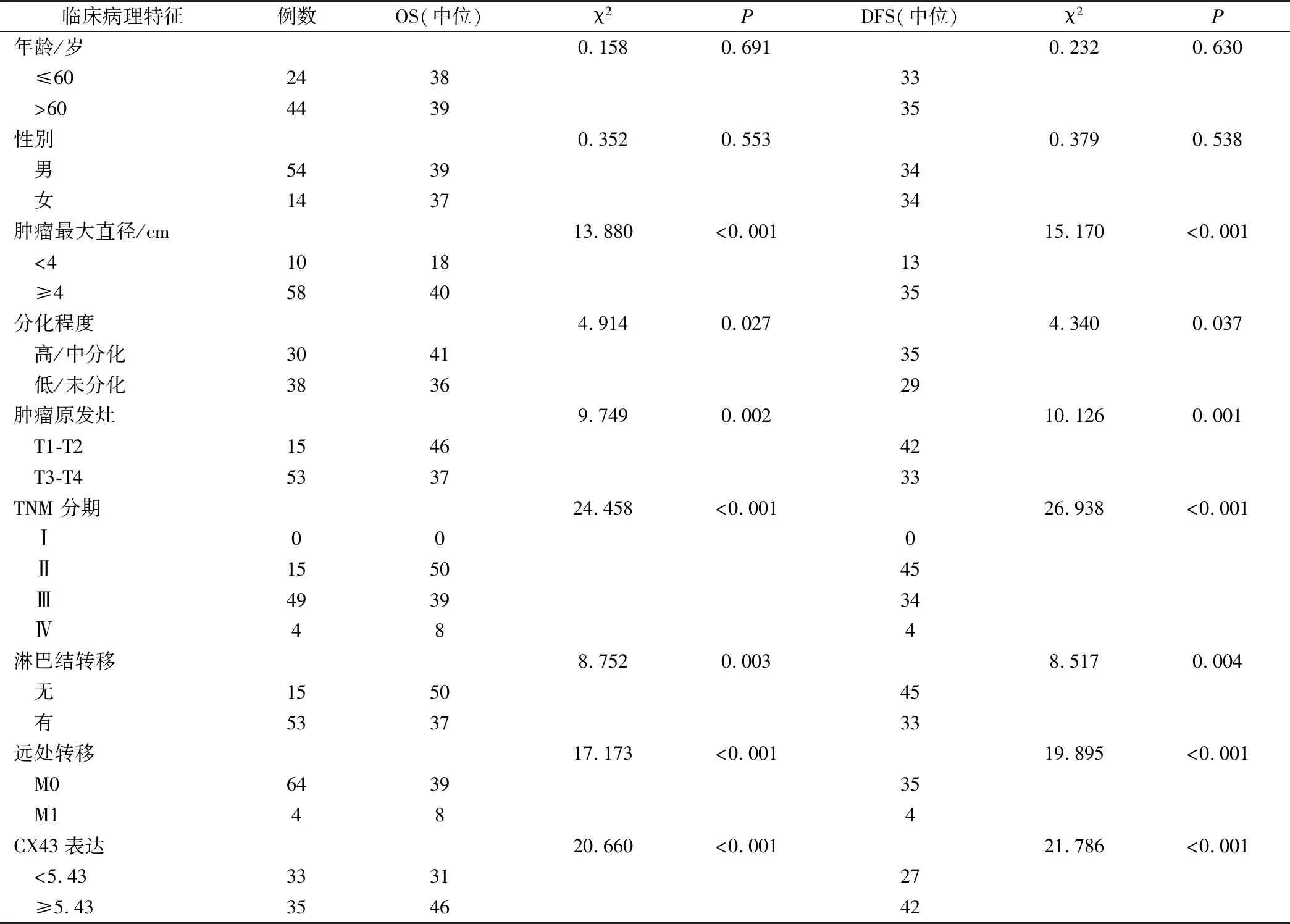
表2 68例胃癌患者总生存期及无病生存期影响因素的单因素分析/月
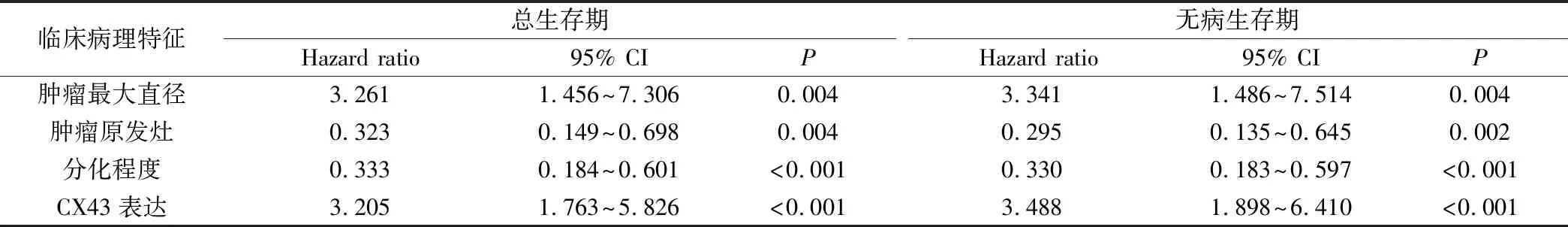
表3 68例胃癌患者总生存期、无病生存期的影响因素的多因素分析
3 讨论
已有研究表明,鼻咽癌、甲状腺癌、喉鳞状细胞癌、星形细胞瘤、黑色素瘤及慢性B细胞白血病患者的Cx43表达水平降低,低表达水平Cx43与患者的恶性程度及预后不良有关[3,5-7]。一项关于120例胃癌患者的研究发现,胃正常组织中Cx43的表达高于胃癌组织,同时Western印记实验也证实了同样的结果[8]。这与我们的实验结果相同,但作者并未对Cx43表达与胃癌患者的预后相关性进行研究分析。因此,本文对Cx43表达与胃癌患者的临床病理特征及预后相关性进行了研究。
大量的实验数据表明缝隙连接蛋白的失调及通过缝隙连接的细胞间通讯与肿瘤的发生发展有关[9]。 我们的结果表明,胃癌患者Cx43表达阳性率低于癌旁胃正常组织(51.47%VS 95.58%,P<0.001),这与前文所说的Cx43在其他肿瘤中的低表达特征相一致。罗吉琴等通过分析鼻咽癌组织中Cx43、Cx26的表达与患者临床病理特征的相关性后发现Cx43表达与T分期、临床分期及淋巴结转移相关,而与性别、年龄、病理类型、病灶大小无关[6]。郭爱萍等经研究发现在非小细胞肺癌中Cx43的表达与病理类型、分化程度及Ki-67表达有关[10]。Shao等经研究发现通过逆转录小干扰RNA可以下调Cx43促进乳腺癌细胞的侵袭性表型[11]。这提示低表达Cx43可能与胃癌患者的发生发展相关。为了进一步证明我们的推测,我们分析了68例胃癌患者Cx43表达与临床病理特征的相关性。结果表明,Cx43表达与肿瘤最大直径、肿瘤浸润深度存在显著相关,而与其他临床病理特征之间没有明显的相关性,包括患者的年龄、性别、肿瘤的分化程度及淋巴结转移或远处转移、TNM分期等。Cx43低表达主要出现在肿瘤体积较大、浸润较深的组织中,这些结果验证了我们关于Cx43参与肿瘤发生发展过程的推测。
文献报道,Cx43表达还与恶性肿瘤的预后相关。王俊岭等经研究发现低表达Cx43是影响黑色素瘤患者预后的影响因素[7]。董郁红指出,Skp2和 Cx43可作为甲状腺乳头状癌恶性程度指标及预后指标[12]。为了探讨Cx43与胃癌患者预后的相关性,我们通过Kaplan-Meier分析不同Cx43表达的胃癌患者发现,低表达Cx43患者的无病生存率及总生存率明显低于高表达Cx43患者,提示Cx43表达情况可作为胃癌患者的预后指标。进一步C0X回归分析表明Cx43表达、肿瘤最大直径、肿瘤分化程度及浸润深度均可作为胃癌患者的独立预后指标。因此,临床医师可根据胃癌患者Cx43表达情况为患者制定不同的术后诊疗方案,低表达Cx43往往提示更差的预后,需要进一步的术后辅助治疗并加强复查。
然而,有研究指出Cx43在原发性骨肿瘤中作为肿瘤抑制因子的同时也可作为肿瘤促进因子在肿瘤的发展中起着拮抗作用[13],所以Cx43在胃癌发展过程中的具体作用机制还有待进一步的研究。总的来说,本研究表明在胃癌组织中Cx43的表达降低且这种低表达可能与肿瘤的侵袭转移相关。近年来,针对关键分子驱动因素的靶向治疗已经成为临床治疗癌症的重要方式,Cx43可被用作潜在的生物标志物,为胃癌的临床治疗及预后分析提供新的方向。
