两阶段转速调控对纳豆芽胞杆菌合成维生素K2的影响
2022-03-07冯静静周梦洁胡汶松薛正莲
冯静静,吴 静,李 伟,周梦洁,胡汶松,汪 剑,薛正莲,2,王 洲,2,刘 艳*,2
(1.安徽工程大学 生物与食品工程学院,安徽 芜湖 241000;2.微生物发酵安徽省工程研究中心,安徽 芜湖 241000)
维生素K2(VK2,MK-n)是一种重要的脂溶性维生素,在血液凝固和预防骨质疏松症中发挥重要作用,并具有降低与心血管相关疾病的风险,以及抗肿瘤、改善Ⅱ型糖尿病患者的骨质、改善早期膝骨关节炎、保护肾功能等作用[1-3]。据统计,由于人口老龄化、久坐不动和维生素D缺乏症日益严峻,导致2010年全世界约900万例骨折,因此研究预防骨质疏松的高效率产品迫在眉睫[4]。而维生素K2作为预防骨质疏松症的有效药物,其价格昂贵、产量低、供不应求。维生素K2也被称为甲萘醌(menaquinoe),它的萘醌环与4~13个异戊二烯单元组成的可变侧链相连,生成一系列被称为MK-n的异构体,其中n代表异戊二烯单元的个数[5]。
甲萘醌是呼吸链中重要的电子传递载体,因此很多微生物都可以产生甲萘醌。不同的菌株可以产生不同类型的甲萘醌[6],纳豆芽胞杆菌(Bacillus subtilis natto,Bsn)能够产生MK-4~MK-8的MK同系物,MK-7占比可达96%,而黄杆菌主要产生MK-4和MK-6,一些肠道微生物如乳球菌、肠球菌也可以产生MKs[7-9]。纳豆芽胞杆菌具有食用安全的特点以及发酵产生的MK-7含量高,被认为是微生物生产MK-7最主要和最有发展潜力的菌株[10]。近年来维生素K2(MK-7)的制备和产业化已成为研究的热点。目前,获取维生素K2的方法主要有微生物发酵法和化学合成法[11],化学合成法通常具有产生低活性的顺式异构体、副产物以及造成环境污染等弊端,而微生物发酵法所得产品的生物活性较高,因此广受青睐。
发酵动力学具体研究发酵过程中各个参数之间的关系,包括细胞生长、基质消耗、产物生成速率之间的变化规律以及环境因素对三者的影响[12-13],三者相辅相成,形成错综复杂的体系。张敏[14]等人将发酵动力学模型应用于粪肠乳酸球菌产γ-氨基丁酸(GABA),使GABA产量提高了60.1%。圣亚春[15]等人基于发酵动力学的分析,使丁醇产量提升了210.3%。通过发酵动力学分析,能够深入研究微生物的新陈代谢规律,为后续产业化的过程控制以及工艺的优化提供理论支撑。
生物膜(biofilm,BF)是具有高度组织性的微生态系统,是细菌由浮游的单细胞状态转变为静止的多细胞状态的过程,随后的生长导致了有组织的群落以及细胞分化[16]。它能够附着在非生物介质的表面以及气液相交的界面上,分泌的细胞外聚合物(extracellular poly-mericsubatances,EPS)主要包括胞外多糖、胞外蛋白、胞外DNA(extracellular DNA,eDNA),以此来增强对外界不利环境的抗性以及耐受能力[17-18]。有研究提到枯草芽孢杆菌生物膜的形成有利于维生素K2的产生[19]。静置发酵能够产生大量疏水性的生物膜,作者通过分析不同条件下(0、200 r/min)发酵进程曲线与发酵动力学参数,以及对不同时间点的发酵液进行稀释涂布和扫描电镜观察菌体形态变化,明确菌体生长与产物合成之间的关系,根据结果提出分阶段转速调控的方法,并对其发酵条件(温度、转速、初始pH和时间)进行正交优化,进一步提高纳豆芽胞杆菌合成维生素K2的产量,同时也为大规模生产维生素K2提供理论支撑。
1 材料与方法
1.1 菌种
纳豆芽胞杆菌GMCC2108 (Bacillus subtilis natto):由作者所在实验室保藏。
1.2 试剂
正己烷、异丙醇、二氯甲烷、甲醇(均为色谱纯)、冰醋酸、结晶紫、乙醇、戊二醛(均为分析纯):购于上海生工。
萃取液为V正己烷∶V异丙醇=2∶1
流动相为V二氯甲烷∶V甲醇=1∶9
1.3 培养基
固体培养基(g/L):胰蛋白胨10,氯化钠10,酵母粉5,琼脂20;pH 7.0,121℃灭菌20 min。
种子培养基(g/L):胰蛋白胨10,氯化钠10,酵母粉5;pH 7.0,121℃灭菌20 min。
发酵培养基(g/L):大豆蛋白胨50,酵母粉20,甘油50,K2HPO43.86,KH2PO41.62;121℃灭菌20 min。
1.4 培养方法
将在LB固体培养基上活化的纳豆芽胞杆菌接种于种子培养基中,37℃、200 r/min培养至对数生长期,以体积分数2%将种子液接入50 mL/250 mL的摇瓶中,37℃于0 r/min与200 r/min分别发酵。
1.5 分析方法
1.5.1 生物量的测定按照1.4的培养方法,发酵至相应时间,将菌液全部吸出离心,去除培养基,用PBS(7.4)缓冲液洗涤2~3遍,以完全去除培养基,离心称湿质量,即为生物量(g/L)。
1.5.2 不同转速条件下发酵前期菌落数比较在不同转速条件下培养至所需要的时间,将发酵液稀释至适当的浓度涂布,在相同浓度下比较菌落数量。
1.5.3 维生素K2产量的测定维生素K2标准曲线以及样品的测定参照文献[19]。
1.5.4 甘油残余量的测定甘油标准曲线的绘制以及样品的测定参照文献[20]。
1.5.5 扫描电子显微镜样品的制备样品制备参照文献[21]。
1.6 不同转速下发酵动力学模型的建立
1.6.1 菌体生长模型Logistic方程是典型的S形曲线,可以很好地反应菌体浓度的增加对自身生长产生的抑制作用,且达到稳定期后菌体不再生长,纳豆芽胞杆菌的生长过程可以用Logistic方程来描述,公式(1)。
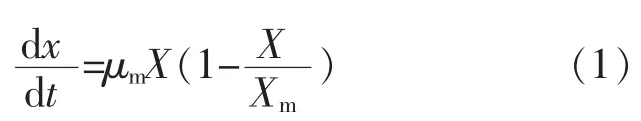
式中:X为生物量,g/L;Xm为最大生物量,g/L;μm为最大比生长速率,h-1;t为发酵时间,h。
1.6.2 产物生成模型根据判断细胞生长与产物生成在时间上的关系,可将其分为3类。当α≠0,β=0时为Ⅰ类发酵,即偶联型发酵;当α≠0,β≠0时,为Ⅱ类发酵,即部分偶联型发酵;当α=0,β≠0时,为Ⅲ类发酵,即非偶联型发酵[14],见公式(2)。
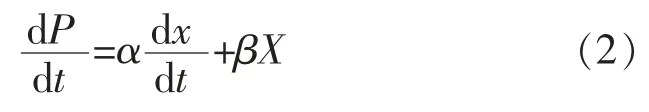
式中:P为维生素K2产量,g/L。
1.6.3 底物消耗模型维生素K2发酵过程中,甘油的消耗主要用于3个方面[22],即甘油分解后产生的3-磷酸-甘油醛可以与丙酮酸通过DXP途径合成维生素K2的异戊二烯侧链部分;供纳豆芽胞杆菌生长;为维生素K2的合成提供前体,促进菌体合成维生素K2。甘油消耗模型见公式(3)。
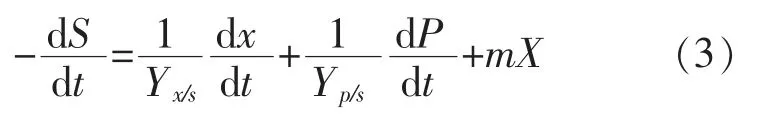
式中:S为甘油质量浓度,g/L;Yx/s为纳豆芽胞杆菌对甘油得率,g/g;Yp/s为发酵产物维生素K2对甘油得率,g/g;m为维持系数,g/(g·h)。
2 结果与分析
2.1 不同转速下维生素K2发酵进程曲线及动力学参数分析
研究了不同转速下(0、200 r/min)菌体生长与产物合成的关系,结果见图1。图中各点为3个平行实验的平均值±标准差,当转速为0时,菌体能够形成很厚的疏水性生物膜(图2),使生物量大大提高,在48 h时生物量达到最大,为(67.08±2.1)g/L。之后随着生物膜的溶解,生物量随之缓慢下降,发酵结束时生物量为(63.21±1.3)g/L,比转速为200 r/min时要高很多。可能的原因是:菌体在形成生物膜之后产生的胞外聚合物对菌体具有保护和抵御外界不良环境的作用,而未形成生物膜的菌体只是一少部分,少量菌体自溶;维生素K2产量在108 h达到最大值,为(21.32±0.08)mg/L。此时,甘油消耗殆尽,无法继续供给菌体生长所需的能量,甘油除了供微生物生长之外,还能够为维生素K2的合成提供前体,促进菌体合成维生素K2;随后维生素K2产量的下降主要体现在两方面[23-24]:一是维生素K2受到光解作用;二是位于细胞膜上的维生素K2在纳豆芽胞杆菌的电子传递系统中作为电子载体参与电子传递链。而pH的升高是由于蛋白质水解和随之而来的氨化作用导致的[25]。
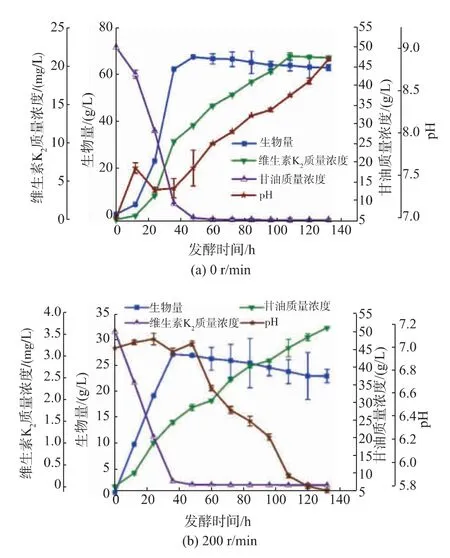
图1 不同恒定转速条件下纳豆芽胞杆菌产维生素K2发酵进程曲线Fig.1 Times courses of VK2 production by Bacillus subtilis natto at various constant rotational speed

图2 生物膜的疏水性Fig.2 Hydrophobicity of biofilms
当增加转速(200 r/min)时,最大生物量为(27.2±0.2)g/L,此时甘油所剩无几,菌体生长受到限制。发酵过程中pH总体趋势降低,可能是由于氮源代谢,氨基酸中的—NH2被利用后导致pH下降,过低的pH影响溶液的化学性质和氧化还原电位,破坏细胞的结构,使菌株对基质的利用速率降低,从而影响产物的合成。发酵结束时维生素K2的产量为(3.68±0.09)mg/L,远低于0 r/min时的产量。纳豆芽胞杆菌发酵时会产生表面活性物质和酶类,可能对细胞结构产生影响,从而使维生素K2的合成受到影响。虽然0 r/min培养的生物膜生物量高于200 r/min培养的生物量,但是将其稀释涂布,发现其菌落数量小于200 r/min下培养的菌落数量,见图3。可能的原因是:摇动培养时,细菌能够很快增殖产生大量菌体;静置发酵时在气液界面产生大量生物膜,其主要成分为胞外多糖、胞外蛋白质和eDNA,生物膜的产生使静置发酵的生物量比摇动培养的生物量高;测定菌落数时用的是发酵液,而静置发酵的菌体大部分被生物膜吸附粘连很难洗脱,因此,静置发酵的菌落数没有摇动培养的菌落数多。
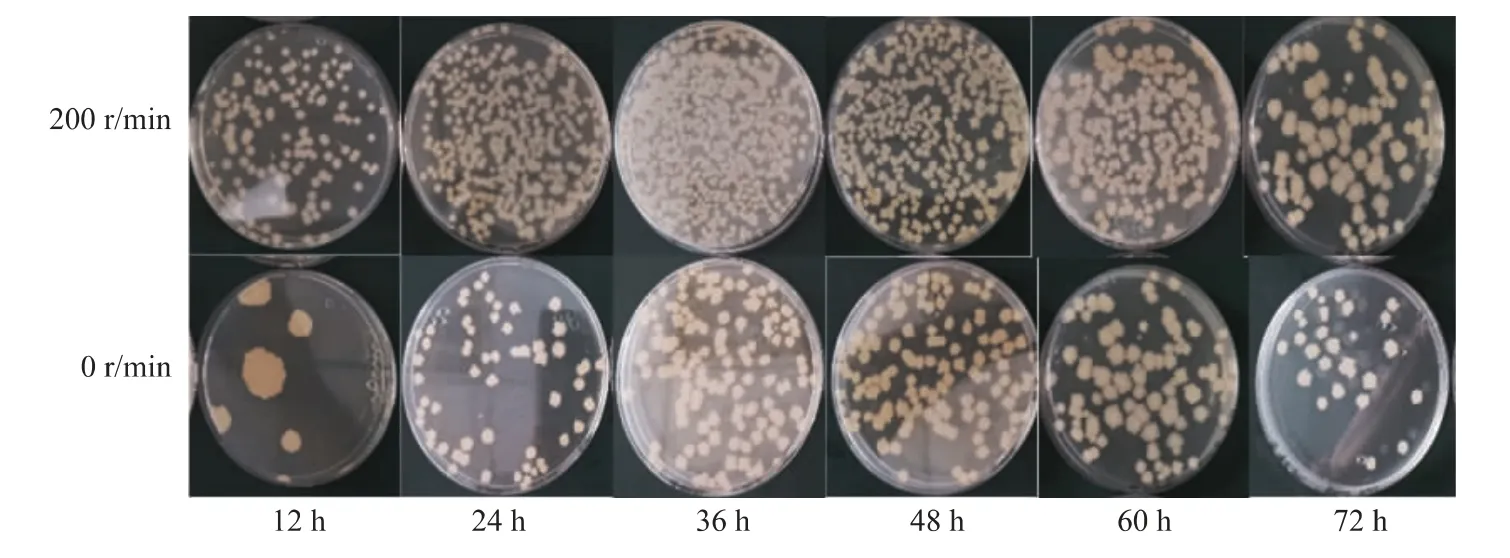
图3 不同转速下培养至12、24、36、48、60、72 h的菌落数量Fig.3 Number of colonies between different rotating speeds at 12,24,36,48,60 and 72 h
综上所述,适合菌体生长的转速和维生素K2合成所需的最适转速并不统一。据文献[26]报道,低转速可以使孢子的产生时间推迟,有利于维生素K2产量的提高,而增加转速可以使氧气的供应量升高,有助于菌体的生长。因此,恒定的转速不能使菌体生长和产物合成同时达到最佳的效果,为使两者同时达到最佳状态,提出分阶段转速控制发酵合成维生素K2。
2.2 不同转速下菌体形态的变化
如图4所示,对不同条件下(0、200 r/min)的菌体形态利用扫描电镜观察发现,0 r/min、24 h时菌体形态正常,箭头所指为胞外聚合物;48 h时菌体表面有轻微褶皱;96 h出现大面积褶皱至发酵结束。而在200 r/min条件下,0~48 h菌体形态正常;72 h菌体开始破裂至发酵结束,但没有破裂的菌体表面润滑平坦。菌体形态产生的差异可能是导致维生素K2产量产生差异的原因之一。

图4 不同固定转速下各时间点的菌体形态Fig.4 Morphology of bacteria at different time points at different constant rotational speed
2.3 不同转速下发酵动力学模型的分析
2.3.1 发酵动力学公式的求解当t=0时,X=X0,P=P0,S=S0,求得的公式(4)、(5)、(6)分别为:
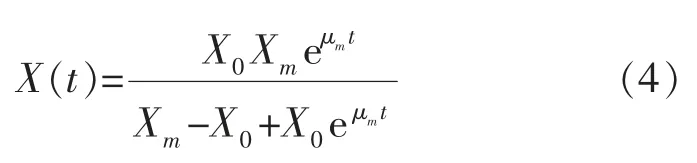
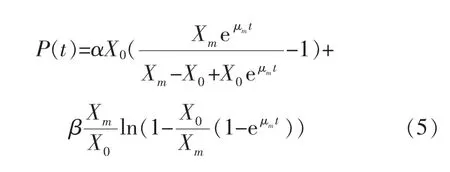
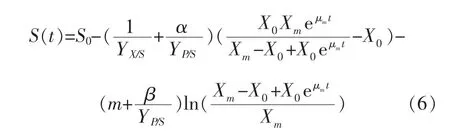
将两种不同转速培养条件下的发酵参数作为实验数据,通过1stOpt软件撰写程序,对上述动力学方程采用通用全局优化算法(First Optimization),不需设置初始值,便能找出最优解,根据实验所得数据求出模型最优参数估计值,结果见表1~2。
由表1~2可知,两种转速培养条件下的α和β值均不为0,说明菌体生长与产物合成之间为部分偶联关系;参数估计值显示静态发酵时μm、YP/S、YX/S大于动态发酵时的值,说明静态发酵有利于维生素K2的生物合成,虽然静态发酵时Xm的值比动态发酵时的值要高很多,但是将两种不同条件下的发酵液进行稀释涂布发现静态培养条件下的菌落数明显少于动态培养的菌落数,可能的原因是静态培养条件下产生的生物膜成分主要为胞外多糖、胞外蛋白以及少量的eDNA,使生物膜生物量升高,但菌体数量少于动态培养,证明维生素K2产量的提高并不是由于生物量的升高而增加,可能是由于产生生物膜之后的一系列生理活动引起的。
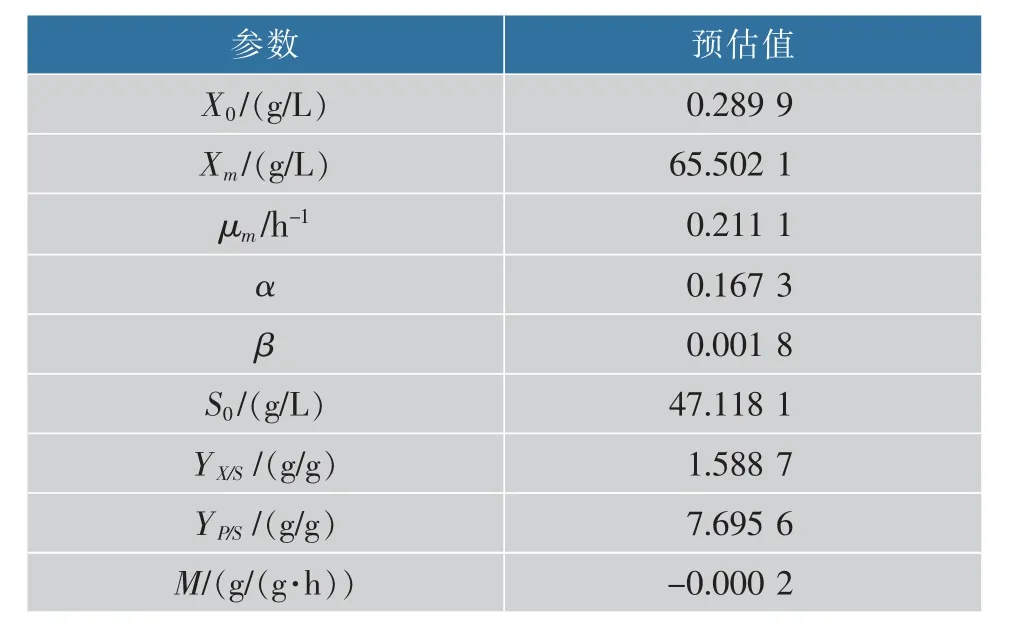
表1 0 r/min发酵动力学参数预估值Table 1 Parameter estimation of the shake flask(0 r/min)fermentation kinetics model
对于要想获得更大的维生素K2产量,通过改变和优化培养条件,尽可能减小维持系数m,使得μ值变大以及更高的菌体生物量X,是提高维生素K2产量行之有效的方法,通过比较静态与动态发酵的实验值与预估值,从表3~4可以看出,细胞生长、产物合成和底物消耗的预估值与实验值接近,说明此模型能较好地反映纳豆芽胞杆菌在250 mL摇瓶中0、200 r/min发酵过程的动力学。
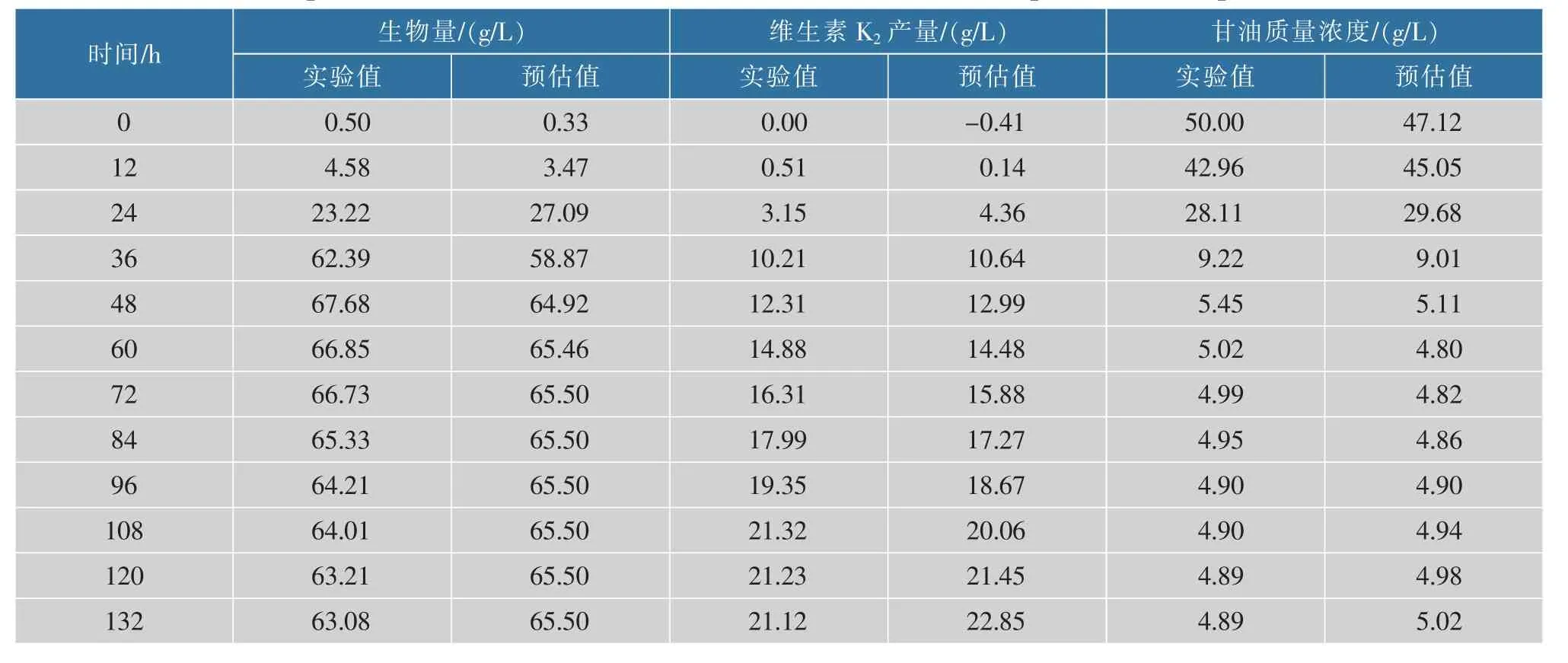
表3 0 r/min发酵实验值与预估值比较Table 3 Experimental value of shake flask(0 r/min)fermentation compared with the predicted value
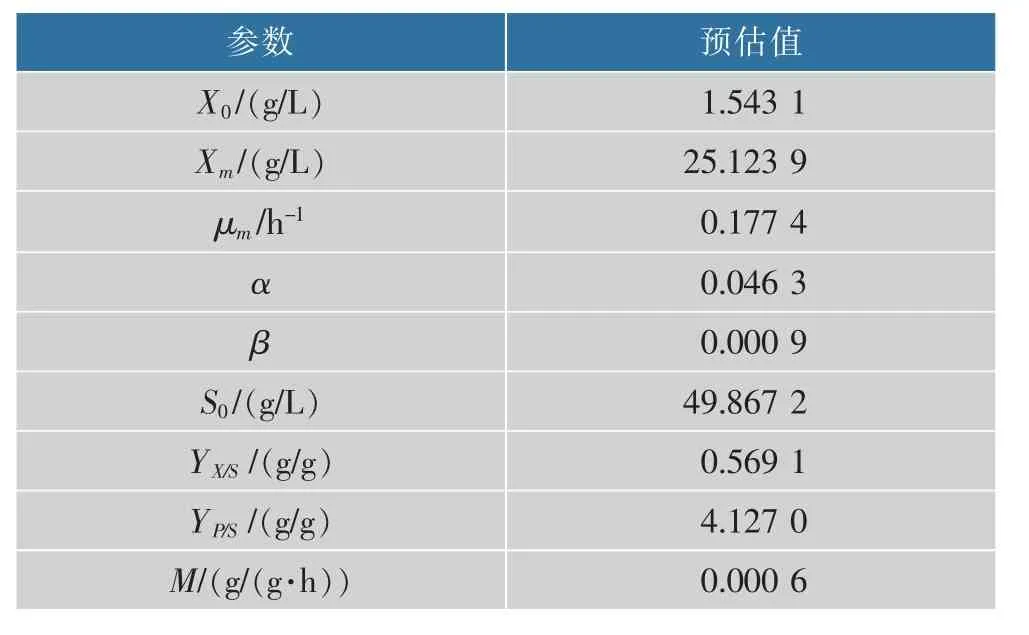
表2 200 r/min发酵动力学参数预估值Table 2 Parameter estimation of the shake flask(200 r/min)fermentation kinetics model
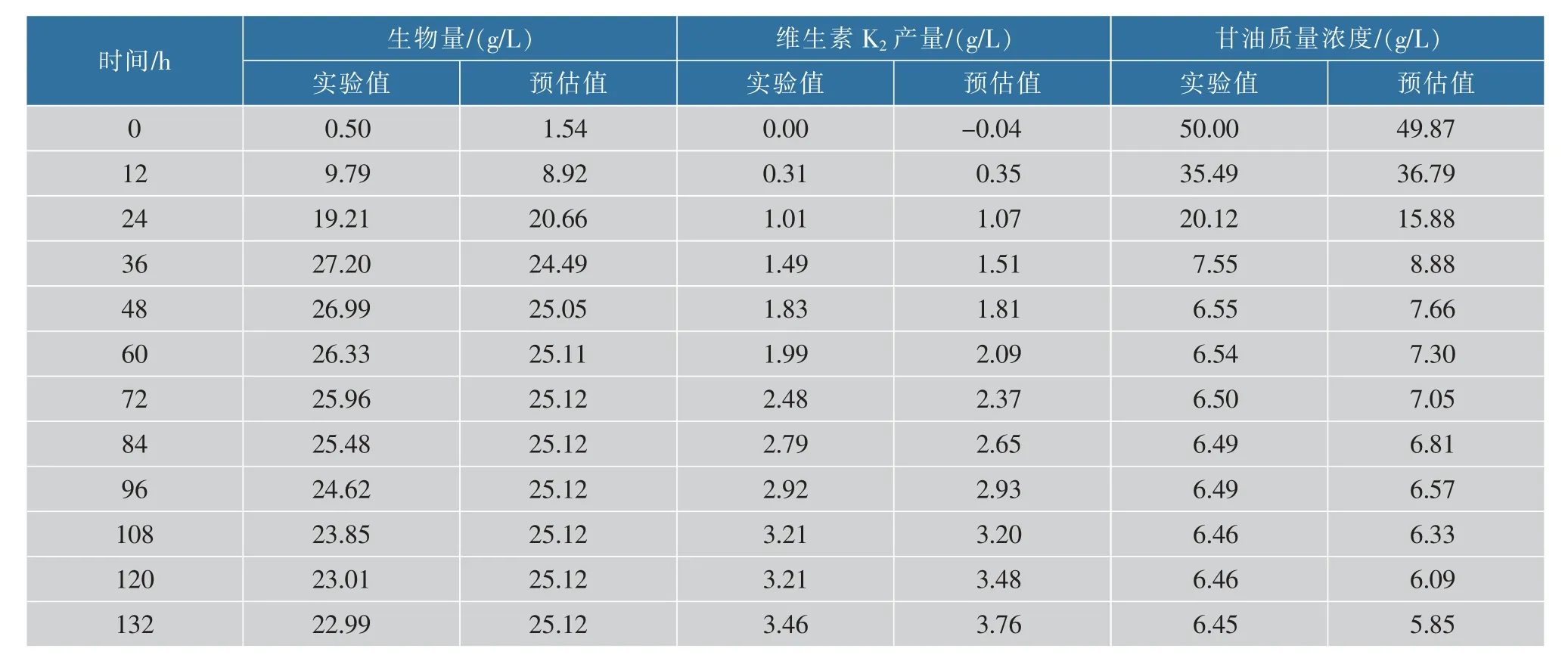
表4 200 r/min发酵实验值与预估值比较Table 4 Experimental value of shake flask(200 r/min)fermentation compared with the predicted value
2.4 两阶段转速控制策略发酵条件的优化
根据上述试验数据结合不同转速下发酵动力学模型的理论验证,证明菌体生长与产物合成之间为部分偶联关系。若在相同的接种体积分数下培养,在发酵前期,0 r/min的菌落数不及200 r/min的菌落数,且生物膜形成的时间长,因此将分阶段转速调控方法用于发酵培养,并对影响其发酵的条件(温度、转速、初始pH、时间)进行正交优化,每个因素4个水平,采用L16(45)正交实验设计方法,每组3个重复。
由表6试验结果的极差分析可知,4个因素影响纳豆芽胞杆菌产维生素K2的次序为D(时间/h)、A(温度/℃)、C(初始pH)、B(转速r/min)。正交实验的最优组合为温度40℃、初始pH 6.5、0~36 h控制转速220 r/min,36~132 h转速为0 r/min,维生素K2的产量达到(35.60±0.13)mg/L,比优化前(0 r/min和200 r/min)分别提高了1.67倍和9.674倍。因此,该方案可行,两阶段转速控制方法可以有效地提高纳豆芽胞杆菌合成维生素K2的能力,为维生素K2的大规模生产提供理论依据。
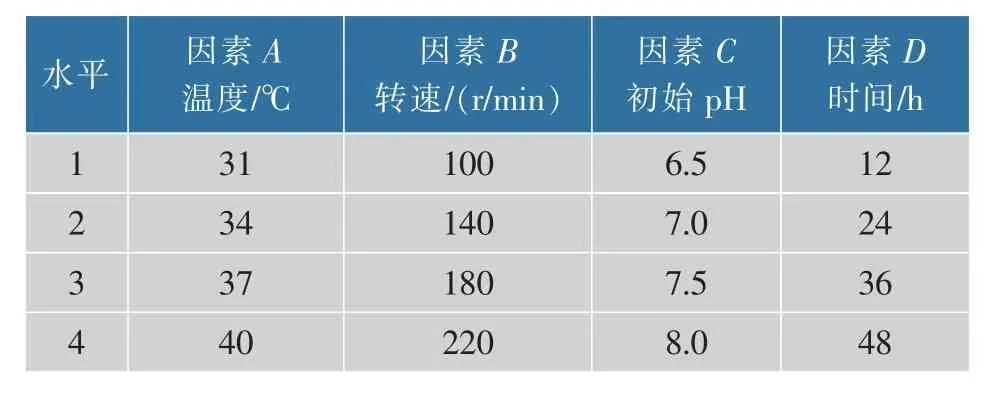
表5 实验因素水平表Table 5 Factor level table
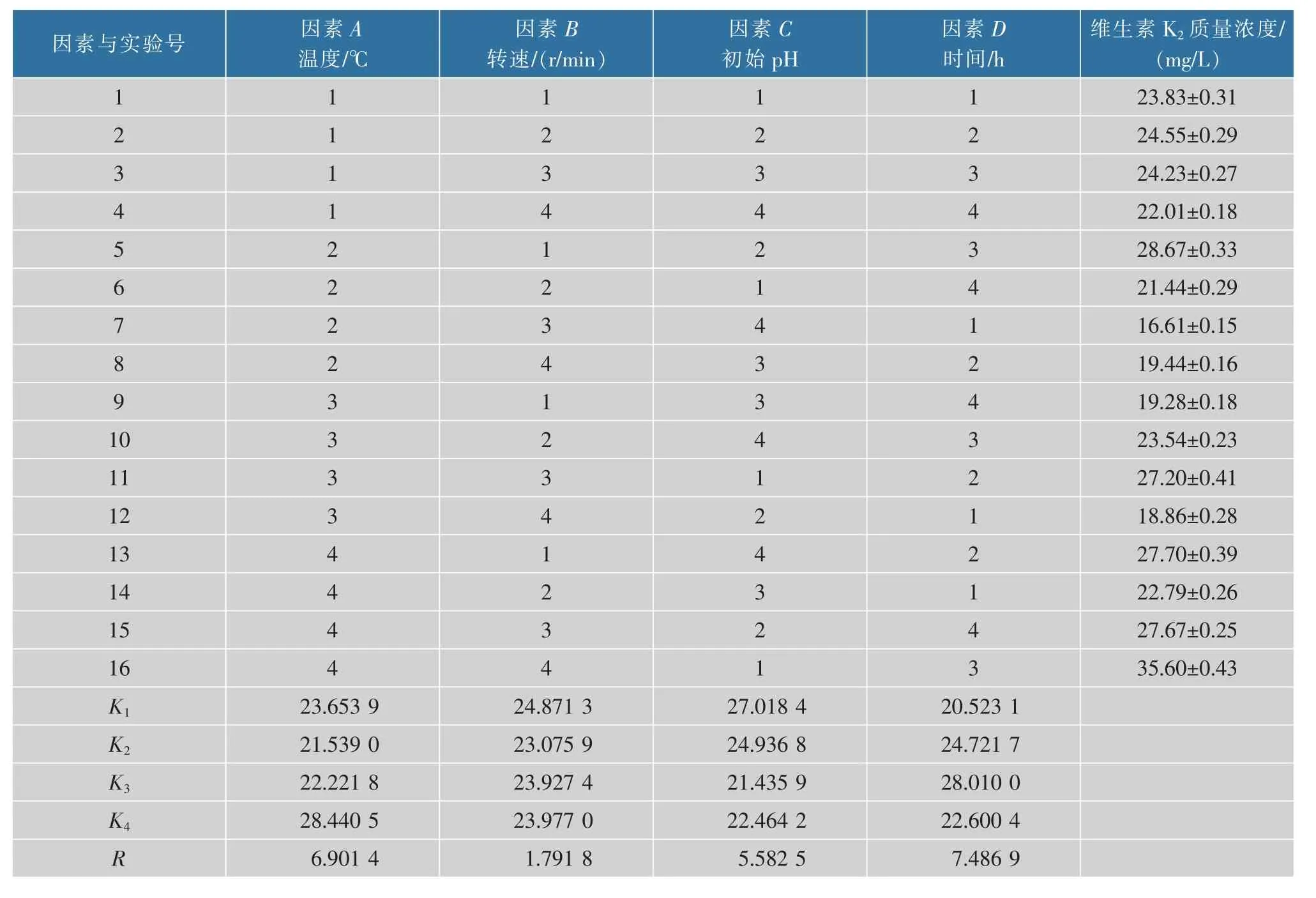
表6 L16(45)正交实验结果Table 6 Result of L16(45)orthogonal test
3 结语
分析不同转速下发酵过程曲线与动力学参数,并用扫描电镜观察菌体的形态变化。扫描电镜结果显示,0 r/min发酵后期菌体表面形态出现明显的褶皱,但菌体很少破裂;对于200 r/min培养的菌体,在72 h菌体出现破裂、自溶现象,但正常菌体表面光滑平整无异常。根据不同条件下菌体生长和产物生成的关系,利用发酵动力学模型证明两者之间的关系为部分偶联型,提出分阶段转速调控的方法进行发酵,并对影响其发酵的条件进行优化。结果表明:温度40℃、初始pH 6.5、0~36 h控制转速220 r/min、36~132 h转速为0 r/min,维生素K2的产量达到(35.60±0.13)mg/L,比优化前(0 r/min和200 r/min)分别提高了1.67倍和9.674倍,这使纳豆芽胞杆菌合成维生素K2的能力显著提高,为进一步大量生产维生素K2提供了依据。
