米曲霉CPA毒素的5-氟色氨酸分子探针研究
2022-03-07胡江春
江 峥,胡江春,王 楠*,2
(1.中国科学院 沈阳应用生态研究所,辽宁 沈阳 110016;2.浙江大学 海洋学院,浙江 舟山 316021;3.中国科学院大学 研究生院,北京 100049)
米曲霉(Aspergillus oryzae)和黄曲霉(A.flavus)均属于曲霉属环绕亚属(Circumdati)。前者在我国和其他东亚国家均有很长的应用于食品酿造和发酵的历史,后者因产生强致癌物质黄曲霉素而成为食品安全的威胁。比较基因组学研究表明,米曲霉和黄曲霉类似于同一个种而非两个独立的种。米曲霉应是在人类长期的驯化过程中通过水平基因转移从黄曲霉的一个类群(Group I)进化而来的,在这个过程中米曲霉逐渐丢失了部分关键基因,造成了不完整的或沉默的黄曲霉素生物合成基因簇[1]。然而,两个菌株往往均含有cpa生物合成基因簇[2],它负责合成一类经常被忽略的真菌毒素CPAs(cyclopiazonic acids)[3-6]。已知的CPA类化合物约30个[7],其中α-CPA是纳摩级的Ca2+-ATP酶抑制剂和神经毒素[8-10]。除酿造食品外,米曲霉经常生长于谷物[11-12]及绝大多数加工食物上[13],造成食品安全隐患。通常对CPA的检测是针对个别CPA生物合成途径产物,如α-CPA[14]。但是,由于CPA常常以多种化学形态存在,客观上对针对性的检测造成了挑战[15]。例如,α-CPA可以继续经P450酶氧化和N—甲基化生成speradine类衍生物[16-18],speradine还可继续在酶促或者自发条件下生成多种氧化及环化产物[19-20]。假设CPA生物合成可以被人为中断在早期步骤,即可实现将所有衍生物进行富集整合的目的。这将使检测目标集中于单个或有限个数的检测对象,从而极大地方便了针对CPAs的检测与监控。
从已知的CPA的生物合成机制来看(图1),CpaS(聚酮合酶-非核糖体肽合成酶,PKS-NRPS)首先利用色氨酸、乙酰辅酶A及丙二酰辅酶A为前体合成第一个中间产物cAATrp[21];CpaD(异戊烯基转移酶)继而催化异戊烯基化反应生成β-CPA[22];β-CPA再通过分子环化反应生成为α-CPA[23-24];后者依次在CpaH(P450单加氧酶)和CpaM(甲基转移酶)的作用下修饰成speradine类衍生物[25];此外,还存在许多speradine继续经氧化的产物,但它们的形成机制尚不清楚。
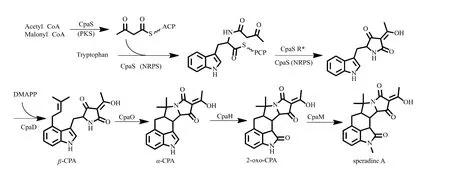
图1 CPA生物合成途径Fig.1 Biosynthetic pathway of CPA
基于该生物合成途径及上述科学假设,作者尝试将卤代色氨酸嵌入CPA生物合成途径,利用其下游酶对底物的特异性造成生物合成的提前中断并引起非天然中间产物的富集,这种表观富集效应将为发展新型特异性CPA毒素检测方法提供科学基础。
1 材料与方法
1.1 材料与设备
1.1.1 菌株及培养基实验菌株A.oryzae HMPF28:分离自大连凌水桥潮间带采集的繁茂海绵中,保存于中科院沈阳应用生态研究及浙江大学海洋学院海洋生物与药物研究所。
培养基:用人工海水配制改良察氏液体培养基(组 分g/dL):蔗 糖3,NaNO30.2,K2HPO40.1,KCl 0.05,MgSO4·7H2O 0.05,FeSO4·7H2O 0.001;自 然pH,固体培养基为上述改良察氏液体培养基中加入2 g/dL琼脂。
人工海水(组分g/dL):CaCl20.147,硼砂0.002 6,KCl 0.068,MgCl21.078,NaCl 2.35,EDTA 0.000 03,NaHCO30.019 6,Na2SiO30.003,Na2SO40.4。
1.1.2 主要仪器与试剂5-Fluoro-L-tryptophan(5-F-Trp):购自Acros公司;色谱甲醇及乙腈:购自国药集团化学试剂有限公司;其他培养基成分:市售分析纯级试剂。高效液相色谱-飞行时间质谱仪:安捷伦6230液质联用仪(HPLC-TOF-MS);色谱柱:Phenomenex C18柱(250 mm×4.6 mm,5μm);固相萃取小柱:PEP-SPE(官能化聚苯乙烯/二乙烯苯固相萃取柱)。
1.2 实验方法
1.2.1 5-F-Trp的Feeding实验与样品预处理从甘油管中取200μL菌株保藏液,均匀涂布到改良察氏固体培养基上,用封口膜将培养皿密封,倒置放于恒温培养箱中培养,28℃培养5 d。将活化后的菌株接种到含100 mL改良察式液体培养基的500 mL三角瓶中,置于恒温培养箱中于28℃、180 r/min培养8 d。利用二次添加法,分别在培养48 h后添加至终浓度为0.5 mmol/L的外源底物5-F-Trp固体与72 h添加至最终浓度为1 mmol/L的外源底物5-FTrp固体,对照组不添加5-F-Trp。所得发酵液经离心除去菌体,上清液中的代谢产物采用PEP-SPE进行富集。将100 mL发酵液通过活化的PEP-SPE小柱进行吸附,先用4 mL超纯水洗去杂质,再用4 mL体积分数80%甲醇溶液洗脱得待分析样品。
1.2.2 LC-MS分析
1)LC-MS分析条件 色谱柱:Phenomenex C18柱(250 mm×4.6 mm,5μm);流量:0.5 mL/min;柱温:35℃;进样量:10μL;流动相:体积分数0.1%甲酸的超纯水(流动相A),色谱乙腈(流动相B)。
2)洗脱条件 0~10 min:体积分数88%流动相A和12%流动相B至65%流动相A和35%流动相B梯度洗脱;10~30 min:65%流动相A和35%流动相B至30%流动相A和70%流动相B梯度洗脱;30~37 min:30%流动相A和70%流动相B至100%流动相B梯度洗脱;37~43 min:100%流动相B等梯度洗脱;43~50 min:88%流动相A和12%流动相B平衡。
正离子总离子流模式扫描,同时检测波长220、285 nm的紫外色谱图,提取色谱法高分辨离子峰对相应代谢物进行定性分析。质谱仪条件:电喷雾离子源(ESI源);离子模式:正离子模式;喷雾电压:3 kV;汽化温度:300℃;毛细管温度:270℃;扫描范围:相对分子质量150~2 000。
2 结果与讨论
2.1 菌株A.oryzae HMP-F28的主要代谢产物
在当前实验条件下,未添加底物的HMP-F28菌株发酵液中可见CPA产物α-CPA(m/z 337.1547[M+H]+,产物6)及β-CPA(m/z 339.170 3[M+H]+,产物5)的典型准分子离子峰,其中α-CPA(m/z 337.1547[M+H]+)为主要代谢产物,见图2。除此之外,还发现二酮哌嗪cyclo(N-methyl-Lue-Trp)(m/z 314.1863[M+H]+,产物1)的产生。这说明米曲霉HMP-F28是一个CPA产生菌株,其主要CPA存在形式为α-CPA,同时也存在speradine型经氧化和甲基化的衍生物3和衍生物4。同时其他类型代谢物相对较少,是一个较理想的检验外源分子探针嵌入目标生物合成途径的细胞体系。
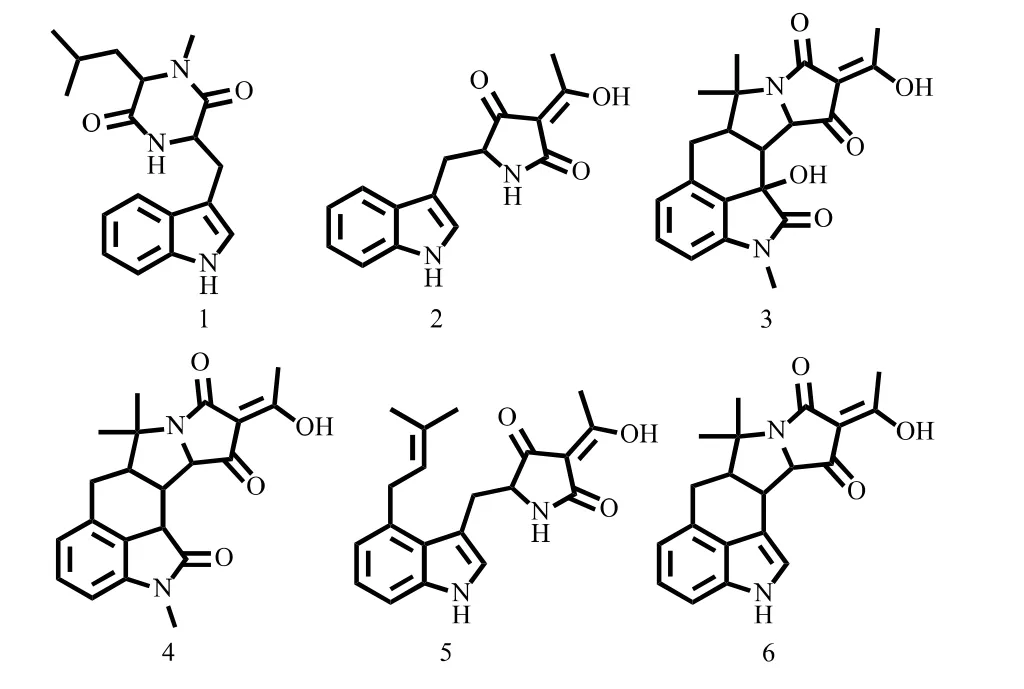
图2 A.oryzae HMP-F28的主要代谢产物Fig.2 Major metabolites produced by A.oryzae HMP-F28
2.2 5-F-Trp分子进入CPA代谢途径的产物
当在HMP-F28发酵培养基中添加5-F-Trp后,可以清楚地观察到原CPA类色谱峰的消失(图3),同时在23.7 min处发现一个新的色谱峰的出现。这说明外源添加物对CPA生物合成途径发挥了预期阻滞作用,使其主要终产物含量急剧减少乃至消失。进一步提取该新色谱峰的高分辨质谱图可知,该代谢物给出了m/z 289.098 3[M+H]+及C15H14FN2O3+准分子离子峰,对应分子式C15H13FN2O3,这与预期的CPA生物合成途径中第一个中间体cAATrp的5-氟代衍生物相符合(图4),因此将该新产物鉴别为5-F-cAATrp(衍生物7)。在添加5-F-Trp底物后,菌株中富集5-F-cAATrp,说明5-F-Trp可以进入CPA生物合成途径并经CpaS酶的催化生成的5-F-cAATrp。但是除了5-F-cAATrp外,其生物合成下游代谢产物并未见明显富集,意味着5-F-cAATrp相对于天然底物cAATrp来说不是一个CpaD合适的底物。这造成5-F-cAATrp从CpaS释放后,立即被CpaD的底物特异性限制,无法再次进入CPA生物合成途径并被继续加工成下游产物。
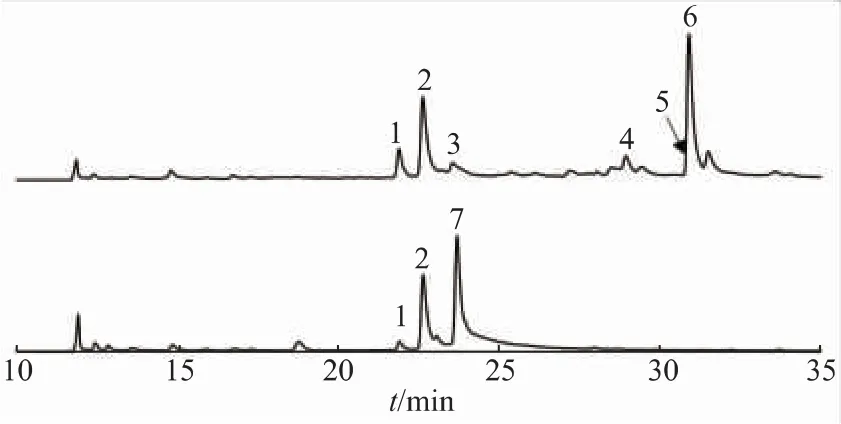
图3 不添加底物(上)及添加5-F-Trp(下)的A.oryzae HMP-F28代谢图谱Fig.3 Metabolic profiles of A.oryzae HMP-F28 without(upper panel)or with(lower panel)the addition of 5-F-Trp
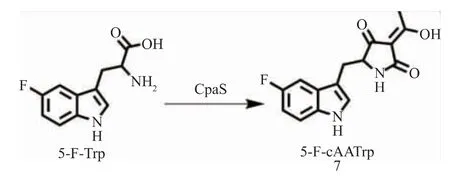
图4 5-F-Trp转为为5-F-cAATrp的示意图Fig.4 Conversion of 5-F-Trp into 5-F-cAATrp
值得注意的是,一般情况下当外源底物进入了某个天然产物的生物合成途径后,通常仍然会观察到目标生物合成途径天然产物的产生。这是因为,无论是原始添加物或者添加物经该途径修饰的衍生物对于相应的催化酶来说都不是天然底物,因此很难超过天然底物对催化酶活性位点的竞争。本研究结果显示,5-F-Trp的添加造成了α-CPA及下游产物的消失,同时也未见上游cAATrp及β-CPA的积累,这意味着5-F-Trp对原CPA途经的抑制最早可能发生在CpaS酶NRPS模块中的A domain(腺苷酸化结构域)对色氨酸的激活步骤,尤其当5-FTrp过量存在时,大量的5-F-色氨酰AMP的产生使T domain(硫酯化结构域)难以捕捉到天然底物色氨酰AMP并生成cAATrp。综上可知,5-F-Trp应是CpaS酶各个结构域的较合适的底物,因而可以抑制CPA生物合成途径所有天然产物及中间体的产生;同时,5-F-cAATrp并非异戊烯基转移酶CpaD的合适底物,造成5-F-Trp的非天然衍生产物经CpaS加工后立即被CpaD限制形成早期产物富集,这种富集效应非常有利于对米曲霉、青霉可能含有活跃CPA毒素生物合成基因簇的定性检测和定量测定。
3 结 语
作者以CPA毒素产生菌米曲霉为研究对象,发现添加外源5-F-Trp可以阻断CPA毒素(α-CPA及β-CPA)的产生;同时因5-F-Trp可嵌入CPA的生物合成途径并造成非天然上游产物5-F-cAATrp的大量富集,这种富集效应可将所有CPA代谢途径的下游产物整合为单一化合物5-F-cAATrp。考虑到α-CPA可经过N-甲基化、多重氧化反应等一系列后修饰步骤生成多达30余种毒素衍生物,因而通过探针分子5-F-Trp可有效整合这些复杂的后修饰衍生物。利用这种方法可将多个代谢物的定性与定量工作简化为针对单一目标化合物的检测和分析。这对于实现CPA毒素的高效检测、保障食品安全等方面具有较好的参考价值。
