替加环素对耐甲氧西林金黄色葡萄球菌生物膜的清除作用
2022-01-13袁春妹张能华傅跃青陈兴英金烨沈晓华
袁春妹 张能华* 傅跃青 陈兴英 金烨 沈晓华
金黄色葡萄球菌(staphylococcus aureus,SA)是一类寄居于人类呼吸道、鼻咽部及皮肤的条件致病菌,是导致医院感染的主要病原体之一。耐甲氧西林金黄色葡萄球菌(methicillin resistant staphylococcus aureus,MRSA)对大环内酯类、庆大霉素等常见抗菌素的耐药率>80%,对目前上市的所有β-内酰胺类药物耐药[1],故MRSA被称为“超级细菌”。研究显示,金黄色葡萄球菌感染与导管及其他医疗设备感染相关[2],80%的假体感染是由葡萄球菌引起[3],而且这些感染均与其形成的生物膜相关,当金黄色葡萄球菌以生物膜的形式存在,其耐药性和致病性大大增加,治疗和根除更加困难。替加环素是新一代的甘氨酰环类抗菌药物,抗菌谱广且安全有效,在一定程度上还能破坏鲍曼不动杆菌的生物膜,但有关于替加环素与金黄色葡萄球菌生物膜的研究较少。本文主要探讨不同浓度替加环素对MRSA生物膜的作用及其机制,为临床治疗及院感防控提供依据。
1 资料与方法
1.1 一般资料 纳入研究的30株MRSA均来自于2013年1月至2017年12月浙江中医药大学附属嘉兴市中医院的住院患者,同一患者同一部位分离出的重复菌株不重复计入。质控菌株:铅黄肠球菌ATCC700327和金黄色葡萄球菌ATCC29213均购自卫生部临床检验中心。
1.2 仪器与试剂 VITEK-Compact2型全自动微生物分析仪、VITEK比浊仪(法国梅里埃公司),ST-360酶标仪(上海科华有限公司),小型低速离心机(Thermo公司),PCR反应扩增仪(BIO公司),StepOne型荧光定量PCR仪、Stepone plus型荧光定量PCR仪(ABI),96孔细胞培养板(NEST公司),1%结晶紫染色液(北京索莱宝),Ezup柱式细菌基因组DNA抽提试剂盒、溶葡萄球菌酶(上海生工生物工程股份有限公司),定量PCR试剂SG Fast qPCR Master Mix(加拿大ABI公司)。
1.3 研究方法 (1)细菌的分离与鉴定:按照《全国临床检验操作规程》及VITEK-2型号全自动化微生物分析仪器操作手册进行规范化操作,对分离纯化的细菌进行鉴定。通过VITEK-2型号全自动化微生物分析仪器鉴定,并经过mecA 基因进行MRSA菌种的确认。(2)药物敏感试验:按照2016版美国临床和实验室标准协会(CLSI)的标准,应用微量肉汤稀释法测定30株实验菌株对替加环素的最低抑菌浓度(minimal inhibititory concentration,MIC)和最低生物被膜清除浓度(minimal biofilm eradication concentration,MBEC),每株菌做3个复孔。其中,替加环素对MRSA的MIC值采用欧洲药敏试验委员会(EUCAST)标准,替加环素≤0.12为敏感。(3)生物膜形成能力定量测定:采用96孔聚苯乙烯板结晶紫染色法测定30株MRSA菌株体外培养不同时间段形成生物膜的能力。全功能微孔板酶标仪检测各孔在570 nm处的吸光度值,即OD570值。OD570值判读依据:当OD570≥2ODc时,为强生物膜形成株;当ODc≤OD570<2ODc时,为弱生物膜形成株;当OD570<ODc时,为无生物膜形成株。(4)不同浓度的替加环素作用下生物膜形成定量测定:采用96孔聚苯乙烯板结晶紫染色法测定亚抑菌浓度及亚生物膜清除浓度替加环素作用下生物膜的变化。(5)不同浓度替加环素作用下生物膜相关基因的测定:按照Ezup柱式细菌基因组DNA抽提试剂盒说明进行操作,将提取MRSADNA保存在-20 ℃。应用荧光定量PCR测定icaA、sar、fnbA、agrI基因的相对表达量。生物膜相关基因相对表达量差异采用比较Ct值法(2-(ΔΔCt))公式计算:ΔCt=Ct靶基因-Ct内参基因;ΔΔCt=ΔCt(校准样品)-ΔCt(实验样本),改变倍数=2-(ΔΔCt)。
1.4 统计学方法 采用Microsoft office2007软件和SPSS13.0统计软件。计数资料以(±s)表示,采用趋势χ2检验,两样本间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 30株临床分离的MRSA生物膜形成能力测定 结果显示,30株实验菌株均能形成生物膜。根据结果判读依据:ODc=0.066,OD570≥4ODc,30株均为强生物膜形成株。所有菌株在24 h均已形成生物膜,24 h~48 h内迅速生长。每株菌每个时间段所形成的生物膜量均有差异。5株菌培养48 h后生物膜形成量达到高峰,而后进入平台期,96 h开始下降;16株菌在48 h产生的生物膜量达到高峰,72 h开始下降;另外9株菌在72 h产生的生物膜量达到高峰,而后开始下降。见表1。
表1 30株临床分离的MRSA生物膜形成能力测定(±s)
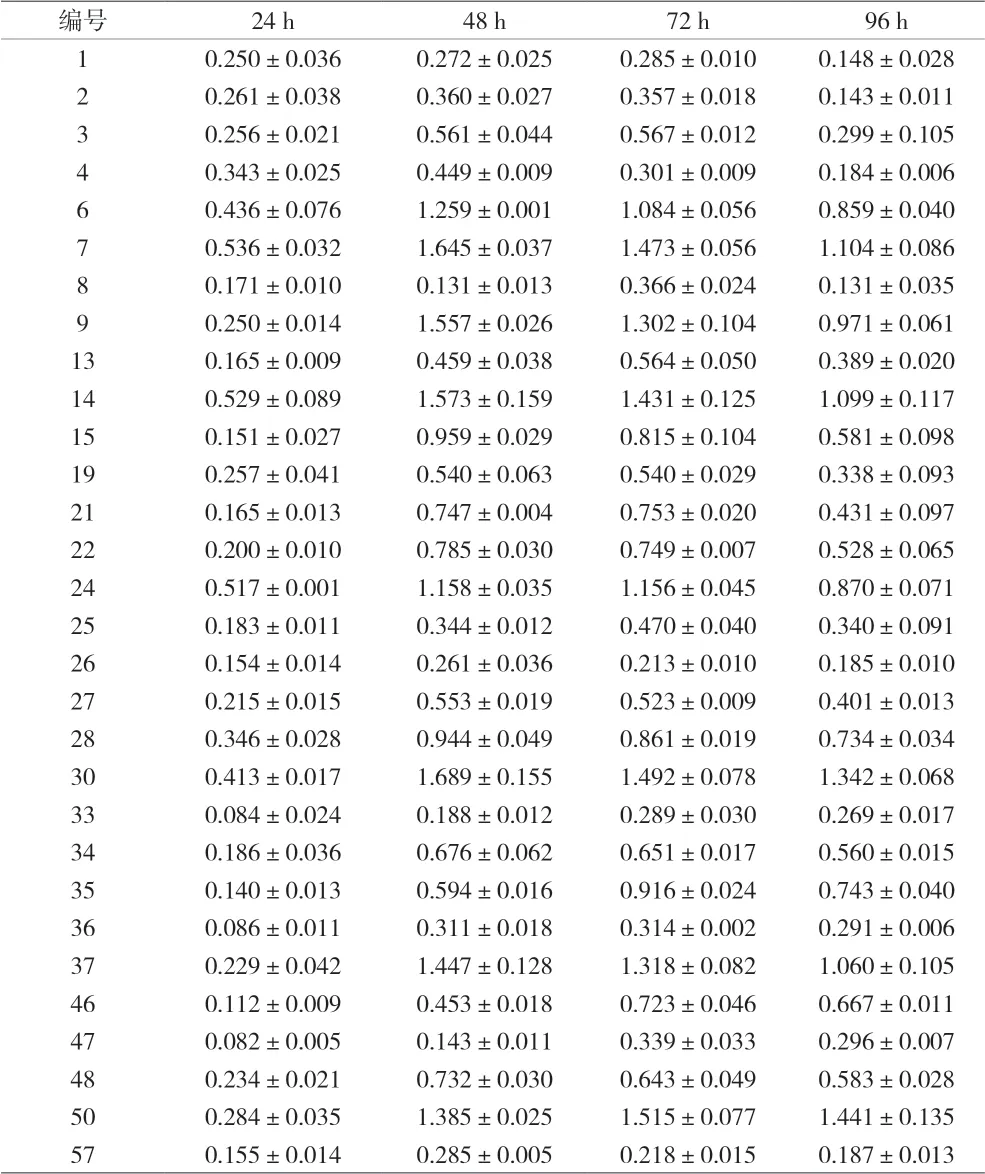
表1 30株临床分离的MRSA生物膜形成能力测定(±s)
编号 24 h 48 h 72 h 96 h 1 0.250±0.036 0.272±0.025 0.285±0.010 0.148±0.028 2 0.261±0.038 0.360±0.027 0.357±0.018 0.143±0.011 3 0.256±0.021 0.561±0.044 0.567±0.012 0.299±0.105 4 0.343±0.025 0.449±0.009 0.301±0.009 0.184±0.006 6 0.436±0.076 1.259±0.001 1.084±0.056 0.859±0.040 7 0.536±0.032 1.645±0.037 1.473±0.056 1.104±0.086 8 0.171±0.010 0.131±0.013 0.366±0.024 0.131±0.035 9 0.250±0.014 1.557±0.026 1.302±0.104 0.971±0.061 13 0.165±0.009 0.459±0.038 0.564±0.050 0.389±0.020 14 0.529±0.089 1.573±0.159 1.431±0.125 1.099±0.117 15 0.151±0.027 0.959±0.029 0.815±0.104 0.581±0.098 19 0.257±0.041 0.540±0.063 0.540±0.029 0.338±0.093 21 0.165±0.013 0.747±0.004 0.753±0.020 0.431±0.097 22 0.200±0.010 0.785±0.030 0.749±0.007 0.528±0.065 24 0.517±0.001 1.158±0.035 1.156±0.045 0.870±0.071 25 0.183±0.011 0.344±0.012 0.470±0.040 0.340±0.091 26 0.154±0.014 0.261±0.036 0.213±0.010 0.185±0.010 27 0.215±0.015 0.553±0.019 0.523±0.009 0.401±0.013 28 0.346±0.028 0.944±0.049 0.861±0.019 0.734±0.034 30 0.413±0.017 1.689±0.155 1.492±0.078 1.342±0.068 33 0.084±0.024 0.188±0.012 0.289±0.030 0.269±0.017 34 0.186±0.036 0.676±0.062 0.651±0.017 0.560±0.015 35 0.140±0.013 0.594±0.016 0.916±0.024 0.743±0.040 36 0.086±0.011 0.311±0.018 0.314±0.002 0.291±0.006 37 0.229±0.042 1.447±0.128 1.318±0.082 1.060±0.105 46 0.112±0.009 0.453±0.018 0.723±0.046 0.667±0.011 47 0.082±0.005 0.143±0.011 0.339±0.033 0.296±0.007 48 0.234±0.021 0.732±0.030 0.643±0.049 0.583±0.028 50 0.284±0.035 1.385±0.025 1.515±0.077 1.441±0.135 57 0.155±0.014 0.285±0.005 0.218±0.015 0.187±0.013
2.2 亚抑菌浓度替加环素对MRSA生物膜形成的作用 本实验替加环素对30株MRSA的MIC值均≤0.12 μg/mL,参照CLSI标准均为敏感。对30株亚抑菌浓度替加环素作用下的MRSA实验菌株的生物膜量进行分析,分别测定1、1/2、1/4、1/8MIC替加环素条件下实验菌株的生物膜生成量。结果显示,所有菌株在亚抑菌浓度的替加环素作用下的生物膜形成能力均有下降,表明在亚抑菌浓度的替加环素作用下可显著抑制MRSA实验菌株生物膜的形成;大部分菌株随着替加环素浓度的增加,生物膜形成量减少;只有少量MRSA实验菌株表现为1/4MIC替加环素下生成增加,其生物膜形成量不完全与替加环素浓度呈负相关。见表2。
表2 亚抑菌浓度替加环素对30株MRSA生物膜的作用(±s)
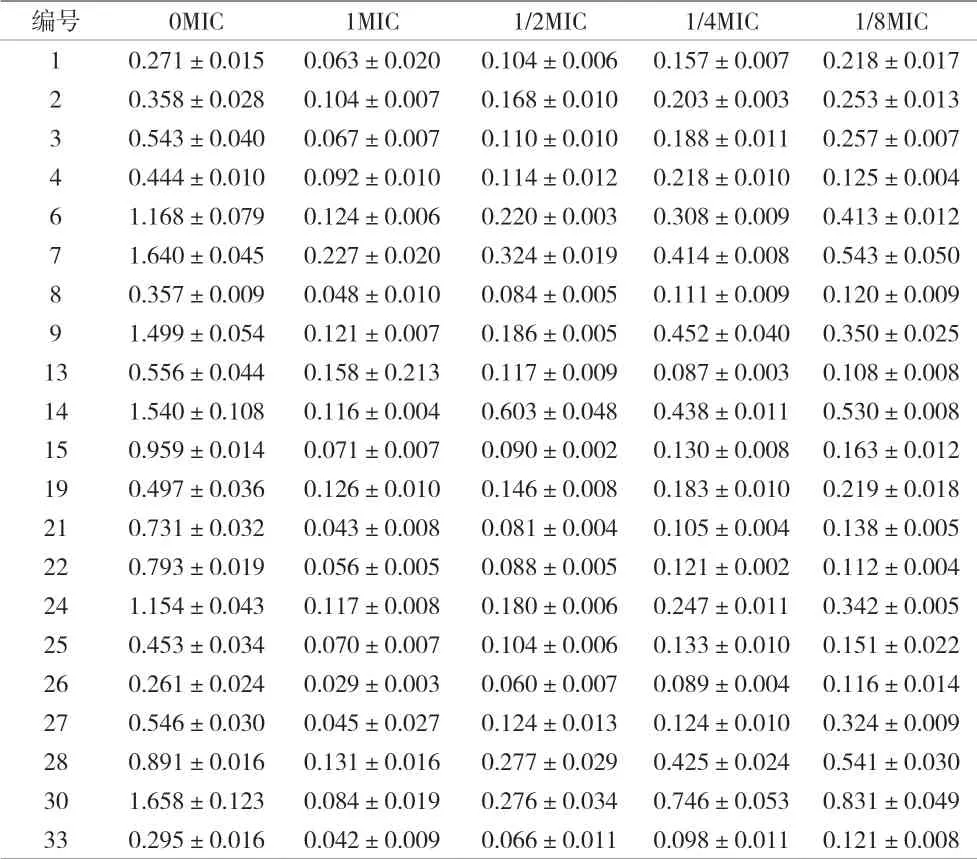
表2 亚抑菌浓度替加环素对30株MRSA生物膜的作用(±s)
编号 0MIC 1MIC 1/2MIC 1/4MIC 1/8MIC 1 0.271±0.015 0.063±0.020 0.104±0.006 0.157±0.007 0.218±0.017 2 0.358±0.028 0.104±0.007 0.168±0.010 0.203±0.003 0.253±0.013 3 0.543±0.040 0.067±0.007 0.110±0.010 0.188±0.011 0.257±0.007 4 0.444±0.010 0.092±0.010 0.114±0.012 0.218±0.010 0.125±0.004 6 1.168±0.079 0.124±0.006 0.220±0.003 0.308±0.009 0.413±0.012 7 1.640±0.045 0.227±0.020 0.324±0.019 0.414±0.008 0.543±0.050 8 0.357±0.009 0.048±0.010 0.084±0.005 0.111±0.009 0.120±0.009 9 1.499±0.054 0.121±0.007 0.186±0.005 0.452±0.040 0.350±0.025 13 0.556±0.044 0.158±0.213 0.117±0.009 0.087±0.003 0.108±0.008 14 1.540±0.108 0.116±0.004 0.603±0.048 0.438±0.011 0.530±0.008 15 0.959±0.014 0.071±0.007 0.090±0.002 0.130±0.008 0.163±0.012 19 0.497±0.036 0.126±0.010 0.146±0.008 0.183±0.010 0.219±0.018 21 0.731±0.032 0.043±0.008 0.081±0.004 0.105±0.004 0.138±0.005 22 0.793±0.019 0.056±0.005 0.088±0.005 0.121±0.002 0.112±0.004 24 1.154±0.043 0.117±0.008 0.180±0.006 0.247±0.011 0.342±0.005 25 0.453±0.034 0.070±0.007 0.104±0.006 0.133±0.010 0.151±0.022 26 0.261±0.024 0.029±0.003 0.060±0.007 0.089±0.004 0.116±0.014 27 0.546±0.030 0.045±0.027 0.124±0.013 0.124±0.010 0.324±0.009 28 0.891±0.016 0.131±0.016 0.277±0.029 0.425±0.024 0.541±0.030 30 1.658±0.123 0.084±0.019 0.276±0.034 0.746±0.053 0.831±0.049 33 0.295±0.016 0.042±0.009 0.066±0.011 0.098±0.011 0.121±0.008
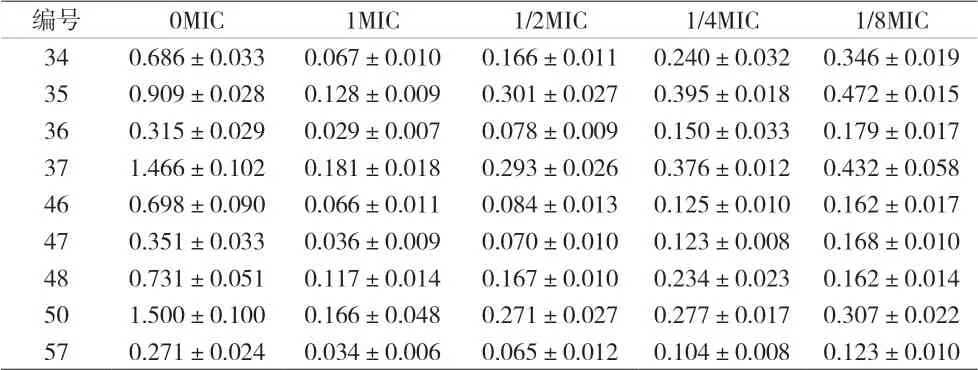
表2(续)
2.3 亚生物膜清除浓度替加环素下对MRSA生物膜的作用 MRSA菌株生物膜形成达高峰后加入一定浓度的替加环素,并以能消除已形成生物膜的最低浓度为最低生物膜形成浓度(MBEC),分别测定1、1/2、1/4、1/8MBEC 的替加环素作用下,30株MRSA菌株生物膜形成量的变化。结果显示,替加环素对30株MRSA的MBEC各不相同,浓度32~128 ug/mL;1/2、1/4、1/8MBEC 替加环素对生物膜均有微弱的消除作用,组间差异无统计学意义(P=0.894)。见表3-4。
表3 亚生物膜清除浓度替加环素对30株MRSA生物膜的作用(±s)
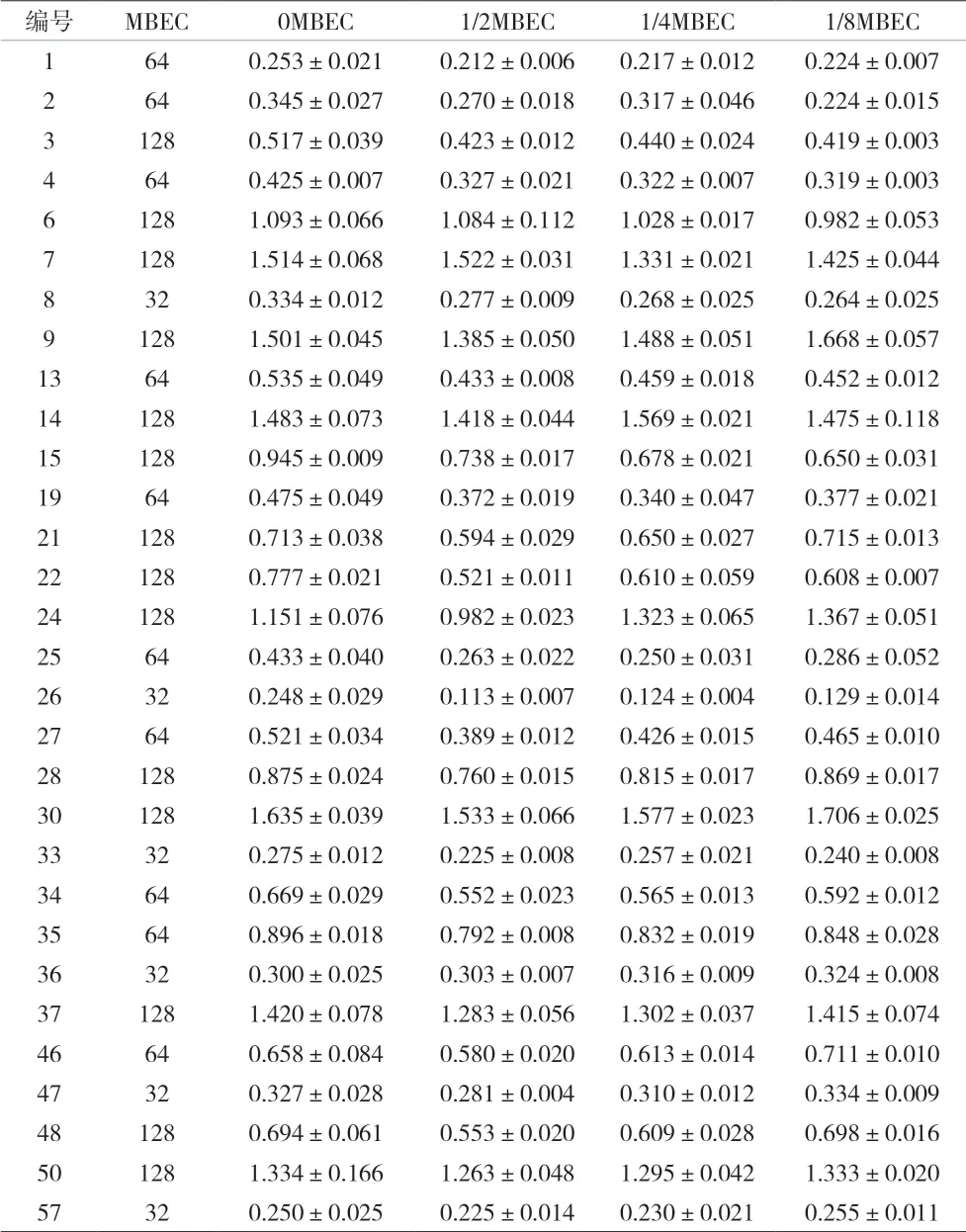
表3 亚生物膜清除浓度替加环素对30株MRSA生物膜的作用(±s)
编号 MBEC 0MBEC 1/2MBEC 1/4MBEC 1/8MBEC 1 64 0.253±0.021 0.212±0.006 0.217±0.012 0.224±0.007 2 64 0.345±0.027 0.270±0.018 0.317±0.046 0.224±0.015 3 128 0.517±0.039 0.423±0.012 0.440±0.024 0.419±0.003 4 64 0.425±0.007 0.327±0.021 0.322±0.007 0.319±0.003 6 128 1.093±0.066 1.084±0.112 1.028±0.017 0.982±0.053 7 128 1.514±0.068 1.522±0.031 1.331±0.021 1.425±0.044 8 32 0.334±0.012 0.277±0.009 0.268±0.025 0.264±0.025 9 128 1.501±0.045 1.385±0.050 1.488±0.051 1.668±0.057 13 64 0.535±0.049 0.433±0.008 0.459±0.018 0.452±0.012 14 128 1.483±0.073 1.418±0.044 1.569±0.021 1.475±0.118 15 128 0.945±0.009 0.738±0.017 0.678±0.021 0.650±0.031 19 64 0.475±0.049 0.372±0.019 0.340±0.047 0.377±0.021 21 128 0.713±0.038 0.594±0.029 0.650±0.027 0.715±0.013 22 128 0.777±0.021 0.521±0.011 0.610±0.059 0.608±0.007 24 128 1.151±0.076 0.982±0.023 1.323±0.065 1.367±0.051 25 64 0.433±0.040 0.263±0.022 0.250±0.031 0.286±0.052 26 32 0.248±0.029 0.113±0.007 0.124±0.004 0.129±0.014 27 64 0.521±0.034 0.389±0.012 0.426±0.015 0.465±0.010 28 128 0.875±0.024 0.760±0.015 0.815±0.017 0.869±0.017 30 128 1.635±0.039 1.533±0.066 1.577±0.023 1.706±0.025 33 32 0.275±0.012 0.225±0.008 0.257±0.021 0.240±0.008 34 64 0.669±0.029 0.552±0.023 0.565±0.013 0.592±0.012 35 64 0.896±0.018 0.792±0.008 0.832±0.019 0.848±0.028 36 32 0.300±0.025 0.303±0.007 0.316±0.009 0.324±0.008 37 128 1.420±0.078 1.283±0.056 1.302±0.037 1.415±0.074 46 64 0.658±0.084 0.580±0.020 0.613±0.014 0.711±0.010 47 32 0.327±0.028 0.281±0.004 0.310±0.012 0.334±0.009 48 128 0.694±0.061 0.553±0.020 0.609±0.028 0.698±0.016 50 128 1.334±0.166 1.263±0.048 1.295±0.042 1.333±0.020 57 32 0.250±0.025 0.225±0.014 0.230±0.021 0.255±0.011
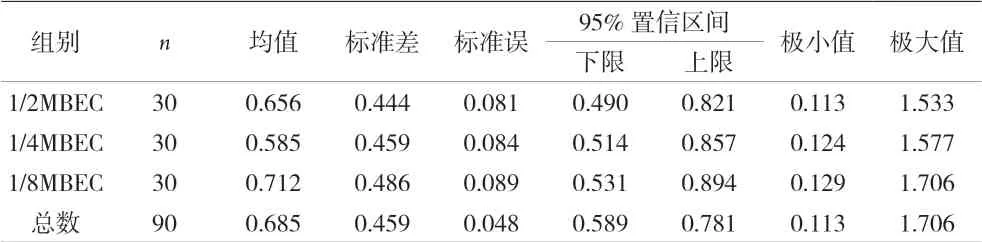
表4 1/2、1/4、1/8MBEC替加环素对MRSA生物膜的差异性比较
2.4 RT-PCR法测定亚抑菌浓度替加环素作用下生物膜相关基因相对表达量 选取实验菌株中的四株菌在四个不同浓度替加环素作用24 h后进行RT-PCR检测icaA、sarA、fnbA、agrI基因的相对表达量,并计算生物膜形成量与其之间的相关性,内参基因为16sRNA。见表5。
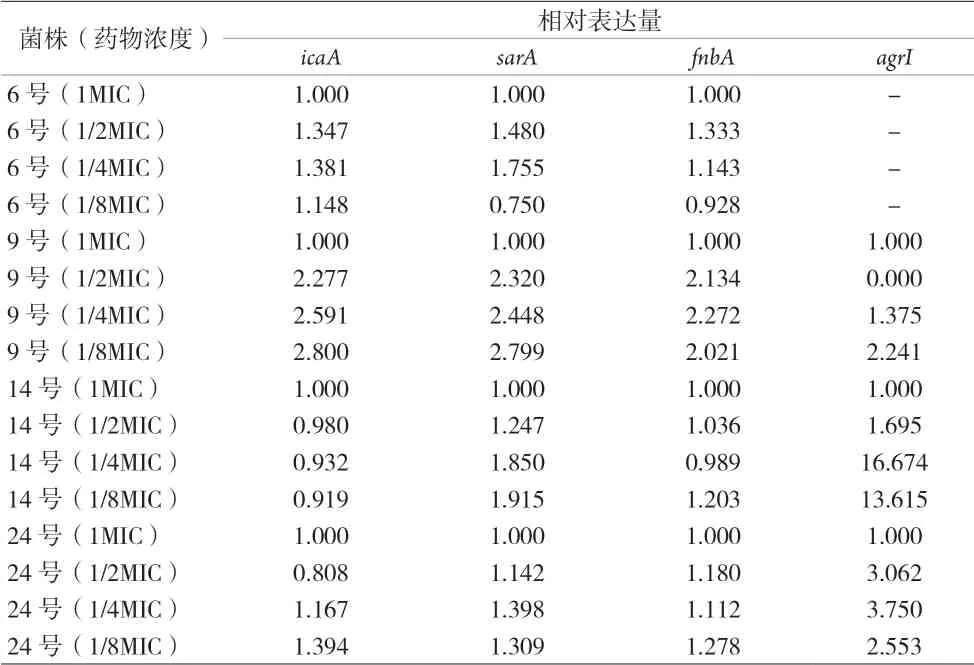
表5 icaA,sarA,fnbA和agrI基因相对表达量
2.5 MRSA生物膜形成量与相关基因表达量的相关性分析 结果显示,生物膜量与以下基因有相关性:icaA(PCC=0.873,P<0.01),icaA和sarA(PCC=0.817,P<0.01),icaA和fnbA(PCC=0.941,P<0.01),sarA和fnbA(PCC=0.844,P<0.01)。见表6。

表6 MRSA生物膜形成量与相关基因表达量的相关性分析
3 讨论
金黄色葡萄球菌是一种机会性人类病原体,感染的范围从轻度皮肤感染到严重坏死性肺炎,同时是菌血症、感染性心内膜炎的主要病原菌,还可引起骨关节、皮肤、软组织、胸膜、肺和装置相关感染。MRSA具有多重耐药性,生物膜的形成是MRSA毒力因子之一[4]。生物膜是一种膜性结构,MRSA由于生物膜的作用,并不引起强烈的炎症反应,因为生物膜隔绝了细菌与机体的直接接触,使细菌得以与机体共存,即使在慢性黏附的状态下[5]。更重要的是,生物膜能够有效阻滞抗生素和机体防御系统对被膜内细菌的杀伤,虽然部分抗生素能够有效杀灭浮游菌,但还会不断释放浮游菌,从而导致感染迁延不愈。生物膜致病机制较为复杂,主要包括以下几个方面[6-11]:①生物膜提供保护屏障,MRSA生物膜可通过多种机制对抗抗生素的杀菌作用,主要是表现在内部微环境的改变、基质屏障作用、群体感应系统、被膜菌的表型变异以及主动外排系统等,为细菌的定植和侵入提供了屏障。②生物膜介导的免疫损伤。中性粒细胞不能进入生物膜内杀伤细菌,只能围绕在生物膜周围,由于生物膜基质屏障缺少特定的化学信号,这些细胞被激活后能释放蛋白酶、细胞毒素等,可引起周围组织损伤。③葡萄球菌生物膜能够通过降低淋巴细胞释放γ干扰素,可减少巨噬细胞的激活,也会导致周围组织损伤。④生物膜能够对抗免疫系统的清除,抗体和炎性细胞只能环绕在其周围,很难进入生物膜内,这样就不能发挥吞噬杀伤作用。
本实验通过96孔聚苯乙烯板结晶紫染色法发现,留取的30株MRSA均形成生物膜,并且都是强生物膜形成株。从30株临床分离的MRSA生物膜形成能力测定表及生物膜生长曲线图可见,菌株生物膜的生长周期具有差异性。细菌形成生物膜的阶段为黏附→聚集与增殖→生物膜的成熟→细菌脱落与播散,由表1可见,培养24 h已经完成黏附形成生物膜,24 h~48 h是聚集与增殖的快速阶段,53.3%的菌株在此时间段成生物膜已经达到高峰,72 h开始下降;16.7%的菌株在此阶段生物膜形成量达到高峰,72 h量与其持平;30%的菌株在此阶段生物膜继续增殖至72 h达到高峰形成成熟的生物膜。72 h~96 h为细菌脱落与播散期,浮游菌遇到适宜的表面继续附着、发展、成熟,形成循环。因此,生物膜的形成是一个动态过程,是导致感染迁延不愈的重要原因。
本研究使用1、1/2、1/4、1/8MIC替加环素对30株MRSA实验菌株进行刺激。结果表明,所有应用替加环素作用下的MRSA实验菌株在亚抑菌浓度条件下其形成生物膜的能力均降低。此外,亚抑菌浓度的替加环素作用下可明显抑制MRSA生物膜的形成。实验菌株形成的生物膜量各自不同,在不同的亚抑菌浓度作用下,大部分的菌株在替加环素作用下表现为随着浓度增加,生物膜形成量减少,呈负相关性。有少量菌株在亚抑菌浓度的替加环素作用下,其形成的生物膜不随替加环素的浓度变化而变化,可能是因为亚抑菌浓度不仅不能破坏、减少生物膜,反而可能诱导刺激生物膜形成,这个问题值得继续研究。
本研究检测了替加环素对30株MRSA实验菌株最低生物膜清除浓度。结果显示,30株的MBEC均显著高于其浮游菌的MIC,表明在替加环素作用下以生物膜形态存在的细菌与浮游菌耐抗菌素的能力相比大大增加。以1/2、1/4、1/8MBEC浓度刺激30株MRSA菌株,结果表明亚生物膜清除浓度对已经形成的生物膜有微弱的消除作用,但不同MBEC的替加环素对成熟生物膜的作用无差异。临床上,可以根据需要联合用药对MRSA成熟的生物膜进行干预。
本研究中亚抑菌浓度替加环素作用下生物膜形成量与sarA、icaA和fnbA呈明显相关性,提示亚抑菌浓度替加环素对MRSA生物膜影响的主要机制是对相关的生物膜基因如sarA、icaA、fnbA进行调控进而影响生物膜的形成。结果提示,亚抑菌浓度替加环素影响生物膜形成与agrI基因相关性不大,可能与本研究中6号菌株在亚抑菌浓度替加环素作用下的agrI未扩增有关,后期需要更多的实验来证明与探究。
综上所述,不同浓度替加环素的作用影响了相关基因的相对表达量,从而影响生物膜形成量的变化。替加环素影响生物膜形成的机制复杂,通过对毒力因子、基因的调控能否降低MRSA生物膜相关感染的发病率和病死率,还需进行深入的研究。另外,MRSA的耐药形势给临床治疗及院内感染防控带来极大的挑战,提示临床医师必须合理选用抗菌药物[12]。
