黑果枸杞提取物基于内质网应激和线粒体自噬调控HepG2细胞自噬
2022-02-24王梦杰吴华刘嘉华张龙飞
王梦杰,吴华,刘嘉华,张龙飞
(青海大学 农牧学院,青海 西宁 810000)
现代快节奏的生活,使得人们的一些习惯发生改变,如昼夜颠倒、饮食不规律等,这些不规律和不健康的生活方式成为诱发各类癌症的主要因素之一.其中,肝癌的发病率和死亡率均高居癌症的前6位,2020年全球死于肝癌的人数达80多万,占全球癌症总死亡人数的8.3%[1].近些年,人们在研究和开发抗肿瘤药物的过程中逐渐将目光转向了可食用的天然化合物,其中就包括黄酮类化合物[2].茄科黑果枸杞多分布于中国西北地区,富含多种花青素类天然色素,其含量居浆果类植物之首[3-4].花青素是一种类黄酮物质,属黄酮类化合物的一个亚群,在抗肿瘤方面具有较强的生理活性,具有一定的食品开发和医学研究意义[2,4].前期研究发现,黑果枸杞提取物(LyciumruthenicumMurray extraction,LRME)可有效抑制HepG2细胞增殖和迁移,并具有剂量和时间依赖性[4].基于此,本实验拟从细胞和分子层面揭示LRME基于内质网应激和线粒体自噬对HepG2细胞自噬影响的分子机理,为开发黑果枸杞的药用价值提供理论依据.
1 材料与方法
1.1 实验材料
LRME,青海金麦杞生物科技有限公司[4];HepG2细胞,中国科学院上海细胞库;细胞周期检测试剂盒,碧云天生物技术研究所.
1.2 实验方法
1.2.1 流式细胞术测细胞周期
分别设对照组(NC),LRME组.将1×105/mL的HepG2细胞接种至6孔板进行常规培养,放入培养箱稳定24 h后,加入LRME进行诱导,控制LRME终质量浓度分别为0、25 μg/mL.诱导24 h后收集细胞,用体积分数为70%的冷乙醇固定过夜,PI染色后上机检测.
1.2.2 qRT-PCR检测关键基因mRNA表达
分别设NC组、LRME组、自噬抑制剂组(3-MA)、LRME+3-MA组.将1×105/mL的HepG2细胞接种至6孔板进行常规培养,放入培养箱稳定24 h后进行分组处理,控制LRME终质量浓度分别为0、25 μg/mL,3-MA的终浓度为5 mmol/L.诱导24 h后通过Triol法提取总RNA,并按TIANGEN试剂盒说明书进行RNA逆转录和qRT-PCR反应,引物由上海生物公司合成(表1).使用 Bio-Rad CFX96 Real-Time PCR Detection System 对各组样本进行扩增,记录各样品扩增Ct值(Ct值指每个反应管内的荧光信号到达设定域值时所经历的循环数),采用2-△△Ct法计算各目的基因的相对表达量.
1.2.3 Western blot检测关键基因蛋白表达
将1×105/mL的HepG2细胞接种至6孔板进行常规培养,放入培养箱稳定24 h后进行分组处理,控制LRME终质量浓度分别为0、25 μg/mL,3-MA的终浓度为5 mmol/L.细胞诱导24 h后,由含体积分数1% PMSF的裂解液进行裂解,离心后取上清液,BCA 法定量.蛋白于PCR仪上95 ℃加热5 min,变性后泳道上样,制备体积分数8%的分离胶和体积分数5%的浓缩胶.SDS-PAGE 电泳浓缩胶 70 V、30 min;分离胶 120 V、90 min.电泳后转膜至PVDF膜,按体积比1∶1 000配制ATF4、FUNDC1及β-tubulin 一抗,4 ℃封闭过夜后洗膜.加入二抗,室温1 h后洗膜.向PVDF膜滴加发光液试剂并反应5 min后曝光显影.

表1 引物序列Tab.1 Primer sequence
2 结果分析
2.1 LRME调控HepG2细胞增殖
2.1.1 LRME调控HepG2细胞周期
经流式细胞术检测细胞周期发现,LRME可有效阻滞HepG2细胞周期(图1).
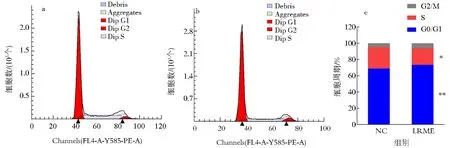
a.NC组;b.LRME组;c.细胞所处周期百分比.与NC组比较*P<0.05;**P<0.01.图1 LRME调控HepG2细胞周期Fig.1 Regulation of LRME on cell cycle in HepG2 cells
由图1可知,与NC组相比,LRME可极显著上调HepG2细胞在G0/G1期的细胞数(P<0.01),并显著下调HepG2细胞在S期的细胞数(P<0.05).表明LRME可显著抑制HepG2细胞增殖,并可有效阻滞HepG2细胞从G0/G1期向S期转化.
2.1.2 LRME调控HepG2细胞关键增殖因子mRNA表达水平
检测增殖关键因子mRNA表达水平发现,LRME可有效抑制HepG2细胞增殖,结果见图2.
由图2可知,与NC组相比,LRME可极显著上调增殖关键因子TP53在mRNA水平的表达(P<0.01),并显著下调CCND1、CDK4和PCNA在mRNA水平的表达(P<0.05).表明LRME可通过上调TP53,下调CCND1、CDK4和PCNA的mRNA表达抑制HepG2细胞增殖.
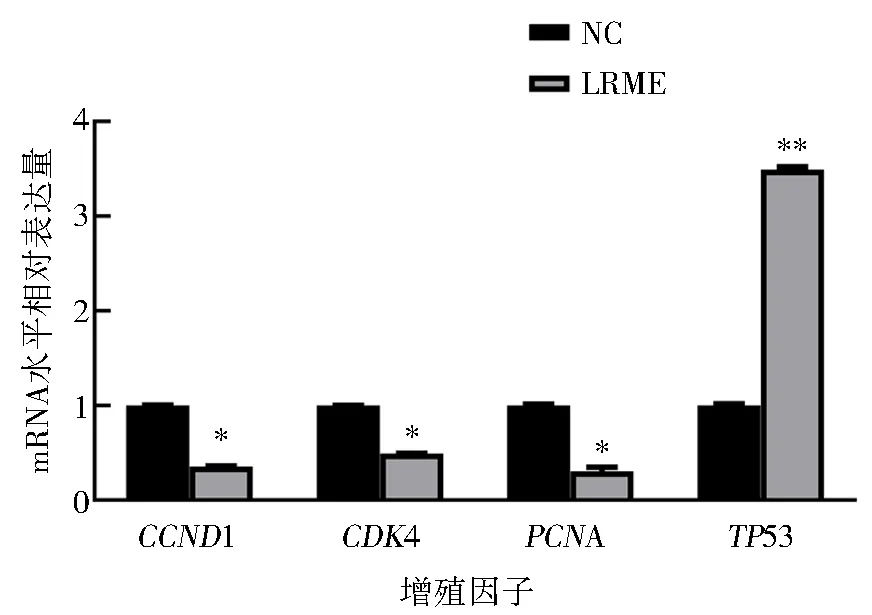
与NC组比较*P<0.05;**P<0.01.图2 HepG2细胞增殖关键因子在mRNA水平的表达Fig.2 Expression of proliferation factors at mRNA level in HepG2 cells
2.2 LRME调控HepG2细胞内质网应激关键因子mRNA和蛋白表达水平
分别选用LRME(25 μg/mL)和3-MA(5 mmol/L)诱导细胞,结果发现,LRME可有效增强HepG2细胞的内质网应激(图3).
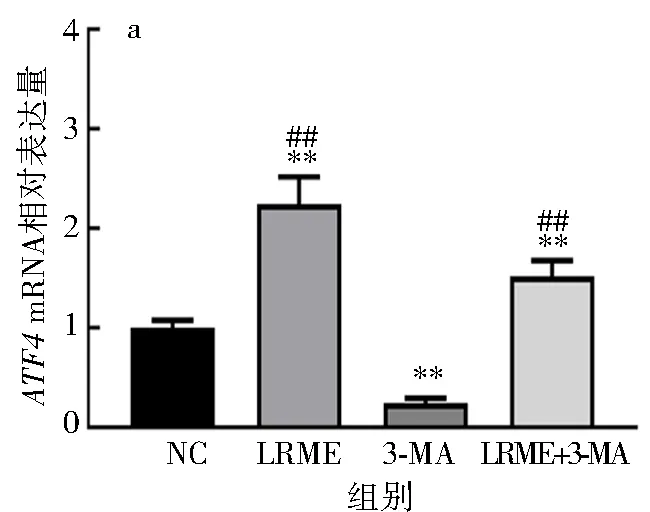
与NC组比较**P<0.01.与3-MA组比较## P<0.01.
由图3可知,与NC组相比,LRME可极显著上调ATF4的mRNA表达水平和蛋白表达水平(P<0.01),3-MA可极显著下调ATF4的mRNA表达水平和蛋白表达水平(P<0.01),LRME+3-MA可极显著上调ATF4的mRNA表达水平和蛋白质表达水平(P<0.01);阻断细胞自噬后,与3-MA组相比,LRME和LRME+3-MA均可极显著上调ATF4的mRNA表达水平和蛋白表达水平(P<0.01).说明LRME可通过上调ATF4在mRNA水平和蛋白水平的表达,增强HepG2细胞的内质网应激.
2.3 LRME调控HepG2细胞线粒体自噬关键因子mRNA和蛋白表达水平
分别选用LRME和3-MA诱导细胞,结果发现,LRME可有效促进HepG2细胞的线粒体自噬(图4).
由图4可知,与NC组相比,LRME可极显著上调FUNDC1的mRNA表达水平和蛋白表达水平(P<0.01),3-MA可极显著下调FUNDC1的mRNA表达水平和蛋白表达水平(P<0.01),LRME+3-MA可显著上调FUNDC1的mRNA表达水平(P<0.05)并极显著上调FUNDC1的蛋白表达水平(P<0.01);阻断细胞自噬后,与3-MA组相比,LRME和LRME+3-MA均可极显著上调FUNDC1的mRNA表达水平和蛋白表达水平(P<0.01).说明LRME可通过上调FUNDC1在mRNA水平和蛋白水平的表达,促进HepG2细胞线粒体自噬.
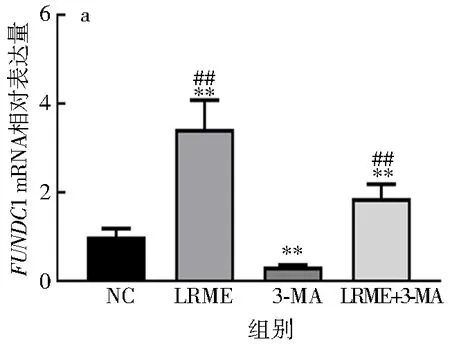
与NC组比较**P<0.01;与3-MA组比较## P<0.01.
2.4 LRME对HepG2细胞自噬关键因子mRNA表达的影响
前期研究发现,LRME可显著促进AMPK和LC3在mRNA水平的表达[4].本实验检测自噬关键因子mRNA表达水平发现,与NC组相比,LRME可显著抑制mTOR的mRNA表达水平(P<0.05).阻断细胞自噬后,与3-MA组相比,LRME+3-MA可极显著上调AMPK和LC3在mRNA水平的表达(P<0.01),并显著下调mTOR在mRNA水平的表达(P<0.05)(图5).表明LRME可通过下调mTOR并上调AMPK和LC3的mRNA表达,促进HepG2细胞自噬.
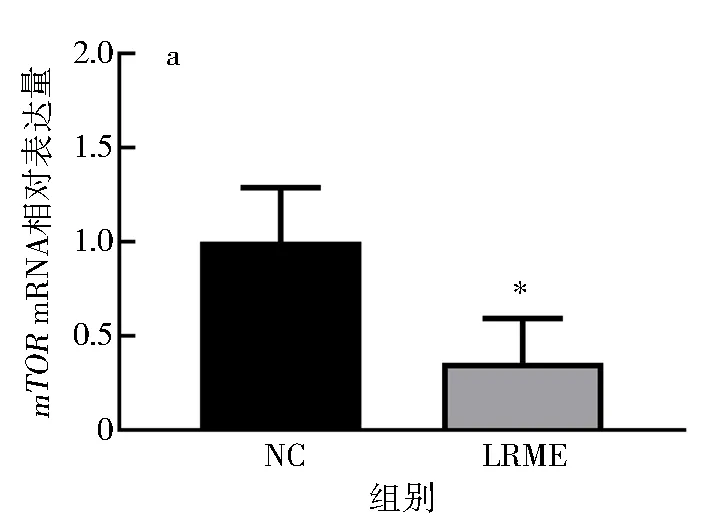
a.mTOR mRNA表达量;b.AMPK、mTOR和LC3 mRNA表达量.
3 讨论
3.1 LRME调控HepG2细胞增殖
细胞分裂过程中,CCND1基因所编码的细胞周期蛋白D1可与细胞分裂蛋白激酶4相结合,调控细胞由G1期向S期过渡,研究发现CCND1和CDK4下调,细胞周期进程可被有效阻滞[5-6].此外,增殖细胞核抗原PCNA在细胞内由G0期开始表达,S期到达峰值,M期出现回落[7].作为评价肿瘤细胞增殖能力的标志物,PCNA表达量越高,表示细胞增殖越旺盛[8].而“分子卫士”抑癌基因TP53则在细胞DNA发生损伤时发挥重要作用.研究发现,TP53所编码的野生型p53蛋白可使G0/G1期和G2/M期细胞停止发育,从而抑制细胞增殖[9].基于花青素可有效抑制肿瘤细胞增殖和阻滞细胞周期[10],本实验研究发现,LRME显著下调HepG2细胞S期的细胞数,将HepG2细胞阻滞在G0/G1期;并通过下调PCNA、CCND1、CDK4和上调TP53的mRNA表达来阻滞HepG2细胞周期,进而抑制HepG2细胞的增殖.
3.2 LRME基于线粒体自噬和内质网应激对HepG2细胞自噬的影响
自噬是细胞自身的一种分解代谢机制,可通过溶酶体降解损伤细胞器和异常蛋白[11],其中包括线粒体和内质网等在内的细胞质内含物可通过双膜自噬小体将物质传递至溶酶体进行大量降解[12].虽然自噬通常被认为可通过减轻细胞应激促进细胞存活,但目前基于癌症病理生理学发现,细胞的异常自噬对诱导癌细胞死亡起着重要作用[13-14].内质网是合成和加工蛋白质的场所,当细胞稳态被破坏时,为了生存,细胞将启动一系列自我保护事件,其中就包括细胞自噬和内质网应激[15].内质网应激通常被认为是细胞的一种病理性状态,即蛋白质在内质网内发生折叠错误和聚集异常,当细胞持续发生内质网应激时,自噬囊泡可吞噬并降解受损的内质网,降解的内质网片段可被细胞重新组装形成新的内质网,恢复细胞的正常生理状态[15].肿瘤内部细胞因缺氧存在着轻度的内质网应激,而重度内质网应激则可造成线粒体损伤,进而抑制肿瘤细胞的存活[16].ATF4是反应响应细胞发生应激的一种基因,可参与调节内质网应激和自噬[12].mTOR自噬途径和AMPK基因可响应并调节内质网应激诱导的自噬反应,进而抑制癌细胞的存活[17-18].本实验研究发现LRME可有效上调ATF4的mRNA和蛋白表达,显著下调mTOR的mRNA表达并上调AMPK的mRNA表达,说明LRME可通过上调ATF4、AMPK和下调mTOR促使HepG2细胞内质网应激并诱导HepG2细胞过度自噬,进而抑制HepG2细胞的存活.
线粒体可参与细胞多种代谢活动,是细胞的“能量加工厂”,当线粒体发生损伤时,细胞则会启动线粒体发生自噬以保证代谢的正常运行[19].线粒体自噬需要线粒体与自噬机制相互作用,使细胞去除受损或多余的线粒体[20].FUNDC1是哺乳动物的一类典型的线粒体受体,可与线粒体相互作用并将LC3募集到线粒体,并借此诱导线粒体自噬[21].本实验研究发现,LRME可有效上调FUNDC1的mRNA和蛋白表达,并显著上调LC3的mRNA表达,表明LRME可通过上调FUNDC1和LC3促进HepG2细胞线粒体自噬,并抑制HepG2细胞存活,这与Chen等[21]研究结果一致.
4 结论
LRME可在体外有效促进线粒体自噬和内质网应激反应,促进HepG2细胞自噬,降低HepG2细胞活力.
