不同组织来源线粒体提取效率和质量的差异研究
2022-10-26张晗奕彭翠平袁玉川
张晗奕,彭翠平,袁玉川,张 清,刘 燕,周 兴
(1.重庆理工大学 药学与生物工程学院, 重庆 400054; 2.陆军军医大学 药物研究所, 重庆 400030)
0 引言
线粒体是细胞氧化磷酸化和能量产生的细胞器,是维持细胞呼吸和细胞稳态的主要来源,有着“细胞能量工厂”的美称[1],线粒体的电子传递链(electron transport chain,ETC)是细胞能量的生产工厂,也是细胞中产生自由基的主要来源[2]。线粒体在产生腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的同时,还对细胞的氧化应激、物质代谢、细胞程序性死亡等多种途径的控制发挥着重要作用[3]。
研究表明,线粒体的结构和功能改变可能导致ATP耗竭、线粒体膜电位降低、活性氧过度产生、线粒体DNA突变或缺失等,进一步导致细胞凋亡、坏死,其功能障碍是多种疾病病理学的重要特征[4]。在脓毒性休克[5]、类风湿性关节炎[6]、全身性炎症[7]等炎症相关疾病中,线粒体功能障碍导致的细胞坏死、氧化应激反应以及ROS爆发是介导炎症起始与进展的关键机制之一。因此,基于线粒体损伤已逐渐成为炎症相关疾病机制与治疗研究的重要热点。
一方面,随着线粒体相关研究的深入,基于离体线粒体的实验研究已经成为线粒体相关的直接作用因子与机制的主要研究手段[8];另一方面,离体线粒体亦被证实能通过线粒体移植策略快速替代靶细胞中受损线粒体功能,恢复细胞呼吸功能、ATP供应以及氧化应激调控,在体内外均表现出对炎症性损伤的快速修复能力,成为线粒体损伤的热点治疗策略[9],受到广泛关注。
由于细胞系提取线粒体周期较长,且细胞传代次数会影响线粒体质量,目前采用较多的线粒体提取通常为组织来源线粒体。然而,现有研究缺乏对不同组织来源提取线粒体的效率、产率、纯度和质量的评价,而这些因素显然对于基于离体线粒体的机制或治疗研究有重要影响。选用合适的组织提取线粒体既能保证提取线粒体的结构完整,纯度较高,还对线粒体功能的研究取得良好效果。因此,本研究首先初步对心、肝、脾、肺、肾、肌肉、外周血来源提取的线粒体功能进行了评价,根据提取难度、线粒体功能从中筛选出两种最适提取的来源,接下来对小鼠肝脏、心脏组织提取线粒体的所需时间、产率、纯度和线粒体活性的差异,遴选线粒体提取的最佳来源组织,为未来基于离体线粒体的各类研究提供重要的方法学参考。
1 材料与方法
1.1 材料与仪器
1.1.1实验动物
雄性C57BL/6J小鼠,体质量18~24 g,6~8周龄,由陆军军医大学实验动物中心提供,饲养过程严格遵守3R原则。
1.1.2主要材料、试剂与仪器
组织线粒体分离试剂盒、增强型ATP检测试剂盒、增强型膜电位检测试剂盒(JC-1)、BCA蛋白浓度检测试剂盒(增强型)、Western及IP细胞裂解液、Mito-Tracker Green (线粒体绿色荧光探针)、辣根过氧化物酶标记山羊抗兔IgG (H+L)、辣根过氧化物酶标记山羊抗鼠IgG (H+L)购自上海碧云天技术有限公司;蛋白酶抑制剂购自上海索莱宝生物科技有限公司;SDS-PAGE 凝胶快速制备试剂盒购自武汉赛维尔生物科技有限公司;Anti-COX IV antibody购自英国Abcam公司;cytochrome C antibody购自维百奥北京生物科技有限公司,蛋白预染Maker和PVDF膜购自美国Thermo公司,牛血清蛋白(BSA)购自德国Sigma公司,β-actin (43D) monoclonal antibody购自中国北京博奥森生物技术有限公司。激光扫描共聚焦显微镜(日本尼康株式会社),垂直电泳仪(美国Bio-Rad公司),超灵敏多功能成像仪(美国GE公司),Centrifuge 5430R 低温超速离心机(德国 Eppendorf 公司)。
1.2 实验方法
1.2.1线粒体的提取
小鼠禁食12 h后,腹腔注射4%的水合氯醛麻醉,待小鼠麻醉后,剪掉小鼠胡须,用消毒的镊子眼球取血0.5 mL,消毒的剪刀沿小鼠腹中线剪开,取出心、肝、脾、肺、肾、肌肉,在磷酸缓冲液中冲洗多余的血液后称重,取0.5 g的心、肝、脾、肺、肾、肌肉。将小鼠心、肝、脾、肺、肾、肌肉转移至装满0.5 mL预冷的磷酸缓冲液中剪碎,冰上放置 3 min后,4 ℃,600 g离心30 s,弃上清,组织沉淀中加入8倍体积预冷的胰酶消化液,重悬,冰上消化20 min,4 ℃,600 g离心30 s。加入2倍体积预冷的线粒体裂解液A,重悬,去除胰酶消化液,4 ℃,600 g离心30 s,弃上清。沉淀中加入8倍体积的线粒体裂解液A,重悬,转入至玻璃匀浆器中,在冰上匀浆20次后,收集匀浆液,1 000 g,重复试验4次,4 ℃离心5 min,取上清,4 ℃离心10 min得线粒体。
1.2.2线粒体蛋白量的测定
使用BCA法检测线粒体蛋白浓度。
1.2.3线粒体粒径和zeta电位检测
使用粒径分析仪测定外周血、肝脏组织、心脏组织来源的线粒体粒径大小。分别吸取1 mL液体置于玻璃检测皿,充分混匀确保样品均匀分散且无气泡产生,室温下平衡1 min,检测粒径大小。使用激光粒度分析仪测定的Zeta电位值。吸取制备的3种不同的溶液约1 mL于电位样品池皿中,连接仪器正负极后将样品放入,室温下平衡1 min后测定Zeta电位值。
1.2.4透射电镜观察线粒体结构
离心得到的线粒体沉淀用2.5%戊二醛4 ℃固定过夜后,用磷酸缓冲液冲洗3次洗去固定液,加入1%锇酸固定2 h,固定完成后磷酸缓冲液冲洗3次,经50%、70%、80%、90%和100%梯度的乙醇溶液脱水后,加入包埋剂37 ℃包埋1.5 h。切片机切片后用醋酸双氧铀和枸橼酸铅染色后,透射电镜下观察线粒体超微结构。
1.2.5共聚焦观察线粒体荧光
Mito-Tracker Green按照1∶5 000用细胞培养基稀释至工作浓度后,37 ℃细胞培养箱避光染色30 min,用磷酸缓冲液清洗3次,用磷酸缓冲液重悬滴至载玻片上,共聚焦显微镜下观察荧光强度。
1.2.6Western Blot检测蛋白水平
线粒体提取的最后一步中,将上清加入适量含PMSF的裂解液冰上裂解,沉淀加入线粒体裂解液,冰上裂解后,用BCA检测上清和线粒体沉淀的蛋白浓度。配胶,上样,电泳,转膜,BSA封闭液封闭1 h,敷一抗4 ℃过夜,洗膜,敷二抗室温1 h,洗膜显影观察细胞色素C氧化酶4(cytochrome c oxidase IV,COX IV)和细胞色素C(cytochrome C)、增殖细胞核抗原PCNA、肌动蛋白β-actin的蛋白表达情况。
1.2.7检测线粒体的ATP含量
用ATP标准品配制ATP标曲溶液,冰上用线粒体裂解液裂解相同量的线粒体悬液,充分混匀后,4 ℃,12 000 g离心5 min,小心吸取上清,取一部分用BCA检测其蛋白浓度。取干净的96孔黑板,每孔加入100 μL ATP检测工作液,室温静置3 min,每孔再加入20 μL的标准品或样品,用移液器反复吹打,立即化学发光法检测ATP含量。
1.2.8线粒体膜电位检测
取相同量的心脏、肝脏来源的线粒体悬液加入适量的JC-1检测工作液后,置于37 ℃的细胞培养箱中孵育20 min。染色结束后,600 g,4 ℃离心3~4 min,取沉淀。洗涤线粒体2次,磷酸缓冲液重悬,加至96孔黑板中,酶标仪检测红绿荧光,红绿荧光的比值即膜电位强度。
2 结果
2.1 不同组织来源对线粒体的功能影响
为了初步评价和筛选出高质量的线粒体,利用差速离心法(图1(a))提取C57 BL/6J小鼠的心、肝、脾、肺、肾、肌肉、外周血来源的线粒体,提取时间、提取量如图1(b)、图1(c)所示。根据线粒体的蛋白浓度对线粒体提取量进一步定量,结果如图1(d)所示。

图1 等量不同来源组织的线粒体水平评价
等量的心、肝、脾、肺、肾、肌肉、外周血用相同方法提取线粒体时,虽然外周血提取较心其他组织来源线粒体的步骤简单,耗时更少,但脾、外周血、肌肉来源提取的线粒体较少,心脏、肝脏来源的线粒体较多。由于外周血来源的线粒体提取较少,且呈红色,对线粒体ATP、线粒体膜电位(mitochondrial membrane potential,MMP)的评价有一定影响,因此只对心、肝、脾、肺、肾、肌肉来源提取的线粒体功能ATP、MMP进行评价,结果如图1(c)、图1(d)所示。肺、肌肉来源的线粒体ATP含量较高,心脏、脾脏次之,而比较MMP时,心脏来源的膜电位水平最优,其余组织的膜电位水平相当。综上所述,肺来源提取线粒体的量、线粒体功能都是较优的,但由于肺的密度较低,在液体中呈漂浮状,使提取难度加大,提取时间增多,如图1(b)所示,且影响线粒体的提取质量。因此肺不作为线粒体提取的最佳来源。而肌肉虽然其ATP含量较高,但其线粒体提取量、MMP水平都较低,也不作为线粒体的提取最佳来源。而肝脏、心脏从提取的量、线粒体功能等方面来评价,都是具有一定优势。因此,初步筛选出心脏、肝脏来源的线粒体作为线粒体提取来源的方案。
2.2 心脏、肝脏提取线粒体的表征
为了在心脏和肝脏两种线粒体提取来源中,遴选质量更佳的方式,我们进一步对心脏、肝脏两种不同来源提取的线粒体进行粒径、zeta电位和线粒体数量的检测。如图2(a)、图2(b)所示,肝脏组织、心脏组织提取的线粒体粒径都在0.5~5 μm,在正常线粒体大小范围内,并且心脏来源的线粒体较肝脏组织来源的线粒体粒径更大。最后对相同量心脏、肝脏2种来源的线粒体Mito-traker Green染色后,共聚焦显微镜下观察,检测结果如图2(c)、图2(d)所示,染色确定了心脏和肝脏提取的都为线粒体,并且进一步验证了相同质量的心脏组织和肝脏组织相比,心脏来源提取出的线粒体是多于肝脏,心脏来源的线粒体荧光强度也是强于肝脏来源的线粒体。

图2 等量的肝脏、心脏组织的线粒体提取效率
2.3 肝脏、心脏提取线粒体的纯度检测
为了对确定2种不同来源提取线粒体的纯度,利用Western Blot分析了心脏、肝脏的线粒体以及上清液的蛋白质水平。检测结果如图3(a)、图3(b)所示,从心脏、肝脏分离的线粒体中都没有胞浆标志蛋白β-actin和细胞核标志蛋白PCNA的表达,只有线粒体标志蛋白COX IV和cytochrome C的表达,证明两种组织来源提取的线粒体纯度都是较高的。而从图3(a)看出上清液中没有线粒体标志蛋白COX IV和cytochrome C的表达,而图3(b)中肝脏提取的线粒体上清有一部分线粒体标志蛋白COX IV和cytochrome C表达,说明肝脏来源的线粒体没有完全分离出来,还有少量线粒体存留在肝脏组织中。
2.4 肝脏、心脏提取线粒体的超微结构
为了分析提取不同来源线粒体的结构是否完整,透射电镜观察心脏、肝脏两种来源的提取线粒体超微结构(图4),发现心脏提取的线粒体大多呈球形或杆形,并且形态结构完整,线粒体外膜完整,线粒体嵴理清晰,无其他细胞器污染,而肝脏来源的线粒体虽然无其他细胞器污染,但形态结构不完整,部分线粒体外膜破碎,线粒体嵴模糊不清或紊乱,通过比较2种不同来源的线粒体发现心脏来源的线粒体形态结构更完整。

图3 肝脏、心脏提取线粒体的纯度检测
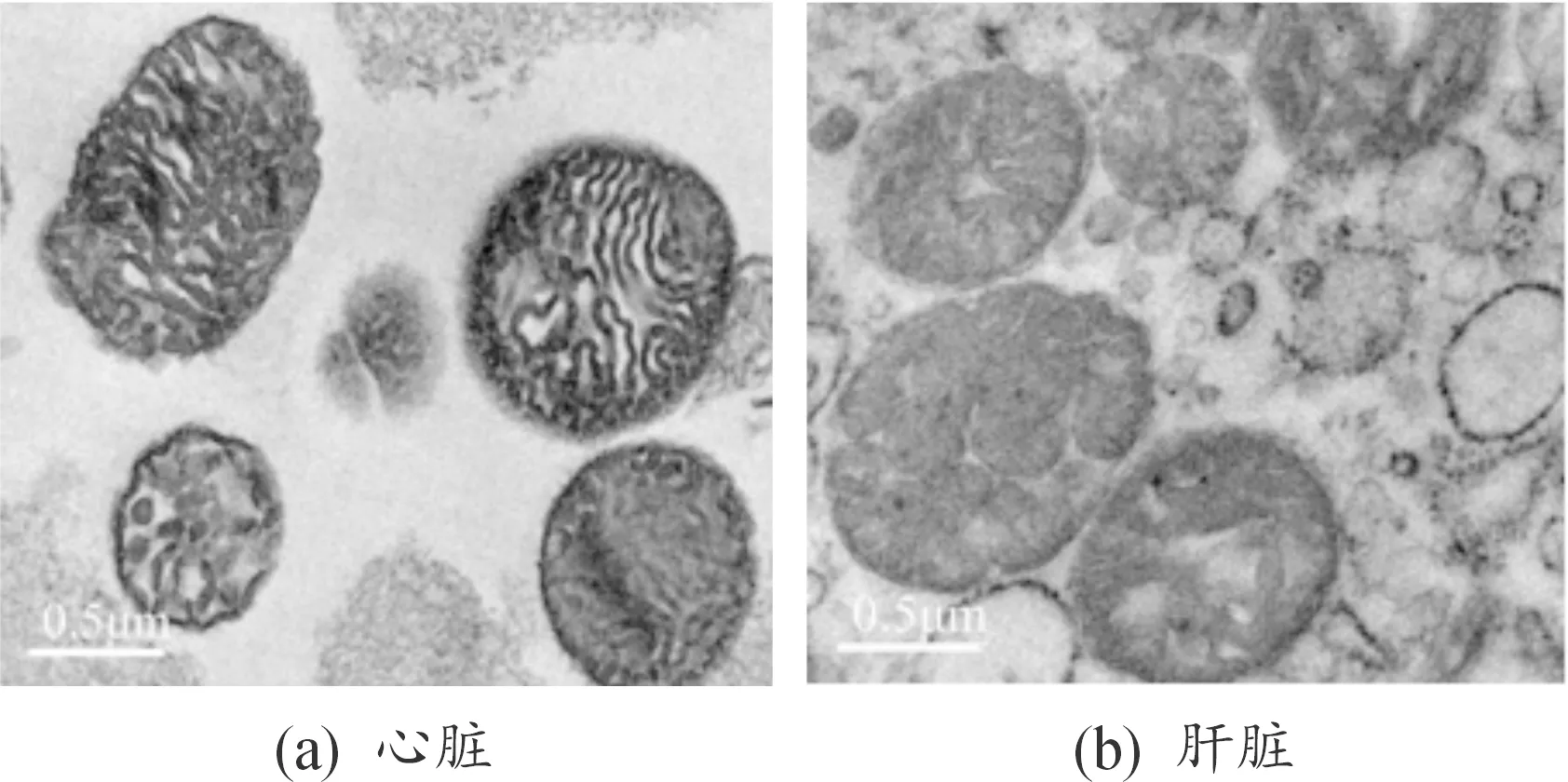
图4 心脏、肝脏来源提取线粒体的透射电镜图
2.5 心脏、肝脏提取线粒体的线粒体功能分析
在确定了提取线粒体的纯度和结构的情况下,进一步对提取的线粒体的生物活性进行分析,检测了线粒体功能指标:线粒体ATP含量和膜电位强弱。线粒体作为“细胞能量工厂”。通过氧化磷酸化和糖酵解产生ATP,因此ATP是反映线粒体状态及活性的关键指标。利用化学发光法检测心脏、肝脏分离的线粒体ATP含量,结果如图5(a)、图5(b)所示,心脏和肝脏来源提取的线粒体都具有正常的生物活性,线粒体ATP含量都随着线粒体的质量(5、25、50、100和200 μg) 呈剂量依赖性增加,但是,在相同质量的线粒体中,心脏来源的线粒体比肝脏来源的线粒体化学发光更强,即心脏来源的线粒体比肝脏来源的线粒体ATP含量更多,对图5(a)、图5(b)的化学发光强度进行统计分析,统计结果如图5(c)所示。膜电位的强弱作为判断线粒体功能的关键指标之一,用JC-1法检测心脏、肝脏来源提取的线粒体膜电位,CCCP为线粒体电子传递链抑制剂,会使膜电位显著降低,将其作为阳性对照组。检测结果如图5(d)所示,阳性对照组经过CCCP处理后,较心脏线粒体组和肝脏线粒体组显著降低,而心脏来源的线粒体膜电位与肝脏来源的线粒体相比显著增高。进一步证明了2种来源提取的线粒体都具有正常的生物活性,但心脏线粒体功能比肝脏线粒体更好。
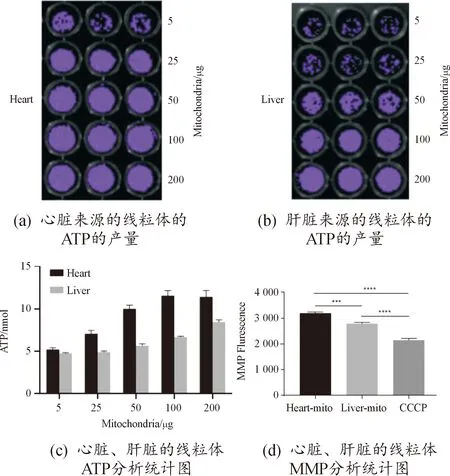
图5 心脏、肝脏提取线粒体的线粒体功能分析
3 讨论
线粒体是细胞中少数拥有独立遗传物质的细胞器,它可以为细胞的各种生命活动提供能量,参与细胞信号传导和生长通路等[10]。研究发现线粒体自噬、线粒体生物学变化和线粒体DNA突变等线粒体障碍是炎症反应的发生机制或进一步恶化的关键因素[11-13]。离体线粒体的研究已成为炎症相关疾病中线粒体损伤机制研究以及治疗研究的重要策略[14-15]。目前对于离体线粒体的提取原理大多是通过差速离心法,技术较为成熟[16]。然而,不同来源的线粒体在线粒体活性、线粒体数量以及提取时间上均具有较大的差异,会明显影响到研究结果的科学性与准确性。因此,对不同组织来源提取线粒体的效率、产率、质量与活性的评价,以确定最适合的离体线粒体组织来源,对于线粒体功能研究来说具有重要的意义。
本研究选择小鼠主要组织心、肝、脾、肺、肾、肌肉,以及外周血,系统比较了各种来源提取线粒体的提取量、线粒体功能的差异,并对其中提取效率最高的心脏和肝脏来源线粒体的形貌大小、线粒体相关蛋白水平以及线粒体生物活性进行了系统评价。
首先,在提取时间和具体方法的复杂性上,上述来源并无明显区别,均是先将组织或外周血处理为单细胞悬液,再裂解细胞后,利用细胞器密度差异,通过差速离心获得,但肺来源的线粒体由于肺组织的密度较低,对提取效率和提取结果存在一定的干扰,因此肺组织不作为线粒体提取的最佳来源。在线粒体提取效率方面,从相同量的心、肝、脾、肺、肾、肌肉、外周血中提取线粒体,我们发现,外周血的提取获得的线粒体产量最低。心脏和肝脏是小鼠中主要耗能器官,已被证实拥有丰富的线粒体[17]。因此,我们发现心脏和肝脏提取的线粒体产量最高,其中心脏提取的线粒体数量和质量均俱佳,这与心脏、肝脏的高耗能密切相关,也与其他在体对线粒体数量的研究基本相符[18-19]。而对线粒体功能评价表明,心脏和肝脏均来源的线粒体提取方法均具有较高的提取量、线粒体水平,而肌肉来源的线粒体提取量、MMP水平都较低,也不作为线粒体的提取最佳来源。
对于心脏和肝脏来源的线粒体,我们又进一步通过分析其中的胞浆蛋白、核蛋白以及线粒体膜蛋白、线粒体内膜蛋白的表达,比较了线粒体的纯度,发现两者均由较高的纯度,并从线粒体提取后残余细胞组分的分析,发现肝脏来源提取线粒体的产率较低的原因,可能其未完全提取肝细胞中线粒体有关。在线粒体质量与活性方面,我们发现心脏来源的线粒体更完整,外膜完整,线粒体嵴更清晰,心脏来源的线粒体ATP含量更多,膜电位也是高于肝脏来源的线粒体。因此,心脏来源的线粒体无论是从结构和生物学活性都是优于肝脏来源的线粒体。
综上所述,本研究证明了心脏来源的线粒体提取在效率、纯度、结构以及功能等方面都优于外周血和肝脏,一方面更适用于对非特定细胞中线粒体功能的研究,另一方面更佳的线粒体活性也更能充分发挥线粒体移植疗法在疾病动物中的治疗作用,因此本研究能对线粒体功能研究机制及线粒体移植治疗的研究提供线粒体组织来源的实验依据,对该领域的发展具有重要的推进作用。
