河南省假禾谷镰刀菌对多菌灵的敏感性
2022-02-22殷消茹徐建强
殷消茹, 徐建强*,, 孙 莹, 朱 凯, 杨 霞,熊 姿, 郑 伟, 侯 颖
(1. 河南科技大学 园艺与植物保护学院,河南 洛阳 471003;2. 河南科技大学 食品与生物工程学院,河南 洛阳 471003)
近年来,由于秸秆还田等耕作栽培措施的推广,主要由假禾谷镰刀菌Fusarium pseudograminearum引起的小麦茎基腐病成为一个日益严重的病害[1]。该病害在我国的黄淮麦区和华东麦区已普遍发生,带来的产量损失越来越严重[2-3]。由于目前尚无免疫及高抗品种可用,且尚无登记应用在小麦茎基腐病防治上的农化产品,生产中急需筛选一批对小麦茎基腐病有防治效果的化学药剂[4]。
多菌灵是20 世纪70 年代研发的苯并咪唑类类杀菌剂,对20 多种重要作物的重大病害均有很好的防治效果[5]。目前,共有6 种剂型被广泛应用在麦类、水稻、棉花、油菜、花生等多种作物上。尽管有些病菌对多菌灵已产生了严重的抗性[6-8],但截至目前尚未见有关假禾谷镰刀菌对多菌灵敏感性的报道。本研究采用菌丝生长速率法测定了2019 年采自河南省8 个地市的90 株假禾谷镰刀菌对多菌灵的敏感性,建立了敏感性基线,并分析不同地市菌株对多菌灵的敏感性差异,以评估多菌灵在小麦茎基腐病防治上的应用前景,旨在为生产中小麦茎基腐病的高效防治提供参考。
1 材料与方法
1.1 供试材料
供试菌株:于2019 年4–5 月份,从河南省8 个地市采集具有典型发病症状的茎基腐病株。将接近地面茎节交界处有霉层的部位剪下,放在加有乳酸的PSA 平板上,待长出菌落后转接保存。共分离439 株镰刀菌。从各地市选取有代表性的菌株,共150 株进行单孢分离,对获得的单孢菌株利用假禾谷镰刀菌 (Fpg-F,5′-CGGGGTAGTTT CACATTTCCG-3′/Fpg-R,5′-GAGAATGTGAT GACGACAATA-3′;扩增长度520 bp) 和禾谷镰刀菌 (Fg-F,5′-TTCTTTGACATCTGTTCAACC CA-3′/Fg-R,5′-ACAGATGACAAGATTCAGG CACA-3′,280 bp) 特异性引物进行分子鉴定,共获得假禾谷镰刀菌菌株105 株[9-10]。选取其中的90 株供试。
供试小麦品种:郑麦366,由河南省农业科学院植物保护研究所杨丽荣研究员提供。
供试药剂:98%多菌灵 (carbendazim) 原药,山东双星农药厂;98%戊唑醇 (tebuconazole) 原药,广西田园生化股份有限公司;97.9%咯菌腈(fludioxonil) 原药,先正达 (中国) 投资有限公司。多菌灵原药预溶于0.2 mol/L 的稀盐酸中,戊唑醇和咯菌腈原药均预溶于丙酮中,均配制成1.0×104μg/mL 的母液,置于4 ℃冰箱中保存,备用。50%多菌灵可湿性粉剂,江苏扬农化工集团有限公司。
1.2 试验方法
1.2.1 多菌灵对假禾谷镰刀菌最低抑制浓度测定
随机选取漯河舞钢菌株JFLW-8 和JFLW-10、信阳市菌株JFXY-17 和JFXY-19,采用菌丝生长速率法[11]测定多菌灵对假禾谷镰刀菌菌丝生长的最低抑制浓度 (minimum inhibitory concentration,MIC)。将新鲜菌饼接入药剂质量浓度分别为0.3、0.6、1.2、2.4 μg/mL 的PSA 平板上,以不含药剂的PSA 平板作对照。每处理3 个重复。28 ℃培养3 d 后,观察各药剂浓度处理下的菌落形态,以供试的全部菌株菌丝生长受到抑制的最小浓度作为多菌灵对假禾谷镰刀菌的MIC[11]。用十字交叉法测量菌落的直径,计算每种浓度处理下药剂对菌丝的生长抑制率。
1.2.2 假禾谷镰刀菌对多菌灵的敏感性测定 根据测定的MIC 值,将多菌灵原药溶于0.1 μg/mL的稀盐酸中,设置0.2、0.3、0.4、0.5、0.6 和0.8 μg/mL 的系列质量浓度,依次测定多菌灵对90 株假禾谷镰刀菌的毒力[12]。利用Excel 2007 和DPS6.55 计算药剂抑制菌丝生长的毒力回归方程、相关系数r和有效中浓度 (EC50)。
1.2.3 敏感性分布图绘制及敏感性基线确定 将多菌灵对假禾谷镰刀菌菌丝生长的EC50值从低到高分为4 个区间,从最小值开始,统计EC50值在每个区间的菌株数和频率。以每个区间的EC50平均值为横坐标,菌株分布频率为纵坐标,绘制假禾谷镰刀菌对多菌灵的敏感性频率分布图,并利用DPS6.55 进行Shapiro-Wilk 正态性检验。以多菌灵对正态性分布菌株的EC50平均值作为该病菌对多菌灵的敏感性基线[12]。
1.2.4 假禾谷镰刀菌对多菌灵和对戊唑醇、咯菌腈敏感性之间的相关性 从90 株假禾谷镰刀菌中随机选择对多菌灵敏感性不同的40 株病菌,采用菌丝生长速率法[13],分别测定其对戊唑醇和咯菌腈的敏感性,戊唑醇的质量浓度梯度设置为0.03125、0.0625、0.125、0.25、0.5 和1.0 μg/mL,咯菌腈的设置为0.005、0.01、0.02、0.03、0.04和0.05 μg/mL。每处理设3 个重复,以不含药剂的PSA 平板作对照。将多菌灵对菌株的EC50值作为x轴,戊唑醇或咯菌腈对菌株的EC50值作为y轴,进行线性回归分析,求出线性回归方程y=bx+a,根据决定系数 (R2) 、b值及F检验的显著水平 (P值) ,分析多菌灵对假禾谷镰刀菌的毒力和戊唑醇、咯菌腈之间的相关性:若P<0.05,b值为正,R2>0.8,则两种药剂之间存在正相关;若b值为负,R2>0.8,则两种药剂之间存在负相关;若P>0.05,两种药剂之间无相关[14]。
1.2.5 多菌灵对小麦茎基腐病的温室防治效果 分生孢子悬浮液制备:将菌株LYXA-8 (2019 年分离自洛阳市新安县) 的新鲜菌饼接入50 mL 绿豆汤培养液中,5 个/瓶,在25 ℃、150 r/min 摇床上光/暗交替培养5 d 后过滤,收集滤液,再经5000 r/min 离心后用无菌水重悬,制备孢子悬浮液,孢子浓度调整为1×106个/mL。
参照贺小伦的方法[15],略有改动。称取5 份籽粒饱满的郑麦366 种子,每份2 g,用75%乙醇消毒1 min 后用无菌水冲洗晾干;将其中3 份放在有效成分为1.17、2.34 和3.90 mg/g 的50%多菌灵可湿性粉剂溶液中,依次标记为T1、T2和T3,浸泡3 h 后晾干;另2 份种子作为空白对照与发病对照,分别标记为CK0和CK,其中CK0为经无菌水浸泡后直接播种,CK 为经无菌水浸泡后接种孢子悬浮液。将孢子悬浮液与无菌土按照质量比为0.75 : 100 的比例混匀,每一塑料杯分装200 g,将T1、T2、T3和CK 的麦种播种在塑料杯里,每杯播种7 粒,覆土30 g,置于25 ℃温室中培养 (光照12 h,黑暗12 h) ,21 d 后观察发病程度和小麦生长情况,测定发芽率、株高、根长及鲜重,统计发病率和级数。病情分级参照王莉莉等的标准[16],计算病情指数和防治效果。
1.3 数据分析
不同地区菌株间对药剂的敏感性差异采用DPS6.55 中的最小显著差异法 (least significant difference,LSD) 检验,并采用SPSS 20.0 软件进行聚类分析。
2 结果与分析
2.1 多菌灵对假禾谷镰刀菌菌丝生长的最低抑制浓度
结果 (图1) 表明:在0.3~2.4 μg/mL 范围内,随着多菌灵质量浓度的升高,菌丝生长抑制率逐渐增加,当多菌灵的质量浓度为2.4 μg/mL 时,其对4 个供试菌株的抑制率均达到100%,说明多菌灵抑制病菌菌丝生长的MIC 为2.4 μg/mL。
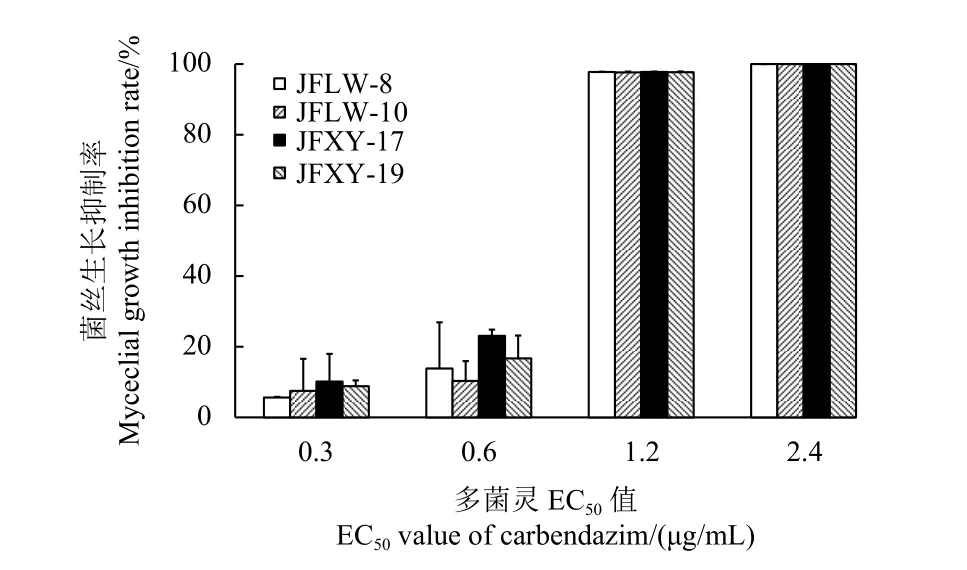
图1 多菌灵对假禾谷镰刀菌菌丝生长的最低抑制浓度Fig. 1 Minimum inhibitory concentration of carbendazim on mycelial growth of Fusarium pseudograminearum
2.2 假禾谷镰刀菌对多菌灵的敏感性及敏感基线
供试90 株病菌对多菌灵的EC50值在0.436~1.73 μg/mL 之间,最大值是最小值的3.98 倍,平均EC50值为 (0.750±0.291) μg/mL。Shapiro-Wilk正态性检验的结果显示,供试菌株对多菌灵的敏感性频率不符合正态分布 (W=0.8195,P=0.0000<0.05) ,但大部分菌株 (61 株,占67.78%) 位于相应的主峰范围内,敏感性频率分布仍为连续单峰曲线,故仍可将 (0.750±0.291) μg/mL 作为假禾谷镰刀菌对多菌灵的敏感性基线 (图2)。
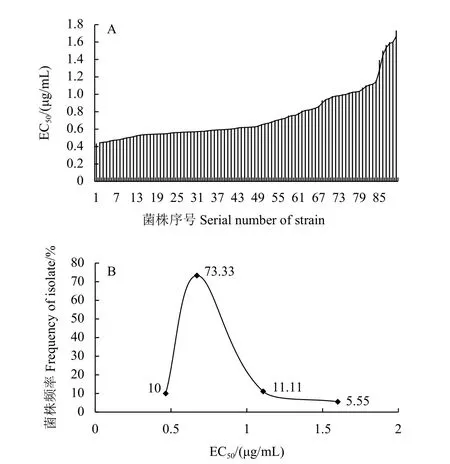
图2 假禾谷镰刀菌对多菌灵的敏感性(A)及频率分布(B)Fig. 2 Sensitivity (A) and frequency(B) of F.pseudograminearum to carbendazim
2.3 不同地市假禾谷镰刀菌对多菌灵的敏感性差异
由表1 可知,同一地市菌株对多菌灵的敏感性差异较大。其中南阳内乡的菌株间敏感性差异最大,敏感性最高是最低菌株EC50值的3.98 倍;商丘虞城、洛阳洛龙两地菌株,以及漯河舞钢、新乡红旗和信阳商城3 地菌株,两组之间差异不太明显;差异最小的为新乡辉县菌株,为1.84 倍。
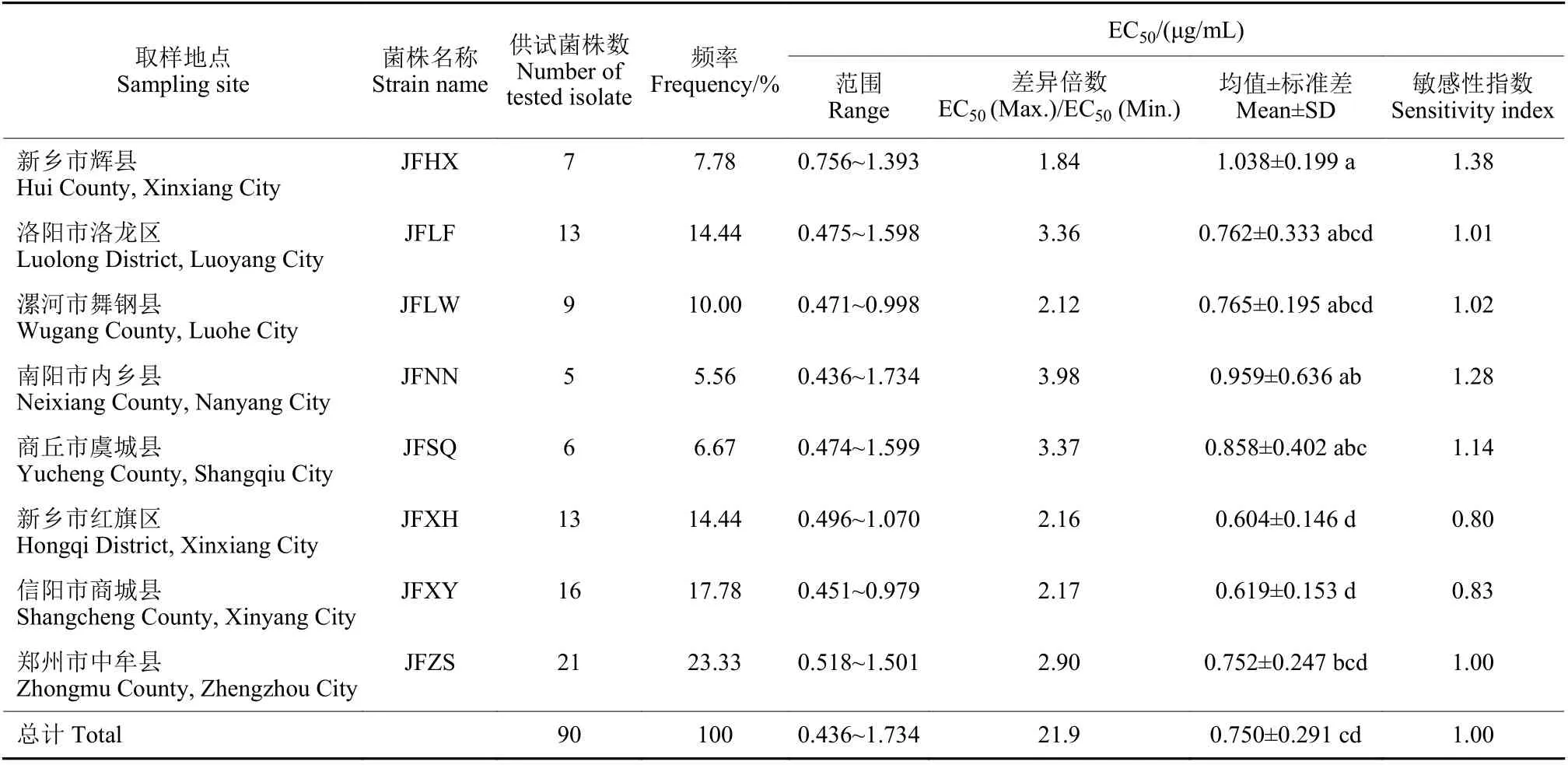
表1 河南省不同地市假禾谷镰刀菌对多菌灵的敏感性Table 1 Sensitivity to carbendazim of F. pseudograminearum from different areas in Henan Province
多菌灵对各地市菌株平均EC50值变化范围为0.604~1.04 μg/mL。新乡辉县菌株对多菌灵的敏感性最低,EC50均值为1.04 μg/mL,与其他地市菌株存在显著差异;而新乡红旗和信阳商城菌株,对多菌灵最为敏感,EC50均值分别为0.603 和0.619 μg/mL。新乡辉县和新乡红旗菌株,敏感性相差1.72 倍。其他5 个地市菌株,对多菌灵的敏感性不存在显著性差异。各地区菌株EC50均值与所有供试菌株的EC50均值相比,新乡红旗和信阳商城的敏感性高于河南省平均水平;新乡辉县、南阳内乡和商丘虞城低于河南省平均水平;而洛阳洛龙、漯河舞钢和郑州中牟则近于河南省平均水平。
2.4 不同地市菌株对多菌灵敏感性水平的系统聚类分析
从8 地市菌株各随机选择4 株,共32 株,采用S P S S 软件对多菌灵抑制病菌菌丝生长的EC50值进行聚类分析。由图3 可知,多菌灵对32 个菌株的EC50值分在5 个聚类组中。第1 组有来源于5 个地市的12 株菌株;第2 组有来源于3 个地市的4 株菌株;第3 组有来源于5 个地市的10 株菌株;第4 组有来源于2 个地市的5 株菌株;第5 组仅1 株菌株。除新乡红旗的菌株只聚类在第一组,辉县的菌株只聚类在第四组外,其他6 个地市的菌株均出现在不同的聚类组中,说明河南省同一地市的菌株对多菌灵的敏感性差异较大 (图3) ;而不同地市的菌株出现在同一聚类组中,说明假禾谷镰刀菌对多菌灵的敏感性差异与菌株来源地理位置无明显相关性。这与LSD 法的分析结果相一致。
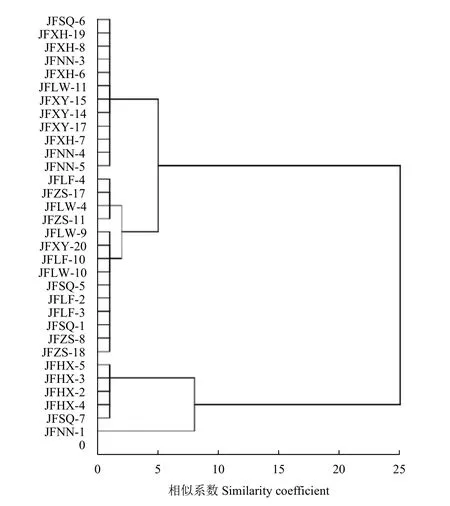
图3 河南省不同地市假禾谷镰刀菌对多菌灵敏感性水平的系统聚类分析Fig. 3 Hierarchical cluster analysis on EC50 values of carbendazim to F. pseudograminearum from different areas in Henan Province
2.5 假禾谷镰刀菌对多菌灵、戊唑醇和咯菌腈敏感性之间的相关性
多菌灵对40 株病菌的EC50平均值为 (0.755±0.336) μg/mL,戊唑醇对40 株病菌的平均值为(0.890±0.143) μg/mL,F检验的显著水平P=0.000 1<0.05,即两者在P=0.05 水平上差异显著;线性回归方程为y=0.183 9x−0.049 9,b为负值,R2=0.187 7,小于0.8 (图4),说明假禾谷镰刀菌对多菌灵的敏感性与其对戊唑醇不存在相关性。
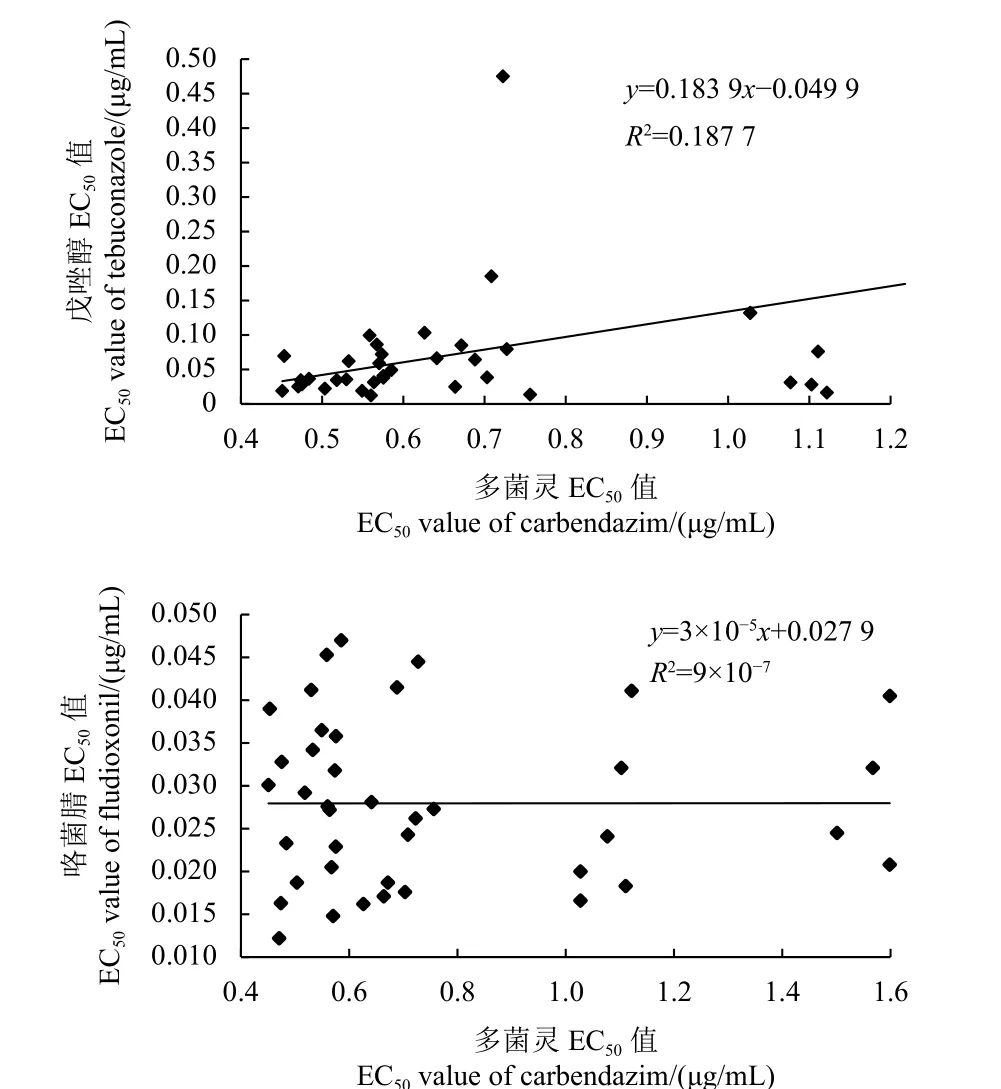
图4 假禾谷镰刀菌对多菌灵与其对戊唑醇、咯菌腈敏感性之间的相关性Fig. 4 Correlation of the sensitivity of F.pseudograminearum between carbendazim and tebuconazole or fludioxonil
多菌灵对40 株病菌的EC50平均值为 (0.755±0.336) μg/mL,咯菌腈对40 株病菌的平均值为(0.028 0±0.009 6) μg/mL,F检验的显著水平P=0.000 1<0.05,即两者在P= 0.05 水平上差异显著;线性回归方程为y= 3 × 10−5x+ 0.027 9,b为正值,R2= 9 × 10−7,小于0.8 (图4),说明假禾谷镰刀菌对多菌灵的敏感性与其对咯菌腈不存在相关性。
2.6 多菌灵对小麦茎基腐病的温室防治效果
温室试验结果(表2)表明:多菌灵有效成分剂量3.90 mg/g 拌种处理的防效最高,达到76.66%;其次为1.17 mg/g 拌种和2.34 mg/g 拌种,防治效果分别为51.32%和49.32%,且病情指数与对照差异显著。说明多菌灵在合理浓度下对小麦茎基腐病具有很好的防效。
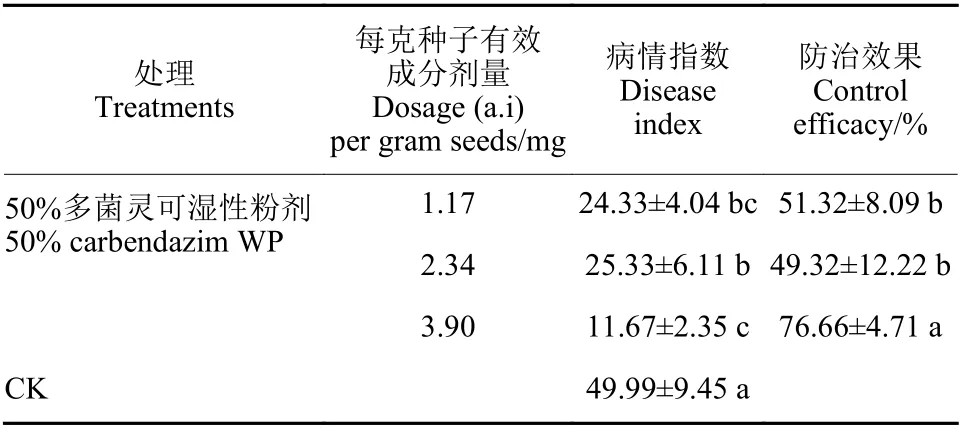
表2 多菌灵对小麦茎基腐病的温室防治效果Table 2 Control efficacy of carbendazim on wheat stem rot
由图5 可知,未经药剂拌种处理、且未接种茎基腐病菌 (孢子悬浮液) 的小麦幼苗长势最好,茎基部呈绿色,根系正常,生长状况良好 (图5-CK0)。未经药剂拌种处理,接种茎基腐病菌 (孢子悬浮液) 的小麦幼苗长势最差,茎基部呈褐色,呈现典型的茎基腐症状,根系发黄,生长不良,整个植株表现坏死症状 (图5-CK)。经药剂拌种处理且接种病菌孢子悬浮液的小麦幼苗,根、茎、叶均生长正常,无坏死现象,说明用50%多菌灵可湿性粉剂拌种对假禾谷镰刀菌的侵染和扩展具有很好的抑制效果 (图5-T1, T2, T3)。
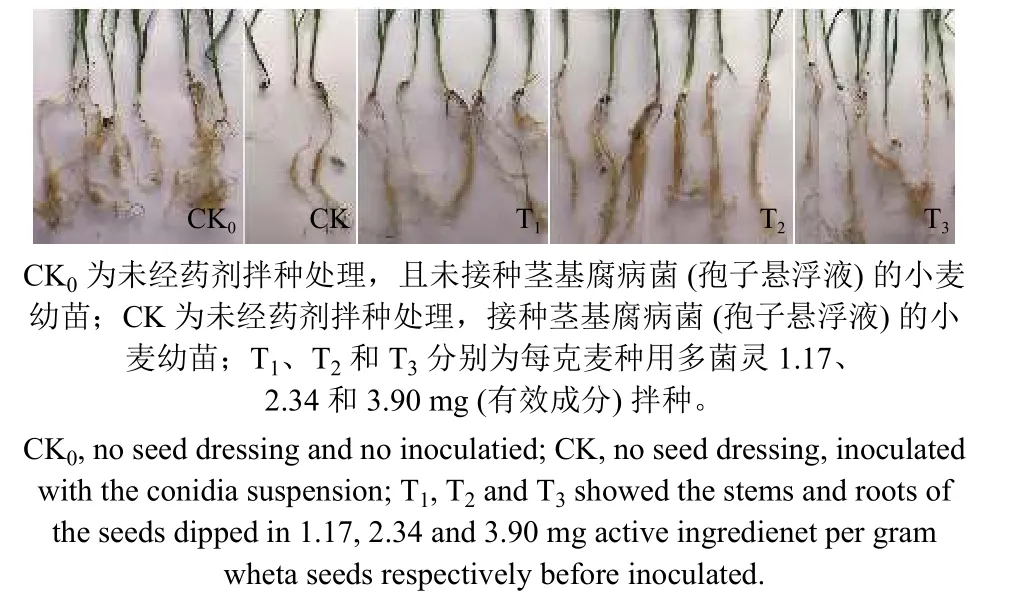
图5 多菌灵对小麦茎基腐病的温室防治效果Fig. 5 Greenhouse control efficacy of carbendazim on wheat stem rot
3 结果与讨论
本研究表明:多菌灵对假禾谷镰刀菌有很强的抑制作用,敏感性基线为 (0.585 ±0.083) μg/mL;假禾谷镰刀菌对多菌灵和对戊唑醇、咯菌腈敏感性间无明显相关性,生产中可以轮换使用这些药剂;多菌灵在温室条件下对小麦茎基腐病表现出较高的防效,显示出在病害防治上的应用潜力。
本研究中假禾谷镰刀菌对多菌灵的敏感性基线与周明国等建立的禾谷镰刀菌Fusarium graminearum对多菌灵的敏感性基线为 (0.575±0.013) μg/mL基本一致[17]。这表明多菌灵也可以应用在以禾谷镰刀菌为主要病原的麦田。但由于禾谷镰刀菌对多菌灵的抗药性风险较高,实际应用时可和戊唑醇、咯菌腈等药剂轮换应用,并监测病原菌对药剂的敏感性变化;或者使用多菌灵的复配剂。
禾谷镰刀菌对多菌灵产生抗药性的风险较高,抗药性主要是由其β2-tubulin 上167、198 及200 位氨基酸的突变引起[18]。假禾谷镰刀菌基因组序列尚未公布,其体内β-tubulin 的基因数目尚不清楚,对多菌灵的抗药性机制可能与禾谷镰刀菌有所不同。假禾谷镰刀菌对多菌灵的抗药性风险评估正在进行中,抗药性菌株的获得及病菌基因组序列的公开将有助于揭示假禾谷镰刀菌对多菌灵抗药性机制。
多菌灵可导致禾谷镰刀菌体内乙酰辅酶A 的积累,上调脱氧雪腐镰刀菌烯醇(DON)毒素的生物合成,故多菌灵在防治小麦赤霉病时会带来麦粒里毒素含量的增加[19]。病菌产生抗药性后,不仅造成防效下降,且抗药性菌株体内毒素含量较多,小麦受毒素污染更加严重[20]。多菌灵在小麦茎基腐病防治上的应用是否会带来毒素污染也应受到重视。由于病菌无法扩展到麦穗,产生的毒素也很难从茎秆向上转移,故发生茎基腐病的麦株,毒素多集中在第4 茎节下面的节间处[21]。田间应用多菌灵防治小麦茎基腐病时不会对粮食造成毒素污染,但对小麦秸秆做成的动物饲料有潜在威胁。
由于大面积实行轮作倒茬、秸秆还田等耕作栽培措施,土壤中的菌源量会逐年积累。所以单纯地依靠化学药剂秋季拌种或种子包衣措施防治小麦茎基腐病,不足以实现对茎基腐病的长期控制。以使用化学药剂为基础,深翻、轮作及其他栽培措施的综合利用将为持续治理小麦茎基腐病提供一条有效的解决途径[22]。
