芜菁的降血脂活性评价及作用机制探讨
2022-02-18刘建兵郑秋霞苏瀚星吴丽云
刘建兵,林 风,林 军,郑秋霞,苏瀚星,吴丽云
(福建省微生物研究所福建省红曲微生物技术开发应用工程研究中心,福建 福州 350007)
芜菁(Brassica rapaL.)别名蔓菁、芫根、盘菜、元根、圆根等,在藏药中又叫“妞妈”(《四部医典》)[1,2]。芜菁是十字花科芸苔属一年或二年生草本植物,植株可以高达1 m,根、茎、叶均可食用,其块根是重要的蔬菜,块根肉质,圆球形、扁圆球形或短圆锥形,其外形圆似萝卜,味甜,密实度高。芜菁是藏区传统的药食两用植物,《本草纲目》、《太平圣惠方》中早有记载:“其气味苦,温,无毒,具有美容、醒酒、促消化,增强体质等功效”,芜菁还是一种味道鲜美,安全无毒的蔬菜,在藏区享有“小人参”美称[3]。现代药理学研究也表明,芜菁富含黄酮、多糖、三萜、硫代葡糖糖苷、脂肪酸等多种生物学活性成分,具有显著的抗炎、抗氧化、抑菌、抗疲劳、免疫调节、抗肿瘤和降血脂等功效,在食品和医药领域正受到广泛的关注[4]。Li 等[5]通过小鼠模型发现芜菁多糖可调节炎症因子和凋亡因子,降低四氯化碳诱导的小鼠急性肝损伤,提示芜菁多糖具有开发成保肝药的潜力;张发斌等[6]以糖尿病模型小鼠为研究对象,发现芜菁正丁醇提取物可有效降血压、降血脂、提高胰岛素水平。
高脂血症是一种在患者血浆内一种或多种脂类异常超标的全身性疾病,可表现为血脂总胆固醇、三酰甘油、低密度脂蛋白胆固醇的异常。随着经济水平的发展,生活水平的提高,人们的膳食营养日益增加,但高脂血症患者数量也不断增加,在我国血脂异常患者已达1.6 亿人。高脂血症是糖尿病、动脉粥样硬化、冠心病、脑卒中等心脑血管疾病的主要诱因之一,因此预防和控制高脂血症对于心血管疾病的预防有着重要的意义。目前,对高脂血症主要通过饮食或药物治疗,其中他汀类药物是应用最广泛的降脂药物,但是药物治疗停药后很容易反弹,还会带来一定的毒副作用,因此寻找一种安全有效的措施来预防和治疗高脂血症变得越来越重要[7]。
本文旨在通过体外胆酸盐结合实验和细胞模型评价芜菁的降血脂活性,再利用网络药理学方法对芜菁的降血脂作用机制进行分析,为芜菁的降血脂作用研究及其功能性食品的开发利用提供理论依据。
1 材料与方法
1.1 药物及药剂
芜菁块根样品购于西藏林芝市;HepG2 细胞购自赛百慷(上海)生物技术股份有限公司。甘氨胆酸钠、牛磺胆酸钠和脱氧胆酸钠购于上海麦克林生化科技有限公司;胃蛋白酶、胰蛋白酶、MTT、油红O、油酸购买于北京索莱宝科技有限公司;RPMI-1640 培养基、胎牛血清、双抗(青霉素/链霉素)、胰酶均购自美国Gibco 公司;甘油三酯(TG)和蛋白浓度测定试剂盒购自南京建成生物工程研究所;总胆固醇(TC)试剂盒购自浙江东瓯诊断产品有限公司;NaOH、无水乙醇等其他试剂均购于中国国药公司;Thermo Scientific Varioskan LUX 多功能酶标仪。
1.2 芜菁水提物的制备
将干燥的芜菁块根样品切成薄片,按3%的料液比加入蒸馏水,于90 ℃水浴锅中提取1 h,抽滤,滤液先用旋转蒸发仪浓缩10 倍后,再冷冻干燥即得芜菁水提物。
1.3 芜菁水提物对胆酸盐吸附率测定
用以0.1 mol/L、pH=6.3 的磷酸缓冲溶液分别配制不同浓度的甘氨胆酸钠、牛磺胆酸钠和脱氧胆酸钠标准溶液(0.01、0.05、0.1、0.25、0.5、0.75、1 mmol/L),取1 mL 于具塞试管中,加入3 mL 质量分数60%的H2SO4溶液于70 ℃水浴20 min,取出冰浴5 min,在387 nm 波长处测定吸光度。以胆酸盐含量为横坐标,吸光度为纵坐标绘制标准曲线。
芜菁水提物粉末加水复溶后,配制成2、5、7 g/L的芜菁水提物样品,分别取5 mL 于具塞试管中,以蒸馏水作为空白对照。再加入3 mL 10 g/L 胃蛋白酶,1 mL 0.01 mol/L 的HCl 溶液,在37 ℃条件下恒温振荡1 h,模拟胃部消化环境;再用NaOH 溶液调节pH 至6.3 后,加入4 mL 10 g/L 胰蛋白酶,在37 ℃条件下恒温振荡1 h,模拟肠道消化环境。每个样品再分别加入4 mL 0.4 mmol/L 甘氨胆酸钠、0.5 mmol/L 牛磺胆酸钠和1 mmol/L 的脱氧胆酸钠,在37 ℃条件下恒温振荡进行胆酸盐结合实验,1 h 后转移至离心管中4 000 r./min 离心20 min,取1 mL上清液进行胆酸盐含量检测,由标准曲线求得样液中胆酸盐的浓度,每个样品做3 个平行。胆酸盐结合率=(C0-C1)/C0×100,式中:C0为胆酸盐加入量,C1为胆酸盐剩余量。
1.4 MTT 实验
HepG2 细胞用含有10%胎牛血清和1%双抗的RPMI-1640 培养液,于37 ℃、5% 的CO2培养箱中培养。取对数生长期的HepG2 细胞接种于96 孔板中,每孔接种100 μL。培养过夜后吸弃上清,加入含不同浓度芜菁水提物(0.10、0.35、0.70、1.00、1.40 g/L)的培养液,同时设置对照组、溶剂对照组和调零孔,每个处理6 个平行。继续培养24 h 后,弃上清,加入10% MTT(5 g/L)100 μL,继续培养4 h,加入二甲基亚砜(DMSO)150 μL,充分混匀5 min,在490 nm 波长处测各组OD 值。通过以下公式计算细胞存活率:细胞存活率=(OD实验组-OD调零孔)/(OD对照组-OD调零孔)×100%。
1.5 油红O 染色实验
实验设置空白对照组(control group)、模型组(model group)、阳性对照组(lovastatin)和不同浓度的芜菁水提物干预组(WET)。取对数生长期的HepG2 细胞接种于96 孔板中,每孔接种100 μL。培养过夜后吸弃上清,除空白对照组加入完全培养液外,其余各组加入含0.3 mmol/L 油酸的培养液处理24 h,造模成功后模型组换成完全培养液,阳性对照组加含100 mg/L 洛伐他汀的培养液处理,不同浓度的芜菁水提物干预组分别添加含不同浓度(0.10、0.35、0.70、1.00、1.40 g/L)芜菁水提物的培养液处理。处理细胞24 h 后,弃去培养基,PBS 清洗,用体积分数为10%的中性甲醛溶液固定20 min 后,再以PBS 清洗3 遍,油红避光染色40 min。染色完成后,以体积分数为60%的异丙醇溶液快速清洗,加PBS二次清洗,于显微镜20 倍下观察细胞形态。观察过后,加入体积分数为60%的异丙醇溶液,室温静置40 min,振板10 min,在528 nm 处检测吸光值,根据下式计算脂变率:脂变率=(OD给药组-OD调零组)/(OD对照组- OD调零组)×100%。
1.6 细胞内TG、TC 水平测定
取对数生长期的HepG2 细胞接种于6 孔板中,每孔接种1 mL。实验分组及给药同油红O 染色实验,细胞给药处理完后加胰酶消化,收集至1.5 mL离心管中,用PBS 清洗2 遍,最后加入250 μL PBS,用超声破碎细胞,按照试剂盒说明书操作测定总蛋白、TG、TC 含量。
1.7 统计学处理
采用SPSS20.0 软件进行单因素方差分析(ANOVA)、t-检验和LSD 检验,P<0.05 为差异具有统计学意义。
1.8 芜菁活性成分和靶点的筛选
通过检索PubMed、中国知网、等数据库文献收集芜菁块根中的活性成分,并将活性成分的canonical SMILES 导入至admetSAR 平台(http://lmmd.ecust.edu.cn/admetsar2/)进行分子性质预测,筛选符合类药五原则[(1)分子量小于500;(2)氢键给体数目小于5;(3)氢键受体数目小于10;(4)脂水分配系数小于5;(5)可旋转键的数量不超过10 个]的活性成分进行下一步分析。将活性成分的结构文件导入 SwissTargetPrediction (http://www.swisstargetprediction. ch/)和 SEA Search Server(https://sea.bkslab.org/)平台进行反向分子对接靶点预测,限定物种为“Homo sapiens(Human)”,将靶点导入Uniprot 数据库进行靶基因注释,并校正为官方名称(Official symbol),取并集得到芜菁的活性成分作用的相关靶点。
1.9 高血脂相关靶点检索与筛选
以“hyperlipidemia”为关键词在GeneCards 数据库(http://www.genecards.org/)中检索高血脂相关靶点,物种限定为“Homo sapiens”。选择“Relevance score”值大于2 的靶点作为高血脂相关靶点。
1.10 “化合物-靶点”网络的构建
高血脂相关靶点与芜菁的活性成分作用的相关靶点取交集,并将数据导入到Cytoscape3.6.1 软件中构建“化合物-靶点”相互作用网络并做网络分析。
1.11 GO 和KEGG 通路的富集分析
将靶点导入DAVID 数据库(https://david.ncifcrf.gov/),进行基因本位论(GO)和京都基因与基因组百科全书(KEGG)通路富集分析。GO 富集分析,包含生物过程(BP),分子功能(MF)和细胞组成(CC)3 个部分,根据(false discovery rate,FDR)分别选择排名前10 条的结果绘制柱状图。KEGG通路分析结果以P<0.01,Count>3 为显著信号通路。
1.12 蛋白互作网络(PPI)的构建与分析
将交集靶点上传至String 数据库(https://string-db.org/),物种选为Homo sapiens,设置“Minimum required interaction score”为0.7(高可信度)。并将数据导入到Cytoscape3.6.1 软件中构建网络并做网络分析。
2 结果
2.1 芜菁提取物胆酸盐结合能力分析
人体内胆固醇的主要分解途径是转变成胆酸盐,胆酸盐又可以经过肠道-肝脏进行回收,所以通过结合消化道中胆酸盐,以此有效排除体内胆汁酸,间接降低胆固醇含量,达到降低血脂的目标[8]。如图1 所示,芜菁水提物对甘氨胆酸钠、牛磺胆酸钠和脱氧胆酸钠3 种胆酸盐都有一定的结合能力,且随着芜菁浓度的增加而增强。在添加7 g/L 时对这3 种胆酸盐结合达到最大,分别为36.01%、28.93%、78.55%。

图1 芜菁提取物体外结合甘氨胆酸钠、牛磺胆酸钠和脱氧胆酸钠能力Fig 1 Effect of Brassica rapa aqueous extract(BRAE)on bile salt-binding capacity(sodium glycylcholate,sodium taurocholate and sodium deoxycholate)
2.2 芜菁对油酸诱导的脂肪肝细胞的降血脂作用
2.2.1 芜菁对细胞活力的影响 采用MTT 法评估芜菁提取物作用下的细胞毒性,见图2A。结果表明,芜菁提取物在0.10~1.40 g/L 浓度下对HepG2细胞活力无显著影响(P>0.05),细胞活力均在90%以上,说明芜菁提取物无显著细胞毒性,并具有良好的细胞相容性。
2.2.2 芜菁取物对细胞内脂质堆积的影响 油酸可通过影响肝细胞的糖脂代谢的平衡,造成糖脂代谢的紊乱,形成脂滴堆积而发生一系列的病变,利用油酸作为诱导剂,复制肝细胞脂肪变性模型是研究脂肪肝、肥胖等一些代谢性疾病的一种重要手段。通过油红染色观察(图2C)和半定量检测(图2B)分析不同剂量的芜菁提取物对细胞内脂质堆积的影响,结果显示经油酸诱导后的模型组内所有细胞均可见密集的红色脂滴,显著的高于空白对照组(P<0.01),说明建模成功。经不同剂量(0.10~1.40 g/L)的芜菁提取液干预后,红色脂滴的密度均有不同程度的减少,且随着剂量的增加脂滴越少,1.40 g/L 的剂量组(g)与阳性对照洛伐他汀组(h)的效果相当。
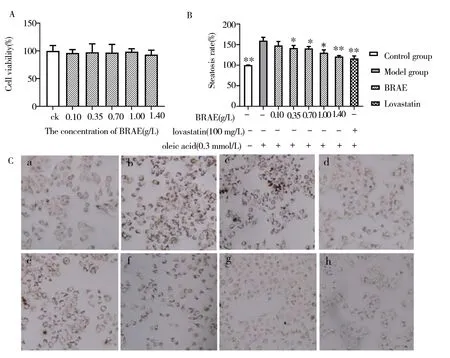
图2 芜菁提取物对油酸诱导后细胞内脂质堆积的影响Fig 2 Effect of Brassica rapa aqueous extract(BRAE)on intracellular lipid accumulation induced by oleinic acid
2.2.3 芜菁提取物对细胞内TG、TC 水平的影响
TG、TC 水平是临床上用来诊断高血脂的常用指标。本文以芜菁提取液1.40 g/L 的浓度处理为例,分析其对油酸诱导的高脂细胞内的TG(A)和TC(B)水平的影响。由图3 可以看出,模型组细胞内的TG(图3A)和TC(图3B)水平均显著的高于空白对照组(P<0.01),而经过芜菁提取液干预组,TG 和TC 水平均显著降低(P<0.01),尤其是TC 水平,与空白对照组相比,差异无统计学意义(P>0.05)。

图3 芜菁提取物对油酸诱导后细胞内TG(A)和TC(B)含量的影响Fig 3 Effect of BRAE on TG and TC Levels in HepG2 cells
2.3 基于网络药理学对芜菁降血脂的机制分析
2.3.1 芜菁活性成分筛选 本研究共确定了21 个有效成分(表1)。

表1 芜菁活性成分信息Tab 1 Information of active components of Brassica rapa
2.3.2 芜菁活性成分潜在降血脂靶点筛选 利用Swiss Target Prediction 和SEA Search Server 平台预测芜菁活性成分的靶点,去除重复后共获得活性成分的潜在靶点682 个,与高血脂相关靶点取交集,整理合并后得交集靶点共55 个。芜菁21 个有效成分中与高血脂相关靶点有互作关系的有15 个,包括6 个糖苷类化合物(苄基α-D-果糖呋喃糖苷、正戊基β-D-果糖呋喃糖苷、苄基-β-D-吡喃葡萄糖苷、2-C-β-D-吡喃葡萄糖基-1-甲氧基吲哚-3-乙腈、乙酮-1-C-β-D-吡喃葡萄糖苷、乙基β-D-吡喃葡萄糖苷),3 个黄酮类化合物(甘草素、4,4'-二羟基-3'-甲氧基查耳酮、利可考酮A),2 个酚类化合物(6-姜酮酚、6-姜烯酚),2 个异硫氰酸盐类(2-苯乙基异硫氰酸酯、异硫氰酸苄酯)和2 个其他类化合物(石竹烯、吲哚乙腈)。由“合物-靶点”网络图(图4)可以看出,该网络由71 个节点和137 条边构成,其中6-姜酮酚(6-paradol)、6-姜烯酚(6-shogaol)、苄基-β-D-吡喃葡萄糖苷(benzyl-beta-D-glucopyranoside)、苄基α-D-果糖呋喃糖苷(benzyl-alpha-D-fructofuranoside)和甘草素(liquiritigenin)的度值(degree)较高,均与10 个以上靶点互作,由此可以推测其是芜菁降血脂的主要活性成分。

图4 化合物-靶点网络图Fig 4 Compound-target network
2.3.3 芜菁活性成分潜在降血脂靶点PPI 蛋白互作网络构建与分析 将55 个交集靶点上传至STRING 数据库,得到蛋白互作网络图,如图5 所示。此网络中的靶点相互作用产生了118 条边,平均最短路径长度为1.979,平均聚类系数为0.250,平均度值为5.2。主要靶点包括VEGFA、IL6、EGFR、PPARG、MMP9、MPO、F2、SERPINE1、TLR4、MGAM 等,其中度值≥10 的有4 个,VEGFA(度值=18)、IL-6(度值=17)、EGFR(度值=13)、PPARG(度值=12),推测这些靶点是芜菁降血脂的关键靶点。

图5 芜菁活性成分潜在降血脂靶点PPI 蛋白互作网络Fig 5 PPI network of potential lipid-lowering targets of active ingredientsof Brassica rapa
2.3.4 芜菁活性成分潜在降血脂靶点GO 富集分析 GO 富集分析结果如图6 所示,包括生物学过程(BP),细胞组分(CC),分子功能(MF),其中富集到172 个BP 条目,占比69.35%。根据FDR(false discovery rate)分别列出了排名前10 条的结果,主要涉及carbohydrate metabolic process、glycogen catabolic process、cholesterol homeostasis、cholesterol metabolic process 等生物学过程,extracellular space、extracellular exosome、extracellular region 等细胞组分和steroid hormone receptor activity、steroid binding、glycogen phosphorylase activity 等分子功能。表明芜菁能通过参与体内多种生物学调控过程以发挥降血脂作用。

图6 芜菁活性成分潜在降血脂靶点GO 富集分析Fig 6 Analysis of GO enrichment of potential targets for lowering blood lipid in active ingredients of Brassica rapa
2.3.5 芜菁活性成分潜在降血脂靶点KEGG 通路富集分析 KEGG 通路分析结果显示,芜菁降血脂的潜在靶点共涉及36 条信号通路。图7 列出了P<0.01 且通路中靶个数(Count)>3 的为显著信号通路,主要包括淀粉和蔗糖代谢、半乳糖代谢、胰岛素抵抗、胰岛素信号通路、HIF-1 信号通路、PI3K-Akt信号通路等。

图7 芜菁活性成分潜在降血脂靶点KEGG 通路富集分析Fig 7 Enrichment analysis of KEGG pathway of potential target for blood lipid-lowering active ingredients in Brassica rapa
3 讨论
芜菁在我国有悠久的栽培应用历史,作为味道鲜美的蔬菜被大量种植,随着对芜菁研究的不断深入,其越来越多的功效作用被人们发现,比如抗炎、抗氧化、抑菌、抗疲劳、免疫调节、抗肿瘤和降血脂等。其中,芜菁的降脂减肥作用越来越多的被人们关注,陈志鹃等[16]研究了芜菁的总皂苷提取物的降脂减肥作用,给高脂饮食诱导的肥胖大鼠模型灌胃芜菁总皂苷提取物45 d 后,其血清中超氧化物歧化酶、谷胱甘肽过氧化物酶、脂蛋白脂酶和肝脂酶的活性相比于模型组均不同程度的升高了,而丙二醛、游离脂肪酸、痩素的含量显著的降低了。皮宁宁等[17]研究了芜菁乙醇提取物的降血脂作用,结果显示,芜菁乙醇提取物能够显著的降低高血脂症大鼠血清中甘油三酯和总胆固醇水平,还能够显著升高高密度脂蛋白胆固醇(HDL-C)水平,其效果比阳性对照物地奥脂必妥片更好。本研究通过体外胆酸盐结合实验和细胞模型评价了芜菁的降血脂活性,实验结果表明芜菁水提物在体外有很好的降血脂效果,芜菁水提物对甘氨胆酸钠、牛磺胆酸钠和脱氧胆酸钠都有一定的结合能力,在7 g/L 时结合率分别为36.01%、28.93%和78.55%。芜菁水提物对油酸诱导的HepG2 脂肪变性细胞有显著的脂肪堆积抑制效果,1.4 g/L 的抑制效果与阳性对照物洛伐他汀的效果相当,其还能显著降低细胞内TG、TC 水平,这与文献报道的结果相一致。
网络药理学是一种从系统生物学角度,结合生物学数据库和生物信息学方法分析药物对疾病作用机制的新方法,它能更全面地认识药物与机体之间的相互作用关系[18]。相比于传统“一个药物、一个基因、一种疾病”的药物开发模式,网络药理学更能契合中药“多成分-多靶点-多通路”发挥整体协同作用的特点,以多维化视角阐明中医药所蕴含的内涵,已成为中医药深入发展的一个得力助推手。
本研究利用网络药理学方法,进一步对芜菁降血脂作用的机制进行了探讨。收集到芜菁块根中符合类药五原则的活性成分21 个,并通过构建的“化合物-靶点”网络图分析出芜菁中的糖苷类和酚类类化合物在发挥降血脂功效中起到了重要作用,其中核心成分为6-姜酮酚、6-姜烯酚、苄基-β-D-吡喃葡萄糖苷、苄基α-D-果糖呋喃糖苷和甘草素。6-姜酮酚和6-姜烯酚是常见于生姜中的活性成分,具有抗炎、抗肿瘤、抗氧化、降血脂,以及心血管和神经保护等活性,Wu 等[14]从新鲜的芜菁块根中,用硅胶柱、Sephadex LH-20 柱多次反复层析分离出6-姜酮酚和6-姜烯酚。6-姜酮酚是由6-姜烯酚在样品干制、加工过程中转化而来,是芜菁辛辣感的主要来源物质[19]。Wei 等[20]经细胞和动物实验证实,6-姜酮酚是由6-姜烯酚具有降脂降血糖功效,其可以通过增强AMPK 酶的磷酸化作用,来提高3T3-L1 脂肪细胞和C2C12 肌管细胞对葡萄糖的利用率,也能显著降低肥胖小鼠的体重、胆固醇和血糖指标。
根据构建的PPI 蛋白互作网络图,分析得出VEGFA、IL-6、EGFR、PPARG 4 个靶点的度值≥10,可能是芜菁降血脂的关键靶点。VEGFA(血管内皮生长因子,vascular endothelial growth factor),是一个重要的促进血管生长因子,对修复和维持血管内皮细胞功能具有重要的作用,并且被证实参与多种疾病的发生发展过程,包括冠心病、肿瘤、糖尿病及血脂异常等。多篇文献报道VEGFA 与血脂异常密切相关,其可以通过抑制内皮脂酶、LPL 和固醇调节元件结合蛋白-2 等基因的表达,来达到降血脂效果。通过本研究中的“化合物-靶点”可以看出,芜菁中的6 个糖苷类化合物和2 个黄酮类化合物(甘草素、4,4'-二羟基-3'-甲氧基查耳酮)均与VEGFA 靶点有互作关系。IL-6(Interleukin-6)是一种由巨噬细胞、脂肪细胞和T 细胞分泌的重要促炎症因子,能介导细胞增殖、血管炎症过程和调节多种炎症反应的进展[21]。高血脂患者一般都伴随着低级慢性全身炎症,有文献指出IL-6 与血脂异常密切相关,并且在调节血脂和体重的过程中发挥着重要作用,其可以通过抑制肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α),降低胰岛素抵抗,从而调节机体的血糖血脂水平[22]。芜菁中的6-姜酮酚和甘草素可PPARG 靶点产生互作,PPARG 是肪组织中调控脂肪酸代谢的关键转录因子,也是临床上当作治疗脂肪酸紊乱的靶基因[23]。
综上所述,本研究通过体外实验得出芜菁水提物具有很好的降血脂效果,其能显著的降低细胞内TG、TC 水平和脂肪堆积。并应用网络药理学探讨了芜菁的降血脂机制,芜菁中的6-姜酮酚、6-姜烯酚、苄基-β-D-吡喃葡萄糖苷、苄基α-D-果糖呋喃糖苷和甘草素等活性成分,与VEGFA、IL-6、EGFR、PPARG 等靶点进行互作,调控淀粉和蔗糖代谢、胰岛素抵抗、HIF-1、PI3K-Akt 等信号通路来达到降血脂效果,这体现了其多成分-多靶点-多途径的整体协同作用。本文为深入研究芜菁的药理机制提供了理论依据,但预测结果不能完全证明其正确性,还需要根据本研究结果开展系统严谨的生物学验证。
作者贡献度说明:
刘建兵:课题设计、实施及撰写全文;林风:课题设计,提供实验材料及理论指导;林军:实施部分实验内容;郑秋霞:实施部分实验内容;苏瀚星:实施部分实验内容;吴丽云:课题设计及理论指导。
