术前PLR 联合NLR 检测在肺癌预后评估中的价值
2022-02-18上官子妍胡凯文
上官子妍,陈 琪,姜 敏,胡凯文
(1.北京中医药大学,北京 100029;2.北京中医药大学东方医院,北京 100078)
恶性肿瘤是危害人类健康的重要疾病之一,根据世界卫生组织最新统计报告[1],2020 年全球新增癌症患者1 930 万例,肺癌依旧是癌症死亡的首要原因。数据同时表明,在中国肺癌患者的发病人数和死亡人数分别占全球总人数的37.0% 和39.8%[2]。因此,肺癌在未来很长一段时间内都将是我国公共卫生领域面临的重要问题。
由于缺乏有效的早期诊断方法,临床上只有20%~30%的肺癌患者能够早期发现并行常规根治性手术治疗,大多数肺癌患者在确诊时已属中晚期,失去了手术机会,或由于基础疾病较多、心肺功能不佳等原因并不适合手术治疗。姑息性放化疗、生物靶向治疗以及各种微创治疗技术为这类患者提供了更多的选择机会。冷消融治疗是目前肿瘤微创治疗的主要技术,以氩氦刀为代表的超低温冷消融是目前我国临床应用的主要肿瘤冷消融技术手段,可用于早期肺癌的根治性治疗和中晚期肺癌的姑息性治疗[3]。由于患者的个体性差异较大,对于同样接受氩氦刀冷消融的患者,术后疗效也都截然不同。及早预测评估冷消融术对预后的影响,对于患者治疗方法的选择至关重要。现代研究表明,血小板/淋巴细胞比值(PLR)以及中性粒细胞/淋巴细胞(NLR)可以反映机体免疫状态,与消化道肿瘤、肝癌、肾细胞癌、宫颈癌等预后都密切相关[4-8],可能会成为敏感有效的预后评估指标,因此本研究观察术前PLR 联合NLR 对肺癌冷消融患者术后生存期的关系,为临床预测患者预后提供客观依据。
1 资料与方法
1.1 研究对象
选取2012 年1 月~2018 年3 月于本院行肺氩氦刀冷冻消融术的原发性肺癌患者的病例资料。本研究共纳入214 例患者,其中男性152 例,女性62例,年龄39.2~84.8 岁,中位年龄66.5 岁。按照组织病理学分型,其中腺癌106 例;鳞癌62 例,大细胞癌3 例,腺鳞癌7 例,肉瘤样癌10 例,黏液腺癌1 例,小细胞肺癌25 例;按TNM 分期,Ⅰ、Ⅱ、Ⅲ期及Ⅳ期的人数分别为7、30、60、117 例。纳入标准:(1)诊断为原发性肺癌,并于我院行肺癌氩氦刀冷冻消融术者;(2)临床病例资料完整者;排除标准:(1)既往有其他恶性肿瘤疾病者;(2)患有血液系统疾病或免疫缺陷、免疫系统疾病者;(3)术前1 个月行放疗或化疗或靶向治疗者;(4)术前1 个月行免疫治疗者;(5)患有严重感染者;(6)合并其他严重影响预后的的疾病,如心力衰竭、肾功能衰竭患者。
1.2 手术操作规范
结合患者病史、临床症状、体征及检查结果,根据《影像学引导肺癌冷冻消融治疗专家共识2018版》[9]中对手术适应证及禁忌证的要求以及主任医师的专业判断确定患者适合接受冷消融治疗。
手术方法:患者取卧位,建立静脉通路,给予心电监护。结合术前影像结果,行肺部局部CT 平扫,对肿瘤进行术前定位。避开大血管,选择最佳进针点及进针方向。常规体表消毒铺巾,1%利多卡因和1%罗哌卡因10 mL 局部麻醉,手术刀片在氩氦刀进针点切开0.5 cm 切口,穿刺针在CT 引导下将穿刺针穿入预定位置,经CT 扫描确定位置无误后,开启氩氦刀冷冻系统,使刀尖温度在1 min 内降至-140 ℃~-160 ℃,进入预定位置冷冻5 min 后,见冰球形成,术中间断扫描监测冷冻范围,约25 min后见冰球覆盖目标病灶,冷冻结束后通氦气拔刀,术中持续记录心电监护,术后扫描未见气胸后辅料加压包扎。
1.3 资料收集
通过查询海泰病历系统,建立研究对象数据库,包括性别、年龄、吸烟饮酒史、肺病史、肿瘤分期、术后生存期、手术方式、病理类型、外周血常规细胞计数等。根据患者术前1 周内血常规结果计算PLR 及NLR 值,根据患者随访结束时的生存状态,绘制受试者者工作特征曲线( receiver operating characteristic curve,ROC),计算youden 指数确定PLR 及NLR 的最佳临界值,将患者分为高PLR 组、低PLR 组和高NLR 组、低NLR 组,分别分析2组患术前PLR 水平和NLR 水平与患者临床病理特征及预后生存时间的相关性。
1.4 统计学处理
采用SPSS 22.0 软件进行数据分析,计数资料以例表示,组间比较采用卡方检验;采用Kaplan-Meier 法进行生存分析;分析影响预后的因素采用Cox 比例风险回归模型。
2 结果
2.1 术前PLR 及NLR 的最佳临界值
经筛选共有214 个患者纳入研究,绘制ROC 曲线,计算术前PLR 的最佳临界点是155.72,此时ROC 曲线下面积为0.766,敏感度为0.875,特异度为0.653,本研究定义低PLR 组为PLR<155.72,共87 例,定义高PLR 组为PLR≥155.72,共127 例;术前NLR 的最佳临界点时是2.91,此时ROC 曲线下面积为0.732,敏感度为0.654,特异度为0.729,本研究定义低NLR 为NLR<2.91,共94 例,高NLR 组为NLR≥2.91,共120 例,见图1、2。
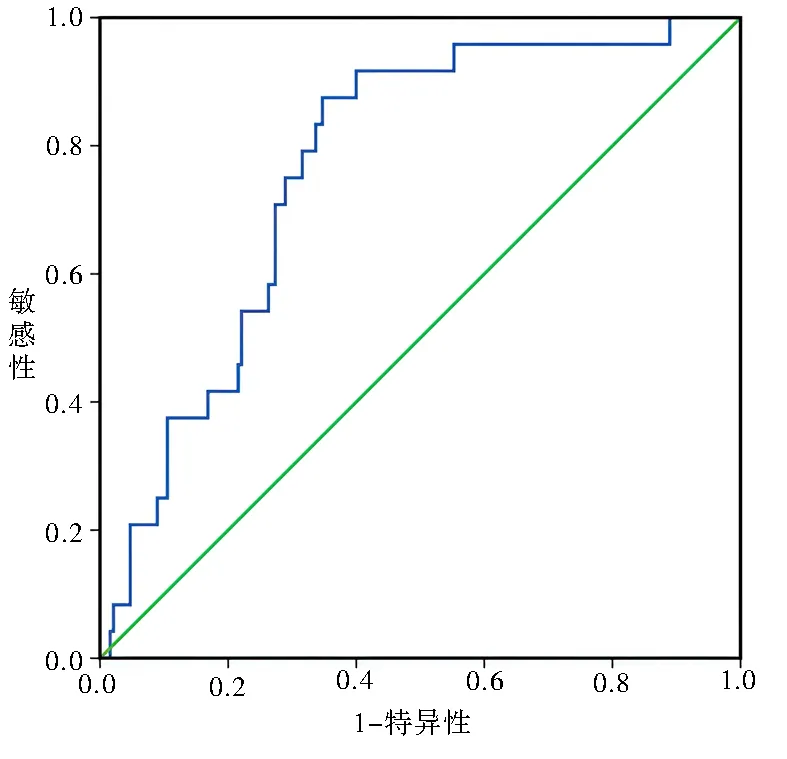
图1 术前PLR 诊断肺癌术后生存状态的ROC 曲线Fig 1 ROC curve of survival status after preoperative PLR diagnosis of lung cancer
2.2 NLR 及PLR 与原发性肺癌患者术前临床特征的相关性
原发性肺癌患者的年龄、性别、肺结节病史、高血压史、粉尘接触史、肿瘤家族史等临床特征与及PLR 及NLR 的高低无关,而高PLR 组原发性肺癌患者的pT 分期、pN 分期、TNM 临床分期与低PLR组比较,差异具有统计学意义(P<0.05),同样,高NLR 与低NLR 组患者的临床特征相比较,得到相同的结果(P<0.05),见表1。

表1 NLR、PLR 与患者临床因素的关系[n(%)]Tab 1 The relationship between NLR,PLR and patients' clinical factors[n(%)]

图2 术前NLR 诊断肺癌术后生存状态的ROC 曲线Fig 2 ROC curve of preoperative NLR diagnosis of lung cancer survival status after surgery
2.3 影响患者预后的危险因素分析
单因素分析结果显示,高PLR(P<0.001)、高NLR(P<0.001)、高pT 分期(P<0.001)、高pN 分期(P<0.001)、高pM 分期(P=0.006)、TNM 分期(P=0.004)均是影响原发性肺癌患者氩氦刀术后生存期的危险因素,而性别、年龄、肺结节病史、高血压病史、粉尘接触史、肿瘤家族史、病理类型与患者术后生存期无关(P>0.05);将单因素分析显示与术后生存期相关的变量纳入cox 多因素分析,结果显示术前高PLR(P=0.036,HR:1.467,95%CI:1.025~2.099)、高 NLR(P=0.001,HR:1.768,95%CI:1.244~2.513)、pT 分期(P=0.027,HR:1.441,95%CI:1.043~1.991)、pM 分期(P=0.032,HR:1.392,95%CI:1.029~1.882)、TNM 分期(P=0.037,HR:1.598,95%CI:1.045~1.812)是术后生存期下降的独立影响因素,见表2、3。

表2 临床因素单因素分析Tab 2 Single factor analysis of clinical factors
2.4 PLR、NLR 与肺癌TNM 分期的相关性
Pearson 相关性分析显示,PLR、NLR 与TNM分期均为正相关,(r分别为0.178、0.181,P<0.01),见表4。
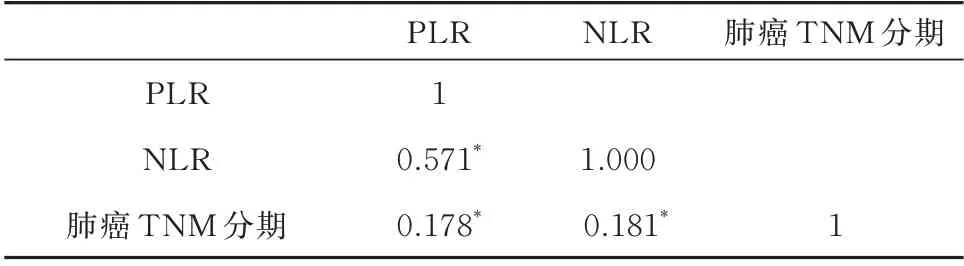
表4 术前PLR、NLR 与肺癌TNM 分期的Pearson 相关性分析Tab 4 Pearson correlation analysis of preoperative PLR,NLR and TNM staging of lung cancer
2.5 PLR 联合NLR 的Kaplan-Meier 生存曲线分析
由统计得出,214 例患者的中位生存期为5.5 个月,由于PLR、NLR 是患者术后生存期的独立影响因素,因此将患者根据PLR=155.72 及NLR=2.91最佳临界值分别分组,进行Kaplan-Meier 生存曲线分析,结果显示:高NLR 组和低NLR 组的术后中位生存时间分别为5.3 个月和11.9 个月,两组的术后1年生存率为分别为21%和47.9%,差异具有统计学意义;高PLR 组和低PLR 组的术后中位生存时间分别为5.63 个月和11.87 个月,两组的术后1 年生存率分别为23%和47.1%,差异具有统计学意义;见图3、4。

图3 不同PLR 水平组肺癌患者生存曲线的比较Fig 3 Comparison of survival curves of patients with lung cancer in different PLR levels
由于PLR 及NLR 都是患者预后的独立影响因素,我们将NLR 及PLR 两者联合将患者分为4 组,高NLR 高PLR 组患者的一年生存率为19%,中位生存时间为4.83 个月;高NLR 低PLR 组患者的一年生存率为27%,中位生存时间为8.17 个月;低NLR 高PLR 组患者的1 年生存率为37%,中位生存时间为10.7 个月;低NLR 低PLR 组的1 年生存率为52%,中位生存时间为12.17 个月;差异具有统计学意义,见图5。
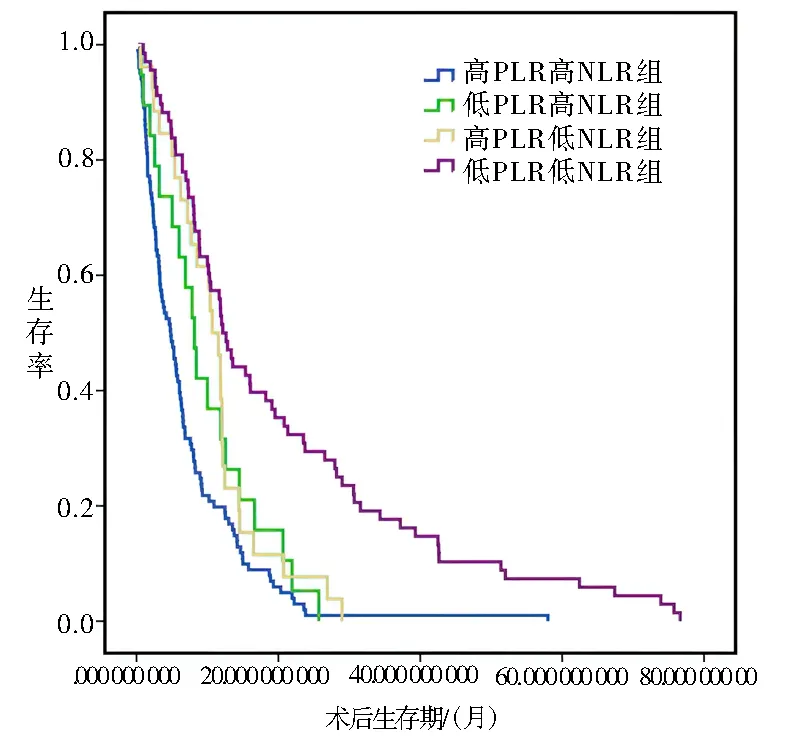
图5 不同PLR 联合NLR 水平组肺癌患者生存曲线的比较Fig 5 Comparison of survival curves of lung cancer patients with different PLR combined with NLR levels

表3 影响患者预后的危险因素分析Tab 3 Analysis of risk factors affecting the prognosis of patients

图4 不同NLR 水平组肺癌患者生存曲线的比较Fig 4 Comparison of survival curves of lung cancer patients with different NLR levels
3 讨论
肺癌晚期患者的治疗是肺癌体系中的重要组成部分,据研究调查显示[10],约57%的肺癌患者在发现时已经发生了远处转移,专家共识提出[11],晚期肺癌患者应采取综合、全身、个体化治疗,以最大程度的延长患者生存时间,控制肿瘤进展程度,提高生活质量为目标。氩-氦冷冻消融是目前较成熟的冷冻消融治疗技术[12],指分别以氦气和氩气作为热媒和冷媒,对局部肿瘤组织进行急速升温和超低温冷冻,达到毁损的效果。冷冻消融联合“绿色治疗”的理念[13],以最小的不良反应直接消灭瘤体,又能有效协同降低现代医学治疗的不良反应,从而达到提高生存质量、延长生存期的双重疗效。然而由于患者术后反应也不尽相同,迫切需要有效的预后指标从而更好的选择个体化治疗策略。
本项研究中,以PLR=255.72,NLR=2.91 为临界值,低值组肺癌患者术后生存率、术后中位生存时间均显著高于高值组,对于PLR 和NLR 均低组病人来说,往往预示着较长的生存时间,较高的生存率;而多因素Cox 回归分析显示,高PLR、高NLR、TNM 分期均是肺癌患者预后生存期的独立危险因素。Pearson 相关性分析显示,PLR、NLR 与TNM 分期三者均呈正相关,三者对肺癌冷冻消融术后生存期的影响方向一致。因此,通过观察患者术前全血细胞分析结果可有效的预测患者术后生存情况。
肿瘤的十大特征包括促进肿瘤的炎症和持续的血管生成[14],实体瘤周围浸润着中性粒细胞及其他免疫细胞,该过程往往伴随着炎症反应[15]。越来越多的证据表明,血小板、中性粒细胞、淋巴细胞和肿瘤细胞相互作用[16,17],参与肿瘤的生长和侵袭、异常血管生成和炎症过程等多个方面;首先,血小板数量会在癌症病人的血液中增加,并且与恶性程度和进程有明显的相关性[18];中性粒细胞是人体重要的免疫防御细胞[19],可以通过中性粒细胞外诱捕网激活肿瘤细胞的活性,促进肿瘤细胞的增值、侵袭和转移[20,21],同时肿瘤细胞的全身炎症有利于中性粒细胞的增长使其在多种肿瘤中呈现高表达,相互共同促进肿瘤进程;另外,淋巴细胞包括T 淋巴细胞、B 细胞和NK 细胞,具有免疫监控和防御功能,其密度与患者存活率升高有关[22],但其被肿瘤细胞分泌的血管内皮生长因子(VEGF)所抑制,随着肿瘤的进展VEGF 分泌不断增多,使免疫细胞缺乏,产生有益于肿瘤生长的微环境[23]。PLR、NLR 体现三者之间的动态平衡[24,25],结果更为稳定,反映了机体的炎症反应和免疫反应,在肿瘤发展的动态评估上优于血小板、淋巴细胞或中性粒细胞计数的单一指标,因此使PLR 及NLR 成为有价值的预后评估方式。
总之,本研究表明,术前PLR 及NLR 与患者术后生存情况相关,是简单有效的预测指标,而PLR、NLR 根据血常规结果计算,方法简单,成本低廉,可重复性强,对于预测预后,优化临床诊治方案都有一定的意义。本研究作为一项回顾性研究,可能存在偏倚,仍需要多中心大样本前瞻性研究进一步验证。
作者贡献度说明:
上官子妍:负责构思、数据收集处理、写作;陈琪:病案数据收集;姜敏:总体指导;胡凯文:总体指导。
