植物乳杆菌LP21绿色合成纳米硒及对溶藻弧菌的抑菌活性
2022-02-16王丽红
王丽红,杨 辉,苏 文,孔 阳
(陕西科技大学食品与生物工程学院,陕西 西安 710021)
硒是一种人体和动物必需的微量元素[1-2],但安全剂量范围非常窄[3-4],限制了传统补硒化合物的使用。研究发现纳米硒具有低毒、高活性、易吸收等优势,因而在抗氧化[5]、抗癌[6]、抗菌[7]、促进生长[8]等方面展现出良好的应用前景。微生物可通过同化还原、异化还原和生物群落甲基化等作用,将环境中有毒的亚硒酸阴离子还原为毒性较低的单质硒,积累在细胞内或分泌在胞外[9],合成的纳米硒具有典型的红色球形,稳定性好、生物相容性高[10-11]。乳酸菌是一类具有促进生物体肠道内菌群生态平衡,对宿主起有益调节作用的微生物菌群,具有公认的安全性(Generally Recognized as Safe,GRAS)[12]。课题组前期研究筛选到1 株植物乳杆菌(Lactobacillus plantarum)LP21,具有对亚硒酸钠耐受能力强、纳米硒转化率高的优势。
溶藻弧菌(Vibrio alginolyticus)为河口和海洋的正常环境菌,是各种水产养殖中的一种主要的条件致病菌,容易导致鱼虾等患疾病甚至死亡,是引起海洋动物和水产养殖大流行性疾病的重要致病菌[13]。为了减轻染病造成的致命后果,目前过度使用抗生素或化学杀菌剂在水产养殖中很常见,引起超级细菌和耐药性基因的产生、传播,已成为危害公共安全问题之一[14-15]。预防和控制水产养殖设施中的致病性感染[16]是目前亟需解决的问题。
纳米硒颗粒具有抗菌的特性[17-18],而且对铜绿假单胞菌(Pseudomonas aeruginosa)和念珠菌(Candidaspp.)具有抗生物膜活性[19],但是应用于溶藻弧菌的抑菌活性还鲜见报道。本研究拟采用植物乳杆菌LP21在生长繁殖中转化合成纳米硒,利用透射电镜、粒径仪、X射线衍射、红外光谱对制备的纳米硒进行结构和性能表征,并对其抑制溶藻弧菌的生长繁殖、运动性、生物膜形成、细胞形态等进行研究,旨在为渔业养殖提供一种无毒和有益环境奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
植物乳杆菌LP21、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)由陕西科技大学1C420实验室分离保藏;溶藻弧菌(CCCCT No.AB209306)由陕西科技大学食品与生物工程学院刘欢老师提供。
1.1.2 培养基
LB(Luria-Bertani)培养基:胰蛋白胨10.0 g、酵母菌粉5.0 g、氯化钠30.0 g、蒸馏水1 000 mL、琼脂粉(固体培养)15.0~20.0 g。
改良MRS(Man Rogosa Sharpe)培养基:蔗糖20.0 g、牛肉膏5.0 g、硫酸锰0.05 g、蛋白胨10.0 g、乙酸钠5.0 g、硫酸镁0.2 g、磷酸氢二钾2.0 g、吐温80 1 mL、柠檬酸三铵2.0 g、酵母菌粉4.0 g、蒸馏水1 000 mL。
1.1.3 试剂
亚硒酸钠 山东西亚试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 西陇科学股份有限公司;过氧化氢、无水乙醇 天津市天力化学试剂有限公司;NaOH、硝酸、高氯酸 天津科密欧化学试剂有限公司;乙酸 天津市北辰方正试剂厂;结晶紫常德比克曼生物科技有限公司;溴化钾(光谱纯)天津恒创立达科技发展有限公司。
1.2 仪器与设备
恒温培养箱 重庆试验仪器设备厂;压力蒸汽灭菌器上海申安医疗器械有限公司;紫外-分光光度计 上海光谱仪器有限公司;LGJ-15D冷冻干燥机 北京四环科学仪器厂;Phenom Pro X飞纳扫描电镜 复纳科学仪器(上海)有限公司;H-7650透射电子显微镜 日本日立公司;D/max2200PCX光衍射仪、Vertex70红外光谱仪德国布鲁克公司;Litesizer™ 500纳米粒度仪 奥地利安东帕有限公司;Scientz-1500F超声波分散仪 宁波新芝生物科技股份有限公司;IRIS Intreid II电感耦合等离子发射光谱仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 植物乳杆菌LP21合成纳米硒
将活化3 次的植物乳杆菌LP21以2%接种量,接种于含亚硒酸钠质量浓度1 g/L的改良MRS液体培养基中,其中亚硒酸钠需单独灭菌后加入,35 ℃厌氧瓶培养72 h后,10 000 r/min离心10 min,沉淀经蒸馏水洗3 次得到纳米硒-植物乳杆菌,4 ℃冰箱保存备用。
1.3.2 透射电镜观察纳米硒-植物乳杆菌
吸取纳米硒-植物乳杆菌滴加于铜网上,滤纸吸去多余水分,红外线灯照射干燥后,透射电镜观察,能谱仪分析。
1.3.3 纳米硒的分离
将纳米硒-植物乳杆菌用0.1 g/100 mL SDS(1 mol/L NaOH溶液配制)悬浮,超声波分散仪300 W,3 s/停3 s,处理15 min,3 000 r/min离心10 min,收集上清液12 000 r/min离心10 min,蒸馏水洗涤3 次重悬,然后通过0.45 μm微孔滤膜过滤,冷冻干燥制备得到纳米硒颗粒,进行结构表征及抑菌活性研究。
1.3.4 纳米硒粒径分析
取纳米硒重悬,分别滴加于一次性比色皿中,置于纳米粒度仪卡槽中,测定粒径。设定预热时间120 s,测量温度25 ℃,测量次数3 次。
1.3.5 纳米硒红外光谱分析
采用溴化钾压片法,傅里叶红外光谱仪对纳米硒进行检测,光谱测定范围400~4 000 cm-1。
1.3.6 纳米硒X射线衍射分析
采用X射线衍射对纳米硒结构进行分析,以CuKα射线为辐射源(λ=0.154 nm),电流50 mA,电压40 kV。
1.3.7 平板抑菌活性测定
将纳米硒-植物乳杆菌、纳米硒用硝酸-高氯酸混酸消化,方法详见文献[20],电感耦合等离子发射光谱仪测定硒含量,并稀释到250 μg/mL与相同质量浓度亚硒酸钠分别制备成样品1、2、3。对照为植物乳杆菌及0.22 μm滤膜过滤后的发酵液,分别为样品4和5。
将指示菌溶藻弧菌、大肠杆菌、金黄色葡萄球菌按1%的接种量分别接入LB液体培养液中,37 ℃恒温培养24 h,测定菌液OD600nm值并稀释至1.0。培养皿注入20 mL LB固体培养基,水平放置使之凝固,将1 mL指示菌均匀涂布培养基上,放入浸泡有样品的滤纸片,37 ℃培养24 h,测量抑菌圈直径,每个处理3个平行。
1.3.8 纳米硒对溶藻弧菌生长的影响
采用二倍稀释法[21],确定纳米硒的最小抑菌浓度(minimum inhibitory concentration,MIC)。
将指示菌溶藻弧菌按1%的接种量,分别接入添加纳米硒亚抑制剂量143 μg/mL的LB培养液中,37 ℃、150 r/min振荡培养,以未添加纳米硒的无菌培养基为对照,采用比浊法,每隔2 h取出1 mL菌液,3 倍稀释后600 nm波长处测定OD值,观察菌体生长情况,绘制生长曲线。
1.3.9 纳米硒对溶藻弧菌生物膜形成的抑制
采用结晶紫染色法测定纳米硒对溶藻弧菌生物膜的抑制作用。将含亚抑制剂量143 μg/mL纳米硒的5 mL LB装在干净的无菌玻璃管中,接种0.05 mL溶藻弧菌,以不含纳米硒的培养为对照,37 ℃培养48 h后,弃去培养基,附着的细胞用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤,1 g/100 mL结晶紫染色,水冲洗,33%(V/V)乙酸溶液脱色,在570 nm波长处测定洗脱染料OD值。
1.3.10 纳米硒对溶藻弧菌运动性的影响
在含琼脂0.5 g/100 mL(软板)和1.5 g/100 mL(硬板)固体LB平板上测定纳米硒对溶藻弧菌的游动和群集能力的影响。溶藻弧菌分别点样在含亚抑制剂量纳米硒的软板和硬板上,并用不含纳米硒的培养作对照,24 h后拍照记录。
1.3.11 扫描电镜观察纳米硒对溶藻弧菌形态的影响
将指示菌溶藻弧菌按1%的接种量分别接入LB培养液中,37 ℃恒温培养8 h后,添加纳米硒质量浓度为143 μg/mL,继续培养24 h后,5 000 r/min离心10 min,PBS洗涤3 次,收集沉淀,乙醇梯度洗脱,样品处理详见文献[22]。扫描电镜观察菌体形态。
1.4 数据统计及图表绘制
2 结果与分析
2.1 植物乳杆菌LP21转化合成纳米硒形貌观察
微生物对基质中亚硒酸盐的还原被认为是菌体的脱毒作用,广泛被接受的机制是菌体内谷胱甘肽首先提供电子转化亚硒酸盐形成硒代谷胱甘肽(GS-Se-SG),然后经谷胱甘肽还原酶或硫氧还蛋白还原酶进一步还原,形成不稳定谷胱甘肽硒硫化物(GS-Se-),后经水解形成还原型谷胱甘肽和单质硒[23],再通过硒因子A分泌到胞外[24]。植物乳杆菌LP21在生长繁殖中可将环境中有毒的亚硒酸钠转化成低毒的单质硒,分泌在细胞外,活性单质硒具有典型的红色,透射电镜观察菌体及纳米硒形貌见图1A,在菌体细胞周围游离着球形颗粒,分散性较好。能谱(图1B)分析其主要组分除菌体的成分C、O外,较多的为元素Se,说明植物乳杆菌的富硒能力较强,除少量存在胞内,大部分会分泌胞外,因而使菌体及培养液呈红色,而且培养时间越长,颜色越深。
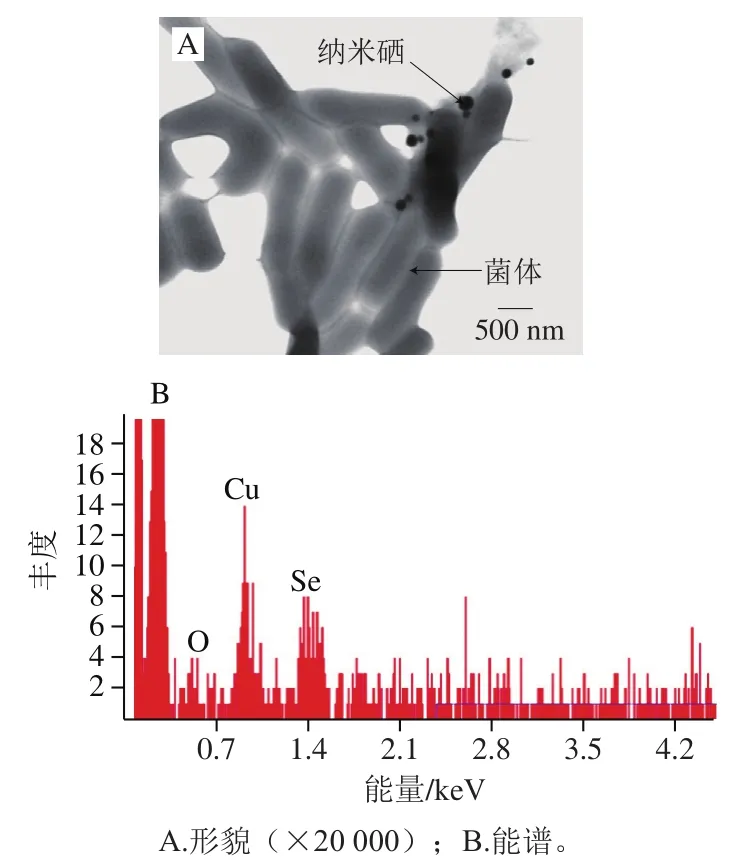
图1 植物乳杆菌LP21合成纳米硒透射电镜及能谱图Fig. 1 TEM image and energy spectra of selenium nanoparticles synthesized by L. plantarum LP21
2.2 纳米硒粒径分析
研究表明粒径在5~200 nm之间的纳米硒具有显著的生物学效应[25-26],而且粒度越小活性越强[27-28],采用粒度仪分析植物乳杆菌合成的纳米硒粒径分布如图2所示。可知,植物乳杆菌LP21合成的纳米硒颗粒分布在98.7~306.9 nm之间,平均粒径为184.6 nm。研究表明微生物合成纳米硒的尺寸与不同菌种[29]和培养条件如pH值、温度、接种量、亚硒酸钠质量浓度以及胁迫时间[30]等有关,而且纳米硒粒径较小的抑菌活性较强。一般微生物合成的纳米颗粒介于30~500 nm之间,植物乳杆菌LP21在前期探索实验条件下合成纳米硒颗粒相对较小,因而在生物活性上具有较大优势。

图2 植物乳杆菌LP21合成的纳米硒粒径分布Fig. 2 Particle size distribution of selenium nanoparticles synthesized by L. plantarum LP21
2.3 纳米硒红外光谱分析
红外光谱反映了纳米硒表面结合的官能团结构,测定纳米硒在400~4 000 cm-1红外光谱范围内的变化,结果如图3所示。可知,纳米硒在3 435(N-H、O—H)、2 920(CH2、CH3)、1 645(C=O)、1 378(C—O或C—H)、1 046(C—O)cm-1有伸缩振动及 669(C—H)cm-1处有外弯曲振动。说明纳米硒单质不是独立存在,表面可能结合了蛋白质、多糖等有机物,这与其他微生物合成纳米硒的报道基本一致。Xu Chunlan等[31]通过化学成分和元素分析表明干酪乳杆菌合成的纳米硒颗粒表面被蛋白质和多糖覆盖。Kessi等[32]发现红螺菌(Rhodospirillum rubrum)形成硒-蛋白复合物,并且蛋白质起到稳定纳米硒结构的作用。Dobias等[33]鉴定了大肠杆菌转化的纳米硒与4 种特异性蛋白质(AdhP、Idh、OmpC、AceA)结合,并观察到在蛋白质存在下,纳米硒尺寸分布更窄。在植物乳杆菌LP21合成的纳米硒表面存在的多糖、蛋白质等生物分子,能够有效地避免纳米颗粒发生转化和团聚,起到天然的稳定剂作用,这也是生物法合成纳米硒较化学、物理法具有优势的原因之一。
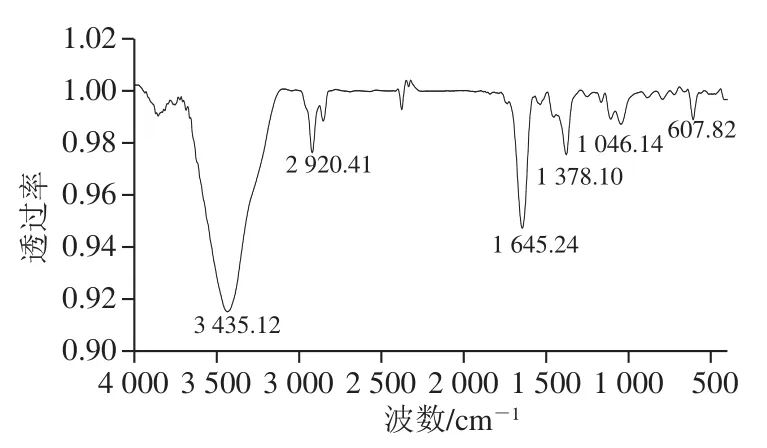
图3 植物乳杆菌LP21合成的纳米硒红外光谱Fig. 3 FTIR spectrum of selenium nanoparticles synthesized by L. plantarum LP21
2.4 纳米硒X射线衍射分析
从图4可知,纳米硒在20°~30°范围内有较强的衍射峰,无晶体特征吸收峰,说明植物乳杆菌合成的纳米硒结晶度较差,属于无定形态。目前,由微生物合成的纳米硒有晶体[29]和无定形态[34],植物乳杆菌合成的纳米硒为非晶形态可能是因为菌体合成的纳米硒表面吸附的生物大分子蛋白质、糖类等,阻碍了晶体的长大,因而呈现无定形。
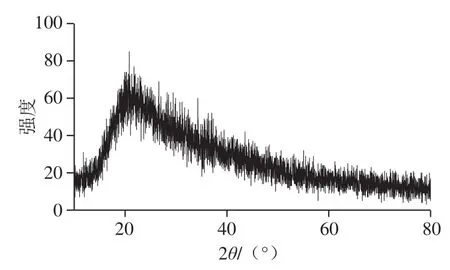
图4 纳米硒颗粒X射线衍射图Fig. 4 XRD pattern of synthesized selenium nanoparticles
2.5 平板抑菌活性
观察纳米硒对溶藻弧菌、大肠杆菌及金黄色葡萄球菌的平板抑菌活性发现,纳米硒及纳米硒菌体复合物对测试菌均表现一定的抑菌活性,而植物乳杆菌菌体、发酵液、亚硒酸钠无明显抑菌活性。平板抑菌圈测定结果见表1,纳米硒及菌体复合物对溶藻弧菌和大肠杆菌的抑制力较强,对金黄色葡萄球菌抑菌活性较低。溶藻弧菌和大肠杆菌属于革兰氏阴性菌,金黄色葡萄球菌属于阳性菌,阳性菌的肽聚糖层较厚,可能影响纳米硒颗粒进入细菌胞内,从而影响其抑菌活性。对比纳米硒和纳米硒复合物的抗菌活性可知,纯化纳米硒的活性更强,推测可能是纳米硒菌体复合物中纳米硒易于吸附在菌体表面,不宜在固体平板上扩散,最终降低其抑菌活性。
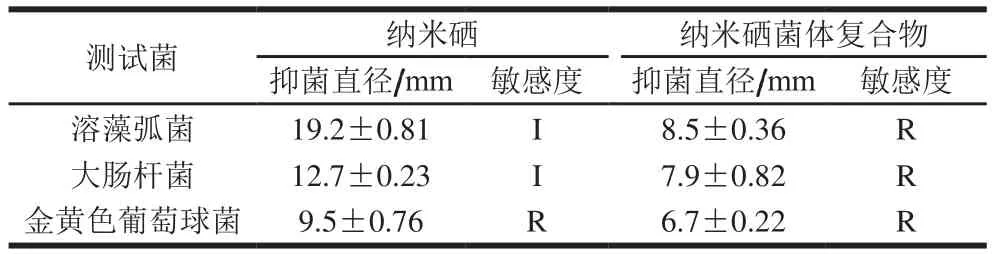
表1 纳米硒平板抑菌活性Table 1 Antibacterial activity of nano-selenium
2.6 纳米硒对溶藻弧菌生长的影响
二倍稀释法确定纳米硒的MIC,结果表明当纳米硒质量浓度达到286 μg/mL时,培养中无溶藻弧菌生长,培养液澄清,当质量浓度为143 μg/mL时,培养液出现菌体生长。因此确定纳米硒对溶藻弧菌的MIC为286 μg/mL,这与Eleonora等[35]采用生物源纳米硒对铜绿假单胞菌的报告基本一致。选择亚抑制剂量143 μg/mL研究纳米硒对溶藻弧菌的抑菌作用。
如图5所示,纳米硒对溶藻弧菌的生长具有明显的抑制作用,使菌的潜伏期延长,对照组在4 h后开始进入对数增长期,而纳米硒组在8 h才开始进入对数期,并且比对照组提前进入稳定期,发酵终了溶藻弧菌生长量也较低。说明在亚抑制剂量下纳米硒可抑制溶藻弧菌的生长,并使菌体快速衰退死亡。

图5 纳米硒对溶藻弧菌生长曲线影响Fig. 5 Effect of nano-selenium on the growth curve of V. alginolyticus
2.7 纳米硒对溶藻弧菌生物膜形成的影响
生物膜是一种基质,可封闭、固着微生物群落,使其附着于非生物和生物表面,可保护微生物免受恶劣环境及噬菌体、变形虫捕食,提高其生存能力和环境耐受性[36-37]。溶藻弧菌在适应自然环境生长过程中极易在水中形成生物膜,并附着在生物体的表面,被膜内的细菌对抑菌剂的抗逆性增强,很难去除,从而导致持续性污染[38]。
图6显示了纳米硒抗生物膜作用,对照组溶藻弧菌在培养基表面及试管壁上形成厚厚的生物膜,纳米硒处理组的液体及管壁上形成的生物膜较薄,且未连接成片,结晶紫染色结果表明,纳米硒处理的溶藻弧菌形成生物膜生物量降低。因此,纳米硒可有效抑制溶藻弧菌生物膜形成,降低溶藻弧菌的感染力。

图6 纳米硒对溶藻弧菌生物膜的抑制Fig. 6 Inhibitory effect of nano-selenium on V. alginolyticus biofilm
2.8 纳米硒对溶藻弧菌运动性形成的影响
溶藻弧菌有侧鞭毛和极性鞭毛两个鞭毛系统[39],具有在液体条件下游动和在固体表面上群集能力,易于游动并聚集感染宿主[40]。如图7所示,对照组中溶藻弧菌在软膜和硬膜中扩散面积较大,相比纳米硒组对溶藻弧菌的游动和群集都具有较好的抑制,影响了其在基质中运动性,从而降低溶藻弧菌在环境中扩散、侵染宿主的能力。
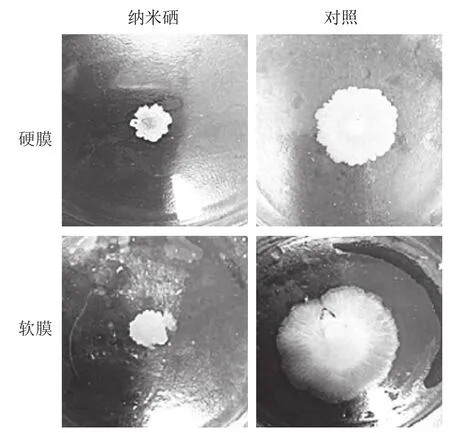
图7 纳米硒对溶藻弧菌运动性的影响Fig. 7 Effect of nano-selenium on the mobility of V. alginolyticus
2.9 纳米硒对溶藻弧菌形态的影响
溶藻弧菌生长良好的培养液中添加纳米硒,培养24 h后,电镜观察纳米硒对菌体形态的影响。从图8可知,对照组中溶藻弧菌菌体表面光滑,未见异常。而纳米硒处理的菌体形态发生明显变化,表面出现塌陷,部分表面出现溶洞,说明纳米硒可能影响了溶藻弧菌细胞膜或细胞壁的结构,进一步会导致细胞内容物释放,菌体死亡。Xu Chunlan等[31]研究在纳米硒处理的癌细胞内发现了纳米硒颗粒,说明纳米硒可以进入癌细胞内部,最终诱导细胞的凋亡。Zhang Xiaohui等[41]提出抑菌剂“成孔理论”,认为抑菌剂可进入细胞,并使细胞形成可渗透的孔隙通道,导致细胞死亡。植物乳杆菌LP21合成的纳米硒可以使生长良好的溶藻弧菌表面出现孔洞,细胞死亡,但有关纳米硒在胞内的作用机制还需要进一步研究。

图8 溶藻弧菌扫描电镜图Fig. 8 Scanning electron micrographs of V. alginolyticus treated or not treated with nano-selenium
3 结 论
植物乳杆菌繁殖过程可产生有机酸、细菌素、过氧化氢等代谢产物,不仅具有益生菌调节生物胃肠道菌群平衡、促进营养物质吸收等功能[42],而且具有稳定水的pH值、抑制底部粪便和残饵料的腐烂、减少化工降解素用量、降低养殖成本的作用[43]。采用植物乳杆菌LP21合成纳米硒,比化学合成法简单、成本低,并且生物来源的纳米硒生物相容性高,易于在体内吸收利用。植物乳杆菌LP21合成的纳米硒分泌在细胞外,呈球形,为非晶态,粒径分布在98.7~306.9 nm之间,平均粒径为184.6 nm。纳米粒子表面覆盖蛋白和糖类化合物结合,降低了电位,通过负电荷抑制纳米颗粒的团聚,从而维持纳米结构的稳定。植物乳杆菌LP21合成的纳米硒对溶藻弧菌的MIC为286 μg/mL,在143 μg/mL亚抑制剂量条件下对溶藻弧菌的生长繁殖、运动性、生物膜均有显著抑制,并可造成菌体细胞壁和细胞膜结构变化,引起菌体死亡。目前溶藻弧菌可以在水中游动、聚集形成生物膜,附着于鱼、虾等生物表面引起感染,对水产养殖业造成了巨大的经济损失。采用植物乳杆菌LP21转化纳米硒,菌体是有益的载体,可作为养殖饲料促进养殖水产的代谢吸收,合成的纳米硒具有抑菌溶藻弧菌繁殖、运动、形成生物膜的功效,有望为水产养殖中防治溶藻弧菌的感染提供新的方法。
