马铃薯蛋白与蛋清蛋白混合凝胶特性分析
2022-02-16刘鑫硕刘倩楠胡宏海
刘鑫硕,刘倩楠,刘 伟,徐 芬,张 良,胡宏海
(中国农业科学院农产品加工研究所,农业农村部农产品加工重点实验室,北京 100193)
马铃薯(Solanum tuberosum)是仅次于水稻、小麦和玉米的第4大粮食作物[1],除淀粉、纤维素外,马铃薯蛋白(potato protein,PP)也是其主要成分之一。PP富含苏氨酸、色氨酸、蛋氨酸和其他粮食缺乏的赖氨酸,氨基酸组成与动物蛋白和溶酶菌相当,具有很高的利用价值[2]。同时,尽管新鲜马铃薯中蛋白含量只有2%左右,但就产量而言,马铃薯单位面积的蛋白质产出量仅次于小麦[3],是植物蛋白的重要来源。如何促进PP在食品加工中的应用,对满足人们对优质蛋白日益增长的需求具有重要意义。
蛋白凝胶化是赋予食品理想质构的主要手段之一,不同处理方法和处理条件会影响PP的凝胶性。Katzay等[4]发现压力和热诱导PP凝胶有相似的流变曲线,但其分子相互作用力不同;Malling等[5]研究不同干燥方法、pH值和离子强度对PP凝胶的外观和质地特性的影响。目前,PP主要采用酸热絮凝法从马铃薯淀粉工业废水中提取,与等电点沉淀法、盐沉淀法、离子交换等提取方法相比,该方法成本低,但由于在絮凝过程中杂质会被蛋白质絮状物包裹而沉淀,导致纯度降低,蛋白变性,功能性质发生改变[6-7]。这种PP原料溶解度降低,凝胶性变差,凝胶强度降低,限制了其在食品中的应用[8]。
大多数食品是含有不同种类蛋白的混合物体系,不同蛋白间的相互作用对食品品质有重要影响。McCann等[9]研究表明可以通过调节大豆蛋白-乳清蛋白的比例制备不同机械性能的混合高蛋白食品;Ainis等[10]研究了不同比例和不同处理条件的菜籽蛋白和乳清蛋白混合凝胶的流变和持水性;毛超[11]研究了马铃薯乳清复合蛋白乳液填充对乳清蛋白凝胶物理化学性质的影响。通过不同种蛋白的复配,调控体系的凝胶性,对赋予食品独特的营养价值、形态、风味以及质地等特征具有重要意义[12-13]。蛋清蛋白(egg white protein,EWP)具有优良的凝胶特性,广泛应用于烘焙制品、肉制品以及面制品等食品的生产制作中,可改善产品的质构及风味[14-15]。研究表明,随着燕麦球蛋白-蛋清混合物中蛋清含量的增加,其储能模量(G’)和损耗模量均增加[16];添加蛋清可以减少燕麦面条70%的烹饪损失,延长烹饪时间并提高面条的硬度、耐嚼性、拉伸力和拉伸距离[17];通过调节特定比例的大豆蛋白和EWP,产生协同增强作用,从而改善混合凝胶性能[18]。同时,EWP含有人体必需的8 种氨基酸且蛋白质消化率高,尤其含有丰富的蛋氨酸,具有较高的营养价值[19]。因此,将EWP添加至PP中,可能是改善PP凝胶性能的一种有效途径。
目前,PP和EWP混合凝胶特性尚不清楚。本研究以PP和EWP作为研究对象,考察不同比例PP和EWP混合凝胶的凝胶特性变化,研究混合蛋白的凝胶行为,以期为促进PP在食品复合体系中的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
PP购于北京凯美特生物科技有限公司,基本组成(干基,质量分数):水分(5.79±0.05)%、粗蛋白(85.21±0.13)%、灰分(5.8±0.2)%、淀粉(1.47±0.06)%。在2 g/100 mL质量浓度下,溶解度为43.3%。EWP购自浙江康德蛋业有限公司,基本组成(干基,质量分数):水分(6.68±0.05)%、粗蛋白(83.19±0.21)%、灰分(5.9±0.2)%、淀粉(1.12±0.01)%。
BCA蛋白浓度试剂盒 赛默飞世尔(中国)有限公司;其余试剂均为分析纯。
1.2 仪器与设备
ThermoMixer C恒温混匀仪 德国艾本德股份公司;Allegra 64R离心机 美国Beckman Coulter公司;Physica MCR 301流变仪 奥地利Anton Paar有限公司;LGJ-10冷冻干燥机 上海德洋意邦有限公司;S-570扫描电子显微镜 日本日立公司;TU-1810紫外-可见分光光度计北京普析通用仪器有限责任公司;Nicolet 67型傅里叶变换红外(Fourier transform infrared,FT-IR)光谱仪美国Thermo Nicolet公司。
1.3 方法
1.3.1 混合凝胶的制备
用蒸馏水配制15 g/100 mL的PP和EWP混合悬液,PP与EWP的质量比分别为1∶0、9∶1、3∶1、1∶1、1∶3、1∶9、0∶1,在室温下搅拌均匀。用1 mol/L HCl或1 mol/L NaOH溶液将pH值调节至7.0。将混合悬浊液在恒温混匀仪中85 ℃加热30 min后,立即用冰水冷却,制得混合蛋白凝胶。取部分样品用于凝胶强度、保水性的测定。其余样品真空冷冻干燥48 h,研磨成粉后,过80 目筛制得混合蛋白凝胶粉末用于后续测定。
1.3.2 凝胶强度测定
采用质构分析仪对样品进行凝胶强度的测定[20]。样品为直径23 mm、高度12 mm的圆柱形。质构分析仪参数设定:测试前速率5 mm/s,测试速率2 mm/s,测试后速率2 mm/s,测试形变50%;探头为P/36R;程序设定:TPA模式,即每测定一个样品探头会下压2 次。每个样品平行测定5 次,以峰值高度的平均值表示混合蛋白的凝胶强度。
1.3.3 保水性测定
利用离心法测定凝胶保水性[21]。称取一定质量的凝胶样品转移至质量m0离心管中,样品与离心管总质量m1,于10 ℃、6 755 r/min离心15 min,离心后除去上层水分并用滤纸将表面水分吸干后称质量m2。每个样品平行测定5 次。保水性按式(1)计算:
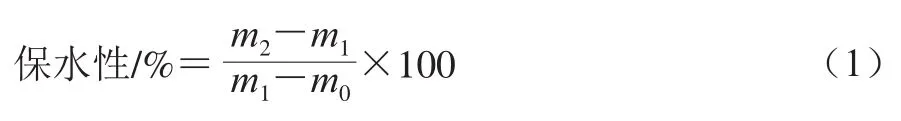
1.3.4 扫描电子显微镜观察
使用扫描电子显微镜对PP-EWP混合凝胶的微观结构进行观察。取少量真空冷冻干燥后的凝胶样品,使用导电胶将其固定于样品台,通过离子溅射喷金处理后,将样品置于扫描电子显微镜平台上,在10 kV电压下对混合蛋白的微观结构进行观察和拍照(500 倍)。
1.3.5 FT-IR测定
称取1 mg左右混合蛋白凝胶粉末以及100 mg溴化钾在玛瑙研钵中研磨混合均匀后压成薄片,使用FT-IR仪收集样品的红外谱图[22]。温度25 ℃,扫描范围4 000~400 cm-1,扫描次数64 次,扫描速率4 cm-1。选择图谱中1 700~1 600 cm-1的酰胺I带用Peak Fit 4.0软件进行分析,对曲线去卷积多峰拟合后,通过吸收峰的面积计算各二级结构的相对含量,每个样品重复测定3 次。
1.3.6 分子间作用力的测定
依据Wang Kaiqing等[23]描述的方法并稍作修改,以测定混合蛋白凝胶的分子间作用力。该方法是通过重新溶解凝胶破坏其中的氢键和离子键或疏水相互作用,反映不同作用力的贡献。用于溶解的缓冲液(在pH 7.0,0.05 mol/L的磷酸盐缓冲液中制备)如下:1)0.05 mol/L NaCl溶液(记为PA);2)0.6 mol/L NaCl溶液(记为PB);3)0.6 mol/L NaCl溶液+1.5 mol/L尿素溶液(记为PC);4)0.6 mol/L NaCl溶液+8 mol/L尿素溶液(记为PD)。
称取0.1 g混合蛋白凝胶粉末溶解于10 mL上述缓冲液中,混匀后,在4 ℃、8 000 r/min离心20 min。使用BCA蛋白浓度测定试剂盒测定上清液的蛋白浓度。离子键的贡献用PB和PA的溶解度之差表示,氢键的贡献用PC和PB的溶解度之差表示,疏水相互作用的贡献用PD和PC中的溶解度之差表示,每个样品重复测定5 次。
1.3.7 游离巯基含量的测定
混合蛋白凝胶游离巯基含量的测定依据Hu Hao等[24]所述的方法并稍作改动。称取100 mg混合蛋白凝胶粉末,将其溶于10 mL的磷酸缓冲液(含有1 mmol/L EDTA,1% SDS,pH 8.0)中,8 000 r/min离心10 min。取3 mL上清液,加入3 mL上述磷酸缓冲液及0.1 mL的2-硝基苯甲酸(2-nitrobenzoic acid,DTNB)溶液(质量浓度为4 mg/mL),于25 ℃振荡1 h后,8 000 r/min离心30 min,在412 nm波长下使用分光光度计测定其上清液的吸光度,每个样品重复测定5 次。游离巯基含量按照式(2)计算:
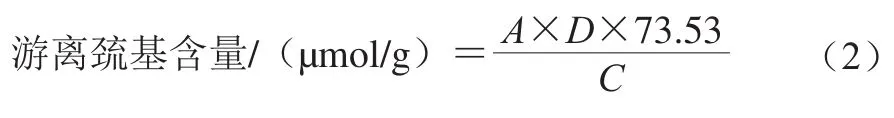
式中:A为吸光度(412 nm);D为稀释倍数;C为样品的最终质量浓度/(mg/mL)。
1.3.8 流变特性的测定
PP和EWP混合物的流变特性通过流变仪进行测定,根据Comfort等[25]的测定方法并略作改动。配制15 g/100 mL不同比例的PP和EWP的混合蛋白悬浊液,调pH 7.0。测定时将样品均匀置于直径为50 mm,夹缝间隙1 mm的平板间,并添加适量硅油以防水分蒸发,采用PP50探头。动态温度扫描条件:频率为1 Hz,应变为0.1%,温度以5 ℃/min从25 ℃升至85 ℃,保持30 min,再由85 ℃降至25 ℃。记录样品的G’和损耗角tanδ随温度变化的趋势,每个样品重复测定3 次。
1.4 数据处理
采用Excel 2016进行实验数据的存档,采用Duncan多重比较对数据进行显著性分析,P<0.05,差异显著,采用Origin 9.0软件绘图。
2 结果与分析
2.1 混合凝胶质构特性
2.1.1 凝胶强度
凝胶强度对食品的组织状态及品质有重要影响[26]。由图1可知,EWP凝胶的硬度((1 614.9±126.4)g)远高于PP凝胶的硬度((460.5±4.4)g),当PPEWP比例为1∶0和9∶1时,混合凝胶的强度差异不显著(P>0.05),但随着EWP比例的进一步提高,混合凝胶强度逐渐提高(P<0.05)。相关研究[27]表明,PP在40 ℃以上加热时会发生沉淀,而PP在提取过程中,由于热絮凝导致溶解度降低,这些不可溶物质可能影响凝胶的形成,导致PP凝胶强度较低。在蛋白体系中,EWP有效提升了混合蛋白凝胶的硬度,这与廖安等[28]对大豆蛋白与蛋清粉复合体系功能特性的研究结果相似。EWP中含有较多的巯基,加热导致巯基和二硫键相互转化,从而使分子间二硫键作用加强[18],凝胶强度增大。因此,EWP可有效提升混合蛋白凝胶性能。

图1 不同PP-EWP比例的混合凝胶强度Fig. 1 Hardness of blended gels with different PP to EWP ratios
2.1.2 保水性
由图2可知,PP凝胶的保水性((97.5±0.71)%)显著大于EWP凝胶的保水性((73.5±0.71)%),混合凝胶的保水性随着EWP含量的增加而降低,当PP-EWP比例为1∶0和9∶1,9∶1和3∶1,1∶1和1∶3,1∶9和0∶1时,每组两组处理之间无显著性差异(P>0.05),各组之间差异显著(P<0.05)。以上结果表明,EWP显著降低了混合蛋白体系的保水性。陈洪生等[29]的研究结果表明,随着EWP含量的增加,EWP和肌原纤维蛋白混合凝胶的保水性呈下降趋势,与本研究结果类似。蛋白在不同pH值条件下,形成凝胶的结构和保水性不同。EWP在pH值小于8时,形成的凝胶结构粗糙[30],保水性差,PP在pH 6.5~7.5形成的凝胶黏聚性和保水性较好[31]。本研究采用的pH值为7.0,EWP和PP在此条件下加热后,随着EWP的增加,形成的凝胶结构不能有效的锁住水分,导致保水性下降。从上述结果可知,PP在保水性方面与EWP形成互补,有效提升了凝胶体系的保水性。

图2 不同PP-EWP比例的混合凝胶保水性Fig. 2 WHC of blended gels with different PP to EWP ratios
2.1.3 扫描电子显微镜观察结果
如图3所示,PP凝胶微观结构的均一程度大于EWP凝胶,且随着EWP比例的增加,混合凝胶结构的粗糙度和表面不平整度逐渐增大,且当PP和EWP的比例小于1时,混合凝胶粗糙程度显著增大。比较混合凝胶的微观结构以及保水性可以发现,凝胶的保水性与其微观结构均一程度趋势一致。Salvador等[32]研究了凝胶结构和保水性的相关性,发现结构致密的凝胶更容易截留水分,因此具有较低的保水性,与本实验结果相似。
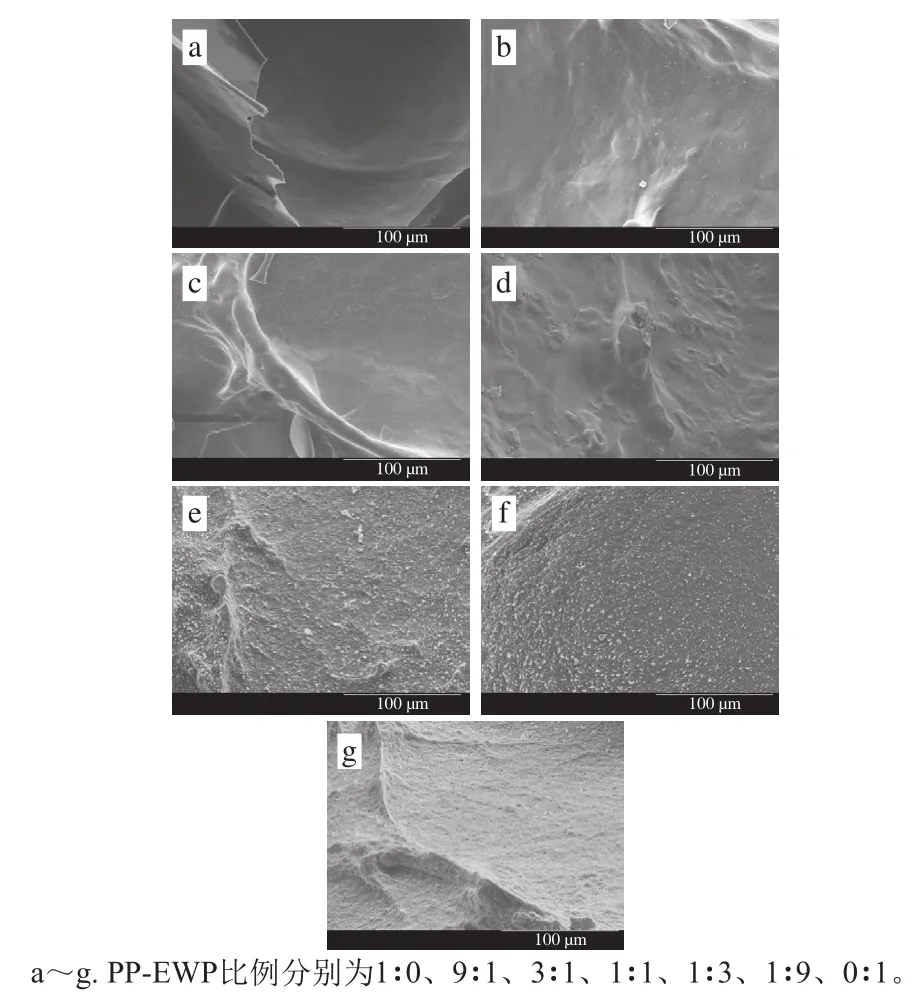
图3 不同PP-EWP比例混合凝胶的扫描电子显微镜图Fig. 3 Scanning electron micrographs of blended gels with different PP to EWP ratios
2.2 混合蛋白凝胶分子结构特性
2.2.1 二级结构
如表1所示,混合凝胶的蛋白二级结构均以β-折叠为主,其次是α-螺旋或β-转角,其中PP凝胶的β-折叠相对含量((45.00±0.40)%)显著高于EWP凝胶((38.85±1.42)%)。随着EWP含量的增加,β-折叠和α-螺旋相对含量先下降后上升,无规卷曲相对含量先上升后下降,β-转角无明显变化规律。可见2 种蛋白混合后,凝胶的二级结构逐渐由有序状态向无序状态转变。Su Yujie等[18]研究表明,EWP和大豆蛋白混合凝胶的蛋白二级结构以β-折叠和β-转角为主,同时α-螺旋相对含量与弹性、保水性呈正相关,β-折叠相对含量与凝胶硬度呈正相关。本研究与以上结果存在差异,原因可能是蛋白质二级结构的变化取决于氨基酸序列和蛋白质分子之间的相互作用,如氢键、疏水相互作用等,也与体系中不同蛋白二级结构的差异有关[33],引起上述变化的机理有待进一步研究。
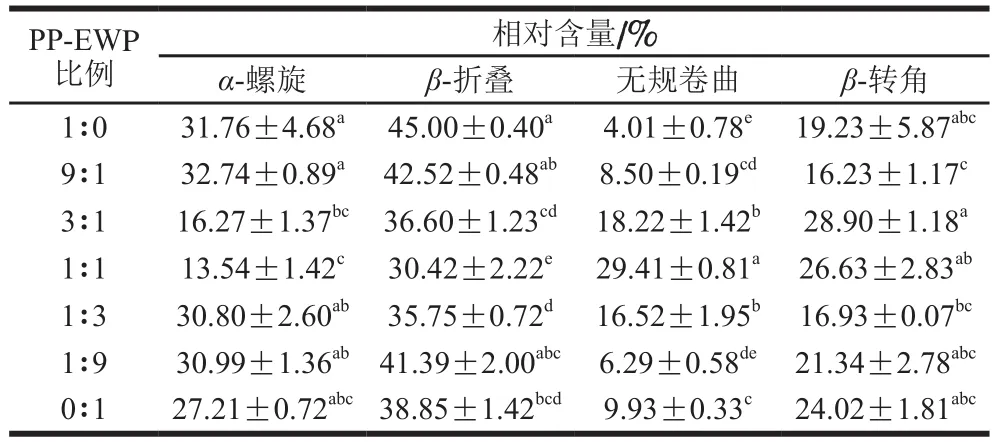
表1 不同PP-EWP比例混合凝胶二级结构相对含量Table 1 Relative contents of secondary structures of blended gels with different PP to EWP ratios
2.2.2 分子间作用力
凝胶形成过程中,形成和决定蛋白凝胶网络的主要作用力有疏水作用、氢键、静电作用以及二硫键等,其构成决定了蛋白凝胶的特性[34-35]。这些化学键可被特定的化学试剂破坏,通过在不同化学试剂中混合蛋白凝胶溶解度的不同,表征混合蛋白凝胶中化学键的变化。如图4所示,PP-EWP混合凝胶中的分子间作用主要是疏水相互作用,其次是氢键,离子键作用相对较少。随着EWP的添加,疏水相互作用贡献显著增强(P<0.05),由(86±5.40) g/L增强至(126.51±1.37) g/L;氢键的贡献力先由(80.15±5.93) g/L降低至(40.11±3.87) g/L后升高至(62.40±3.37) g/L (P<0.05);离子键变化无规律性趋势。此结果与Croguennec等[36]研究热诱导EWP凝胶的主要分子间作用力一致。疏水相互作用的变化趋势与凝胶硬度变化一致,推测混合凝胶的疏水相互作用可能与凝胶硬度相关。氢键作用的变化趋势与二级结构中α-螺旋和β-折叠变化趋势相同,这可能是由于蛋白的二级结构主要由肽链氨基酸上羰基和酰胺基团之间形成的氢键维持,而加热混合蛋白能够破坏氢键作用,使蛋白分子二级结构破坏。
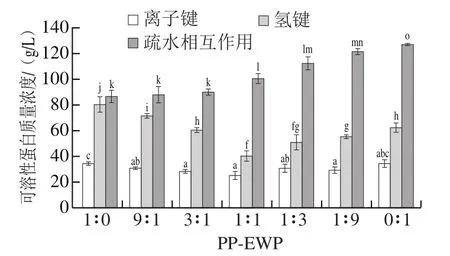
图4 不同比例PP-EWP混合蛋白凝胶分子间作用力Fig. 4 Intermolecular forces of blended gels with different PP to EWP ratios
2.2.3 游离巯基含量
游离巯基基团分布于蛋白质分子的表面,对凝胶的形成十分重要。在热处理过程中,蛋白质展开,导致游离巯基基团易于氧化并形成二硫键。如图5所示,当PP-EWP比例为1∶0、9∶1、3∶1时,随着EWP含量的升高,混合蛋白凝胶的游离巯基含量无显著变化(P>0.05),当PP-EWP比例小于1时,游离巯基含量显著升高(P<0.05)。Shimada等[37]观察到游离巯基基团(SH)在蛋白质形成凝胶的时候可以发生氧化反应转化为S—S键,对蛋白质凝胶强度和结构构成造成一定程度的影响。有研究将游离巯基含量的下降归因于新的二硫键的形成[38]。EWP中含有大量的游离巯基,游离巯基含量的增加归功于EWP的添加,这与Zhang Mengqi等[39]的研究结果类似;而当PP-EWP比例大于1时,EWP的增加本应导致游离巯基的增加,说明在这一阶段游离巯基和二硫键发生交换反应,最终形成具有三维网络结构的凝胶,从而导致凝胶强度升高。
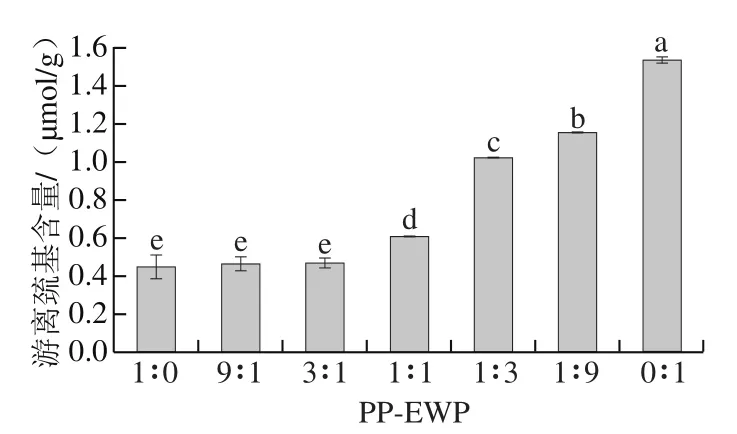
图5 不同PP-EWP比例的混合凝胶游离巯基含量Fig. 5 Free sulfhydryl group contents of blended gels with different PP to EWP ratios
2.3 流变特性
蛋白质分散体和凝胶的流变特性对确定其能否在食品中应用至关重要,是表征食品强度、弹性和黏合特性的重要指标。如图6所示,在升温阶段,随扫描温度的升高,混合蛋白的G’呈先下降再升高的趋势,tanδ呈下降的趋势,且当PP-EWP大于1时,tanδ下降不显著,当PP-EWP小于1时,tanδ急剧下降。在同一扫描温度下,当PP-EWP小于1时,随着EWP添加量的增加,混合蛋白的G’和tanδ逐渐增大;当PP-EWP大于1时,随着EWP添加量的增加,混合蛋白的G’逐渐减小,且随着扫描温度的变化,G’和tanδ变化不显著。在升温阶段前期,扫描温度较低,蛋白质分子未完全变性,分子间离子键和氢键被破坏,疏水基团还被包埋在内部[35],从而使G’降低,随着扫描温度的进一步提高,蛋白分子内部隐藏的巯基、二硫键和疏水基团暴露,分子间相互作用加强,蛋白质分子间随即发生交联聚集,为形成凝胶提供一定驱动力,导致凝胶形成,G’逐渐升高,体系由液体向固体转变,tanδ下降。PP在提取过程中由于热絮凝作用,发生热聚集,导致蛋白发生部分变性,溶解度降低,使PP悬液稠度大,初始G’高,初始tanδ低。在恒温阶段(85 ℃),当PP-EWP比例为3∶1、1∶1、1∶3时,G’和tanδ随恒温扫描的进行变化不明显;当PP-EWP比例为1∶0、9∶1、1∶9、0∶1时,混合蛋白的G’随恒温扫描的进行呈逐渐升高的趋势,tanδ变化不明显。在此阶段主要进行凝胶结构的重排,二硫键促进蛋白分子进一步交联,形成稳定的网络结构。在降温阶段,随着扫描温度的降低,混合蛋白凝胶的G’逐渐增大,tanδ变化不明显且无规律性,凝胶过程结束时,PP-EWP比例为1∶0(全PP)、9∶1(PP占主要组分)和0∶1(全EWP)的G’较高,其中比例为9∶1时G’最大,此阶段主要是氢键发挥作用[18]。
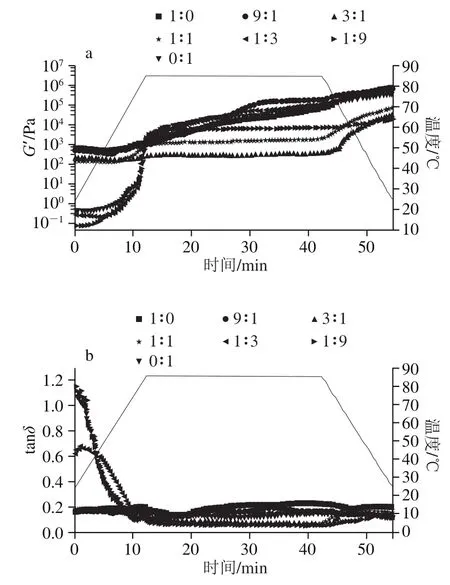
图6 不同比例PP和EWP对混合蛋白G’(a)和tanδ(b)的影响Fig. 6 Effect of PP to EWP ratio on the storage modulus (a) and tanδ (b) of blended gels
2.4 相关性分析
从表2可以看出,凝胶强度与疏水相互作用和游离巯基含量的相关系数分别为0.972和0.923,呈极显著正相关(P<0.01),这说明疏水相互作用和二硫键是维持PP和EWP混合凝胶三级结构的主要作用力。凝胶强度与保水性的相关系数为-0.944,呈极显著负相关(P<0.01),但是与G’无显著相关(P>0.05),董昳廷[19]在大豆蛋白和EWP复合凝胶的质构以及流变性能研究中发现,凝胶硬度与其G’呈极显著正相关,这也可以说明凝胶硬度与G’均反映了凝胶体系的坚硬程度,但是本研究未发现其之间的相关性,原因可能是商业PP经热絮凝发生聚集和部分变性后,其流变性能发生了改变。氢键和β-折叠呈极显著正相关(P<0.01),与无规卷曲呈显著负相关(P<0.05),这可能是由于蛋白的二级结构主要由肽链氨基酸上羰基和酰胺基团之间形成的氢键维持,氢键含量的降低导致混合凝胶的二级结构从有序向无序转变。

表2 不同蛋白比例凝胶各参数间相关性分析Table 2 Correlation analysis among properties of mixed gels with different ratios between two proteins
3 结 论
本实验考察不同比例PP-EWP复合凝胶的质构性质、结构性质和流变性质。混合凝胶质构性质结果表明,随着混合凝胶中PP比例的降低,混合凝胶的硬度逐渐升高,保水性和粗糙程度逐渐降低,说明2 种蛋白可以优势互补,即EWP可提高混合蛋白的凝胶强度,PP可以提高混合凝胶的保水性和降低其粗糙程度;FT-IR结果表明,2 种蛋白混合后,PP-EWP比例越趋近1∶1时,α-螺旋和β-折叠的相对含量越低,凝胶的二级结构由有序向无序转变;分子间作用力和游离巯基含量结果表明,维持混合蛋白凝胶三维结构的作用力主要是疏水相互作用、二硫键和氢键,随着PP-EWP比例的降低疏水相互作用逐渐增强,氢键作用呈先下降后上升的趋势;流变结果表明,当PP-EWP为9∶1、1∶0和0∶1时,混合凝胶G’较高。相关性分析结果表明,凝胶强度与疏水相互作用和游离巯基含量呈极显著正相关,与保水性呈极显著负相关,与G’无显著相关性。本研究阐明了PP和EWP复配对混合凝胶特性的影响规律,为PP和EWP混合体系的实际应用提供了理论依据,但是有关PP和EWP之间的相互作用机理还有待今后进一步研究。
