β-乳球蛋白多酚三配体复合物纳米颗粒的制备与表征
2022-02-16姬雨雪郑丽丽艾斌凌郑晓燕盛占武
姬雨雪,郑丽丽,杨 旸,钟 爽,艾斌凌,郑晓燕,校 导,盛占武,*
(1.海南大学园艺学院,海南 海口 570228;2.中国热带农业科学院海口实验站,海南 海口 570102;3.海口市香蕉生物学重点实验室,海南 海口 570102)
植物源多酚阿魏酸(ferulic acid,FA)(亲水性)、槲皮素(quercetin,QT)(疏水性)和香草酸(vanillic acid,VA)(两亲性)等具有抗菌、消炎、抗氧化、清除自由基、抑制血小板聚集和血栓形成的作用[1-3]。多酚对外界环境(如光和热等)的变化非常敏感,稳定性差,易被氧化形成醌类物质失去活性,限制了其在食品工业中的广泛应用[4]。β-乳球蛋白(β-lactoglobulin,β-LG)的结构中含多个结合位点,作为蛋白质载体与多酚结合后可提高多酚的稳定性和溶解度,也可改善蛋白质的环境敏感性。如今,β-LG被广泛用作包封剂,如纳米颗粒[5-7]、乳化剂[8-9]和纳米复合物[10]。李晓雷等[11]采用β-LG作为载体,使用高效液相色谱检测发现在与β-LG结合后,QT的溶解度提高了1 844 倍。
纳米材料是指50%及以上的颗粒尺寸分布在1~100 nm[12]。由于纳米颗粒粒径较小,被包埋的生物活性物质可以更容易地穿过小肠细胞壁,增加生物活性物质在血液中的浓度,提高其生物利用率[13]。乳化-蒸发法是制备纳米颗粒的方法之一。先将有机相(活性物质)加入水相(乳化剂)中,经过高速剪切、高压均质和微射流等均质手段形成液滴。然后,在真空条件下蒸发掉液滴中的有机溶剂,即可形成纳米包埋颗粒。纳米颗粒的大小可以通过改变均质次数与压力、乳化剂的类型和用量、有机相和水相的体积比例等进行控制。为了获得较小的粒径,通常采用微射流等高能量的均质手段[14]。Bengoechea等[15]利用乳化-蒸发法制备了食物蛋白包埋植物甾醇的纳米颗粒输送体系,具有较好的稳定性和分散性。杜文凯[16]制备了β-LG-表没食子儿茶素没食子酸酯纳米颗粒,有效提高了表没食子儿茶素没食子酸酯的抗氧化活性及抗肿瘤活性。金建昌[17]将4 种儿茶素分别与热诱导β-LG结合制成纳米颗粒,结果证明复合物纳米颗粒延长了儿茶素的抗氧化时效,并对儿茶素有保护和缓释效应。
目前关于β-LG作为绿色生物载体的研究多集中在与单一小分子结合形成单配体复合物纳米颗粒方面[18-19]。课题组前期进行了3种多酚与蛋白结合的实验,探究多酚添加顺序对复合物负载能力的影响,并且在复合物抑制食品中晚期糖基化终末产物(advanced glycation end products,AGEs)的研究结果表明,β-LG与3种多酚形成的三配体复合物对AGEs的抑制效果比多酚单体的效果更好,因其单体之间具有叠加增效作用且多酚与蛋白结合增强了多酚稳定性[20]。因此,本研究以具有多个配体结合位点的β-LG为载体,以植物来源的FA、QT与VA为配体,制备同时负载3种活性物质的蛋白多酚复合物,并在此基础上,优化乳化-蒸发法制备纳米颗粒的工艺,进一步降低复合物粒径,增强多酚稳定性,提高β-LG作为生物载体的利用率,为开发新型的复合纳米颗粒提供理论依据。
1 材料与方法
1.1 材料与试剂
β-LG(18.4 kDa,纯度≥90%) 上海源叶生物科技有限公司;VA(纯度≥97%)、FA(纯度≥99%)、QT(纯度≥96.5%) 中国食品药品检定研究所;乙醇、二水合磷酸二氢钠、十二水合磷酸氢二钠(均为分析纯)西陇化工股份有限公司;甲醇、甲酸、乙腈(均为色谱纯),8-苯胺萘-1-磺酸铵盐(1-anilino naphthalene-8-sulfonic acid,ANS) 美国Sigma公司。
1.2 仪器与设备
F-7000型荧光分光光度计 日本日立公司;Chirascan型圆二色性光谱仪 英国Applied Photophysics公司;UPLC I-Class型超高效液相色谱仪 美国Waters公司;Ultra-TurraxT25高速分散器(配制S25N18G探头)德国IKA公司;APV-1000微射流高压均质机 加拿大ATS公司;RTOP-500Y智能光控制箱 浙江拓普云农科技公司;Zetasizer Nano-ZS90动态多分散粒径仪 英国Malvern公司;Nicolet 6700型傅里叶变换红外光谱仪美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1β-LG三配体复合物的制备
根据Simões等[21]的方法,稍作修改。取β-LG(15 mg/mL)在磷酸钠缓冲液(50 mmol/L,pH 6)中溶解,加入0.02%叠氮化钠用作防腐剂以避免微生物生长。在室温(25 ℃)条件下,400 r/min连续搅拌120 min。将β-LG溶液在4 ℃保存过夜,以确保蛋白质完全水化。通过0.2 μm滤膜过滤样品,去除蛋白质聚集物和杂质。将β-LG溶液放入具塞玻璃管中,在80 ℃水浴加热15 min,取出后在冰中冷却10 min。
将FA、QT和VA分别溶解在磷酸钠缓冲液(50 mmol/L,pH 6)、无水乙醇和70%乙醇溶液中,避光保存。向β-LG溶液加入0.02~0.12 mg/mL不同质量浓度的FA、QT和VA(乙醇含量最多为18%),按照FA>QT>VA的顺序[20]以1 h的间隔依次加入。
1.3.2β-LG三配体复合物纳米颗粒的制备
将1.3.1节获得复合物溶液用高速分散器在5 000 r/min分散2 min,分别在微射流压力40、60 MPa和80MPa下均质1~3 次。通过 40 ℃的旋转蒸发,除去溶剂,使得到的样品中乙醇含量为0。
1.3.3 粒径、多分散指数和Zeta电位
在波长633 nm的He-Ne激光驱动下,通过动态多分散粒径仪测量颗粒尺寸、多分散指数和Zeta电位。取稀释100 倍后的样品[21]1.5 mL分别倒入径长10 mm的一次性石英比色皿和电极比色皿,检测角度为13°。测试3 次取平均值。
1.3.4 多酚的加载率与加载量
参照邓楚君[22]、Cheng Hao等[23]的方法,稍作修改。将复合物纳米颗粒置于超滤离心管中,在14 000 r/min、4 ℃离心15 min。利用超高效液相色谱测定滤液中3种游离多酚单体的含量。将保留在过滤装置中的复合物在55 ℃通风的烘箱中干燥24 h并称质量。按下式计算其加载率和加载量:

FA检测色谱条件:参照傅超等[24]的方法,略有修改。BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相:0.2%甲醇-乙腈(A)-0.1%甲酸溶液(B);梯度洗脱:0~9 min,10% A,90% B;9~15 min,10%~30% A,90%~70% B;15~25 min,30% A,70% B;检测波长324 nm;流速0.3 mL/min;进样量5 μL。
QT检测色谱条件:参照石晓峰等[25]的方法,略有修改。 BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相:乙腈(A)-0.1%甲酸溶液(B);梯度洗脱:0~9 min,5% A,95% B;9~10 min,5%~45% A,95%~55% B;10~20 min,45% A,55% B;检测波长360 nm;流速0.3 mL/min;进样量5 μL。
VA检测色谱条件:参照邹晓红等[26]的方法,略有修改。BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相:乙腈(A)-0.1%磷酸溶液(B);梯度洗脱:0~15 min,5% A,95% B;15~25 min,5%~20% A,95%~80% B;25~30 min,20% A,80% B;检测波长254 nm;流速0.3 mL/min;进样量5 μL。
1.3.5 稳定性
1.3.5.1 贮藏稳定性
样品充N2后室温环境下避光保存35 d,每7 d取样测定粒径及其多分散指数,考察样品贮藏过程中粒径的变化[20]。
1.3.5.2 光稳定性
将样品放置在离LED光源约9~10 cm处,光照强度为4 000 lx,温度保持在25 ℃左右,每6 h用超高效液相色谱测定一次样品中FA、QT与VA含量变化[27]。
1.3.5.3 热稳定性
将样品分别置于25、35、45 ℃和55 ℃的避光水浴锅中。8 h后取样,使用超高效液相色谱测定样品中FA、QT与VA含量的变化[28]。
1.3.6 荧光光谱
在25 ℃条件下,取样品稀释至恒定蛋白质量浓度(0.20 mg/mL),分别收集激发波长在260~340 nm(Δλ=15 nm)和220~360 nm(Δλ=60 nm)的同步荧光光谱[29]。
在25 ℃条件下,取样品稀释至恒定蛋白质量浓度(0.20 mg/mL)分别测定三维荧光图谱。测定条件:激发波长200~350 nm(采样间隔2 nm),发射波长200~500 nm(采样间隔2 nm)[29]。
在25 ℃条件下,取样品稀释至恒定蛋白质量浓度(0.20 mg/mL)分别测定外源荧光光谱。避光条件下,用甲醇制备1.36 mmol/L的ANS储备溶液。将20 μL ANS溶液加入样品(4 mL)中,并在25 ℃孵育10 min。测量条件:激发波长370 nm,发射波长400~600 nm[30]。
1.3.7 傅里叶红外光谱
将干燥的纳米颗粒与KBr以1∶100的比例混合于玛瑙研钵中,研磨混匀,压片后制成透明薄片,放置红外光谱仪中以4 cm-1的分辨率从4 000~500 cm-1进行频率扫描。
1.3.8 圆二光谱
在185~260 nm的范围内,以1 nm/0.5 s的速率,0.2 nm分辨率测量。将蛋白质质量浓度设为0.20 mg/mL,远紫外区的路径长度设为0.5 mm,数据采集时采用恒定的氮气冲洗。实验数据用CD pro软件分析各种二级结构的相对含量[31]
1.3.9 透射电子显微镜观察
在80 kV加速电压下,采用负染色法,将样品分散液滴在铜网格碳支撑膜上,并在2 min后用滤纸和干燥的网格去除多余的溶液。用负染液磷钨酸(质量分数2%)在15 s内对样品进行负染,网格在室温下风干后进行观察[21]。
1.4 数据处理
所有实验重复3 次,用Origin 8.5软件进行数据分析及作图处理,采用SAS 9.4软件进行统计分析,P<0.05,差异显著。
2 结果与分析
2.1 纳米颗粒制备工艺优化
为最大程度排除微射流均质压力的影响,针对不同均质次数对复合物粒径影响的研究中选取3个不同压力,结果见表1。当压力分别为40、60 MPa和80 MPa时,随着均质次数的增加,复合物粒径呈现上升现象,平均粒径最小值均出现于第1次均质的过程中,因此确定最佳均质次数为1 次;随着微射流均质压力的增加,复合物粒径呈现先降低后增加的现象,平均粒径最小值出现于60 MPa的均质过程中,当均质压力进行至80 MPa,复合物的粒径及相应多分散指数有所增加。次数和压力的增加会导致多分散指数和粒径增加,推测是由于均质过程中提供大量能量导致新液滴的快速重聚集,即“过处理现象”。高频的聚集现象和极高的能量密度是产生“过处理现象”发生的主要原因之一[32]。而经过60 MPa压力下第1次均质过程产生的复合物具有较低的多分散指数,表明经此条件制备的复合物分散性最好。因此,在本实验的后续研究中,通过对复合物进行60 MPa、1 次微射流均质处理获得复合物纳米颗粒。
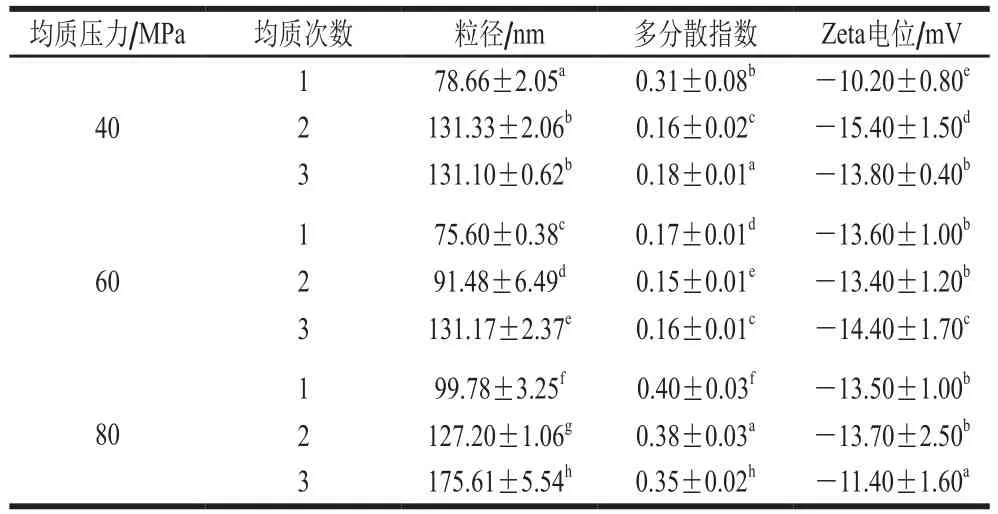
表1 不同均质压力和均质次数下复合物的平均粒径、多分散指数与Zeta电位Table 1 Mean size, polydispersity index and zeta potential of composite nanoparticles prepared with different homogenization pressures and different homogenization cycles
2.2 粒径、多分散指数和Zeta电位
如表2所示,经过80 ℃热处理15 min的β-LG平均粒径为185.6 nm,添加多酚后,复合物平均粒径在130.8~156.2 nm之间,为亚微米级,可见,多酚的加入使复合物粒径降低,这主要是因为3种多酚与蛋白发生结合,使蛋白分子间相互作用减少,表现为粒径的降低[33]。经过乳化-蒸发方法制备的复合物平均粒径在74.5~80.7 nm之间,为纳米颗粒。可见,乳化-蒸发法进一步减小了复合物粒径,可能是由于在真空条件下,复合物中的有机溶剂蒸发后液滴收缩导致[34]。
不同多酚质量浓度的复合物纳米颗粒多分散指数都小于0.21,证明复合物纳米颗粒粒径呈单峰分布且稳定均匀。从表2可以看出,随着多酚质量浓度的增加,复合物纳米颗粒的粒径呈下降趋势,多酚质量浓度在0.12 mg/mL时,粒径趋于平稳,证明多酚质量浓度对复合物粒径有一定影响,在质量浓度0.08 mg/mL条件下的粒径和多分散指数最优,但随着多酚质量浓度的增加Zeta电位未发生规律性的变化。三配体复合物的粒径随多酚质量浓度的增加而增加,在0.12 mg/mL时多分散指数明显提高,说明此质量浓度下的复合物粒径不均匀,呈多峰分布,可能是蛋白结合位点饱和,未结合的多酚分布在复合物中,而复合物纳米颗粒未出现这种情况可能是因为纳米结构具有更大的比表面积,可结合更多的化合物[33]。综合分析,选择最稳定的质量浓度0.08 mg/mL多酚的纳米颗粒进行后续表征。
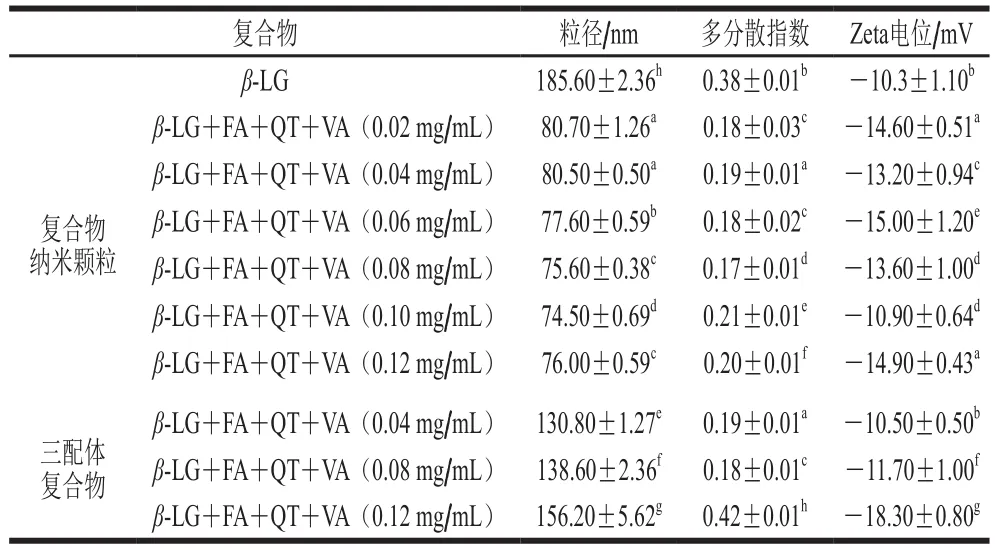
表2 复合物的平均粒径、多分散指数与Zeta电位Table 2 Mean size, polydispersity index and zeta potential of composite nanoparticles
2.3 加载率与加载量
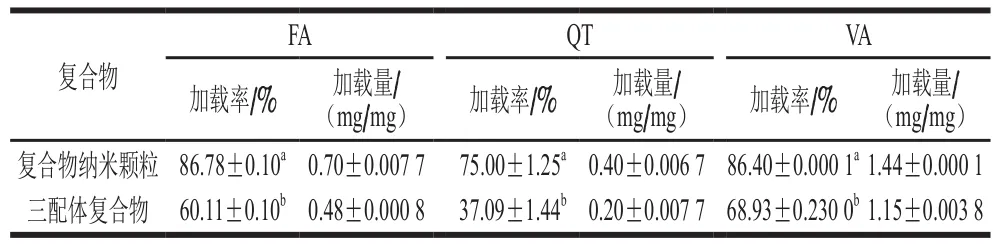
表3 FA、QT和VA在复合物中加载率和加载量Table 3 Loading efficiency and loading capacity of FA, QT and VA in composite nanoparticles
表3显示复合物纳米颗粒中FA、QT和VA的加载率分别为86.78%、75.00%和86.4%。三配体复合物FA、QT和VA的加载率分别为60.11%、37.09%和68.93%。复合物纳米颗粒的加载率均明显高于三配体复合物,其中,复合物纳米颗粒中FA、QT和VA比三配体复合物高26.67%、37.91%和17.47%,这可能是因为纳米结构具有更大的比表面积和体积比,能结合更多小分子,这与粒径结果一致。在复合物中,FA与VA的加载量都高于QT,这可能是QT的疏水性所致,而经乳化-蒸发处理后的纳米颗粒中,QT的加载率升高约38%。
2.4 稳定性
2.4.1 热稳定性
如图1所示,随着温度的升高,复合物纳米颗粒中FA加载率变化不明显,而QT和VA呈下降趋势;三配体复合物中多酚加载率均呈现下降趋势,其原因可能是热处理减弱了β-LG与多酚之间作用力,使部分多酚从β-LG上解离,失去β-LG的保护所致。Prigent等[35]研究了在5、25 ℃和60 ℃条件下牛血清白蛋白与绿原酸的非共价作用,结果显示,两者的结合能力随着温度的升高而降低,这与本研究结果一致。
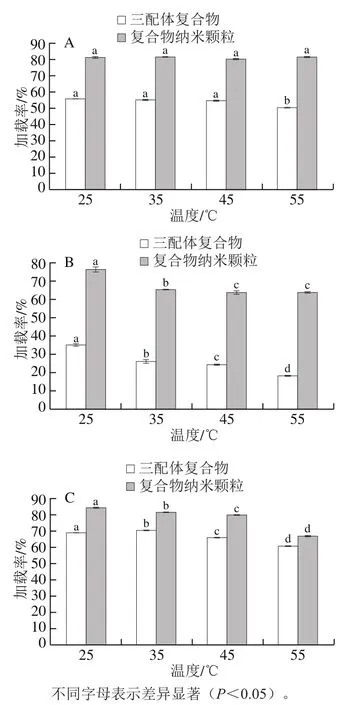
图1 不同温度下复合物中FA(A)、QT(B)和VA(C)的加载率Fig. 1 Loading efficiency of FA (A), QT (B) and VA (C) in composite nanoparticles at different temperatures
2.4.2 光稳定性
如图2所示,在可见光照射24 h之内,复合物中FA、QT和VA的加载率呈下降趋势。纳米颗粒中FA、QT和VA的多酚加载率分别下降12%、8%和4%,三配体复合物中FA、QT和VA的多酚加载率分别下降13%、21%和10%。可以看出,复合物纳米颗粒加载率的下降速率低于三配体复合物。在照射24 h后,复合物中多酚的加载率下降速率显著增大,而在对照组在避光条件下,多酚加载率的变化较小。

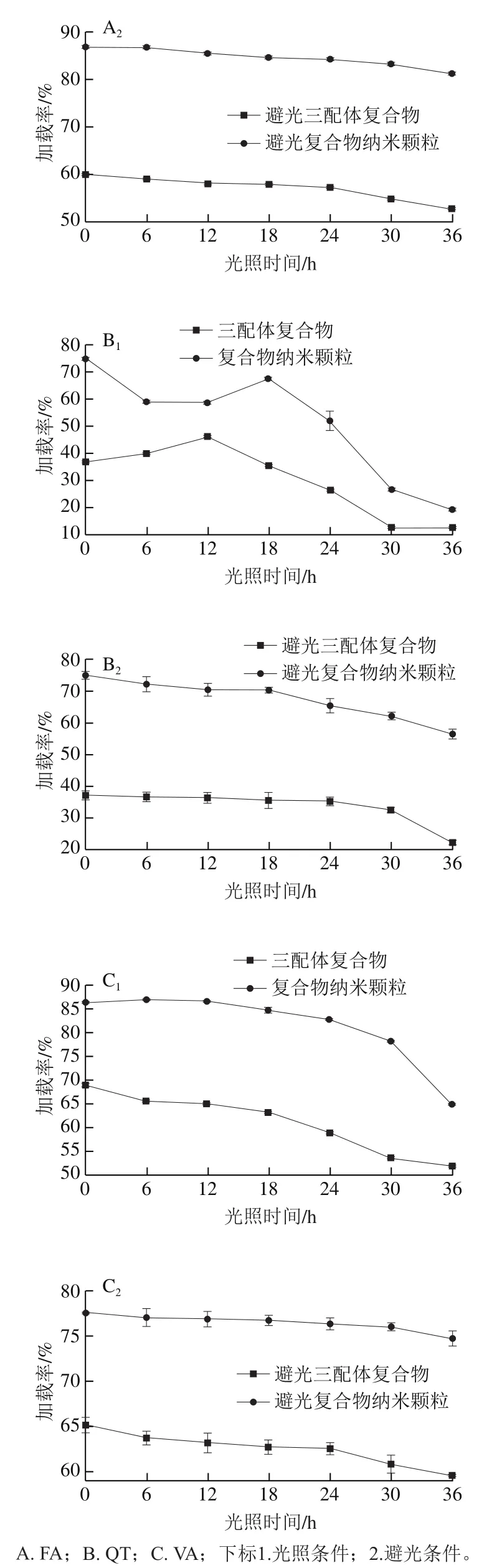
图2 不同光照时间下多酚单体在复合物中的加载率Fig. 2 Loading efficiency of polyphenol monomers in composite nanoparticles with different light exposure durations
2.4.3 贮藏稳定性
由图3可知,随着贮藏时间的延长,复合物粒径逐渐变大,这主要是由于多酚和蛋白的聚集体是热力学不稳定体系,随着贮存时间的延长颗粒之间发生相互聚集使界面自由能降低,从而导致复合物粒径的增大[36]。贮藏35 d后,复合物纳米颗粒的粒径仍然小于100 nm,说明其稳定性较高。
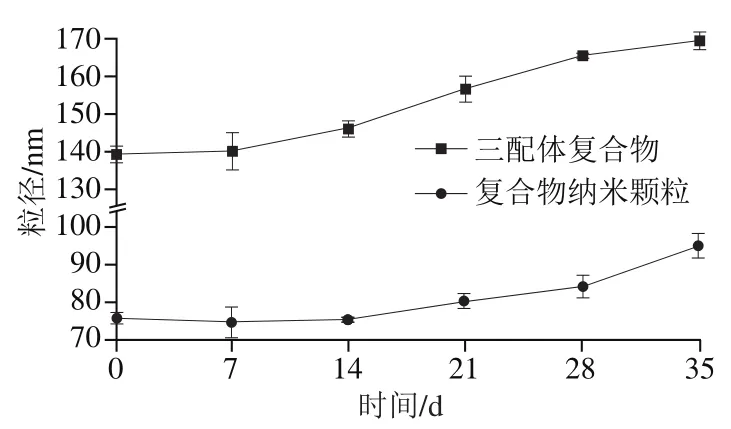
图3 贮藏稳定性Fig. 3 Storage stability of composite nanoparticles
2.5 荧光光谱
2.5.1 同步荧光光谱
采用同步荧光光谱法对荧光团微环境的变化进行表征[37]。如图4所示,加入3种多酚后2 种样品的荧光强度均明显降低,说明多酚的加入对β-LG的微环境造成了影响,色氨酸的荧光强度下降较多,说明蛋白质的构象变化主要发生在色氨酸基团附近[38]。
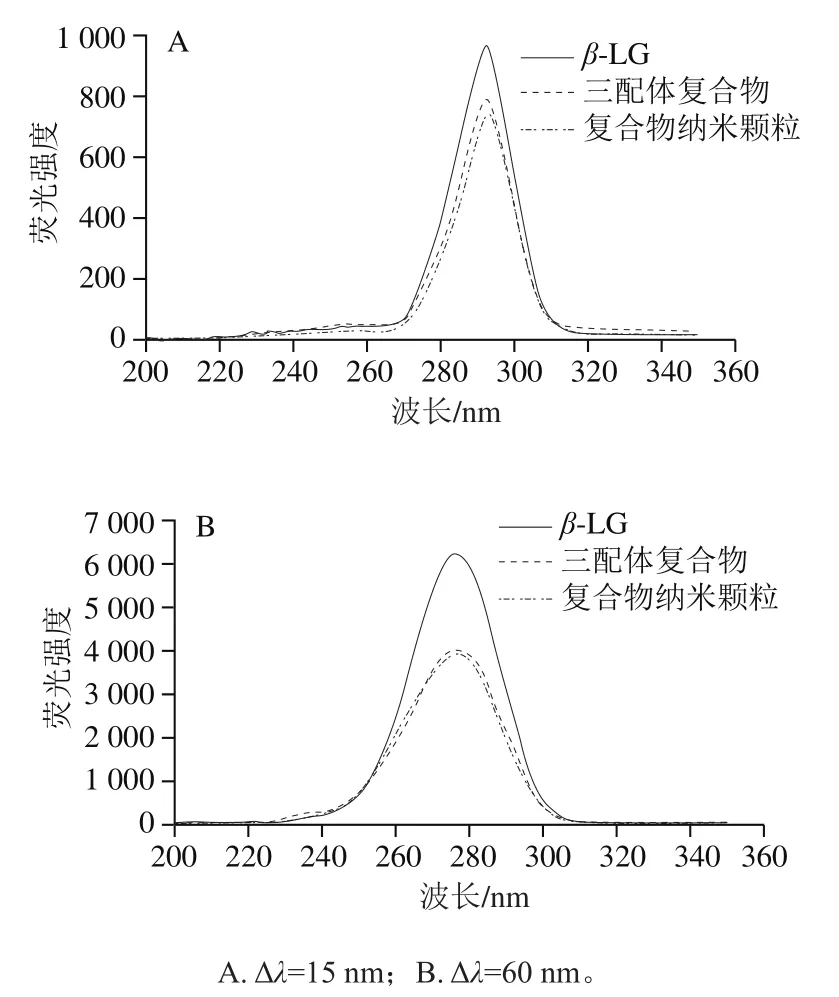
图4 复合物同步荧光光谱图Fig. 4 Synchronous fluorescence spectra of composite nanoparticles
2.5.2 外源荧光光谱
通过荧光疏水探针ANS的结合,检测蛋白质疏水性的变化。β-LG具有不同的2个ANS结合位点,一部分位于内部(即在疏水蛋白核内),含有二硫键;以及另一部分位于外部(即靠近蛋白表面的疏水斑),负责非特异性的ANS相互作用[39-40]。如图5所示,加入多酚后,蛋白疏水性显著降低,可能是因为多酚的加入使蛋白疏水区与ANS结合的位点减少,这与罗舒菡[41]研究结果一致。蛋白疏水性随着复合物粒度的降低而降低,这可能是纳米颗粒制备过程中经过微射流均质的处理。在高压剪切作用下,蛋白颗粒表面暴露出了更多的可与多酚结合的内部疏水基团[42],导致更少的疏水性氨基酸与ANS结合。这也可以解释当加入多酚质量浓度相同时,复合物纳米颗粒比三配体复合物具有更高的加载率。
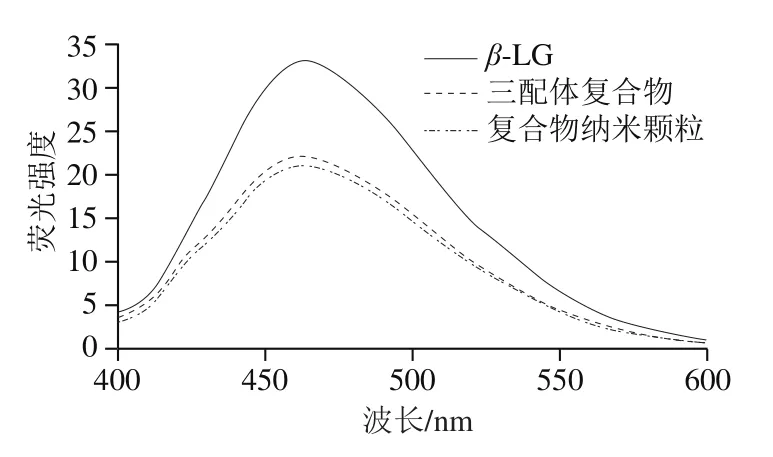
图5 复合物外源荧光光谱图Fig. 5 Extrinsic fluorescence emission spectra of composite nanoparticles
2.5.3 三维荧光光谱
三维荧光光谱是当激发波长和发射波长同时变化时,获得的荧光强度变化,它可以提供蛋白质结构变化的更多细节。图6中存在4个峰:a、b、c和d。峰a代表Trp和Tyr残基的光谱特征峰;峰b与蛋白质的二级结构相关;峰c代表瑞利散射峰;峰d代表二阶散射瑞利散射峰[43]。从图6A、B可知,由于FA、QT和VA的加入,峰a和峰b的荧光强度逐渐降低,这说明FA、QT和VA不仅可以影响Tyr和Trp残基附近的微环境,还可能造成蛋白质结构的改变。且复合物纳米颗粒(图6C)的峰b明显比三配体复合物(图6B)的峰b低,说明前者的二级结构变化比后者大。
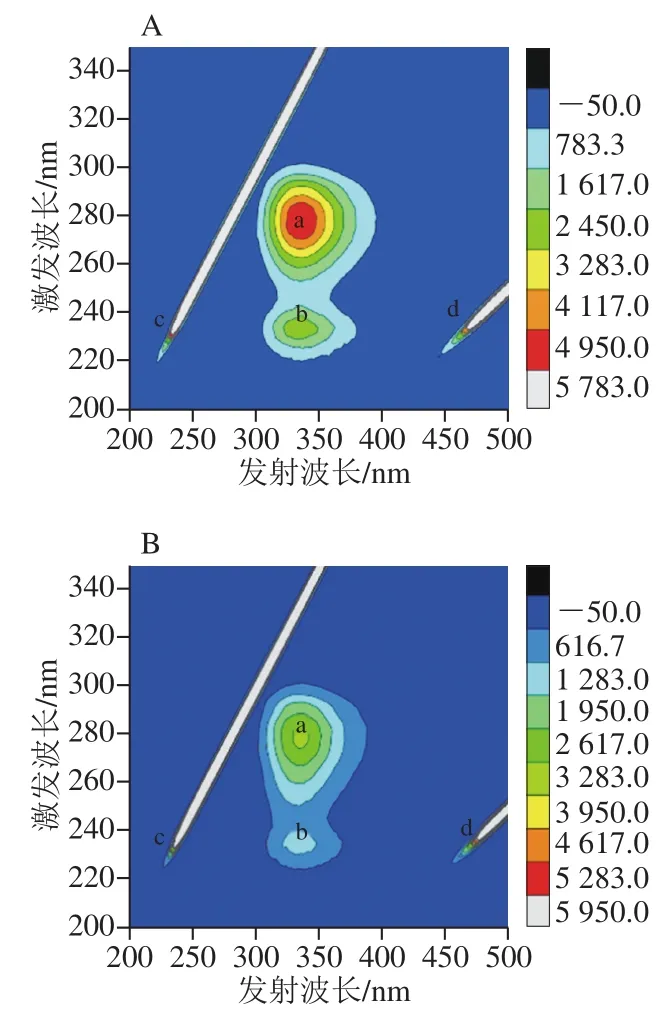
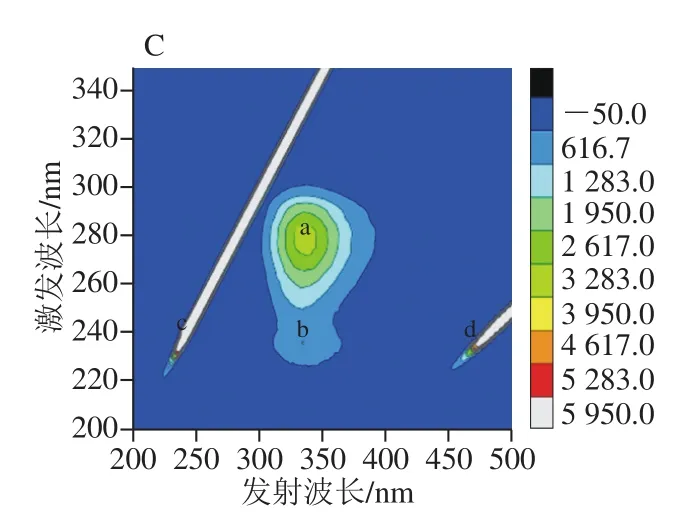
图6 β-LG(A)、三配体复合物(B)和复合物纳米颗粒(C)的三维荧光图谱Fig. 6 Fluorescence excitation-emission matrix landscapes of β-LG (A),three-ligand composite (B) and nanoparticles (C)
2.6 红外光谱
用红外光谱分析多酚与蛋白质结合的构象变化,1 700~1 600 cm-1峰位的酰胺I带与蛋白的二级结构相关。如图7所示,酰胺I带(C=O拉伸)从1 639.37 cm-1(线d)显著移动到1 643.35 cm-1(线f),这种位移变化是蛋白与多酚相互作用的结果,根据Tao Yang等[44]的研究,花青素与β-LG等蛋白质相互作用,导致蛋白质二级结构中α-螺旋结构增多,这与本研究结果一致。与此同时,比较β-LG(线d)、三配体复合物(线e)和纳米颗粒复合物(线f)的红外光谱,发现位于3 363.45 cm-1的羟基振动峰转移到了3 354.24 cm-1,这是因为蛋白中酰胺的氨基与FA(线a)、QT(线b)和VA(线c)的羟基之间发生了相互作用而形成了氢键,氢键的形成会使伸缩振动波数移向低波数,这说明多酚已被蛋白包埋[45]。
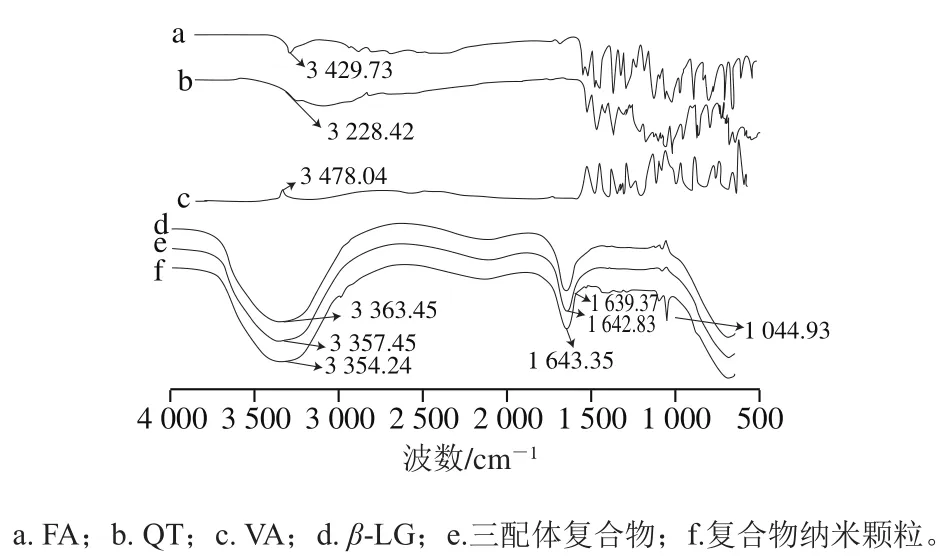
图7 多酚单体与复合物的傅里叶红外光谱Fig. 7 FTIR spectra of polyphenol monomers and composite nanoparticles
2.7 圆二色谱结果
β-LG与多酚等小分子相互作用可能导致β-LG二级结构的相关变化。由表4可知,与纯β-LG相比,复合物纳米颗粒中的α-螺旋相对含量由11.0%增加到35.3%,三配体复合物中的α-螺旋相对含量由11.0%增加到15.1%,这可能是多酚与蛋白的相互作用引起了多肽链的收缩,形成新的氢键所致。儿茶素与β-LG相互作用研究表明,儿茶素使β-LG中的α-螺旋相对含量增加,β-LG结构更加稳定,这与本研究结果一致[46]。
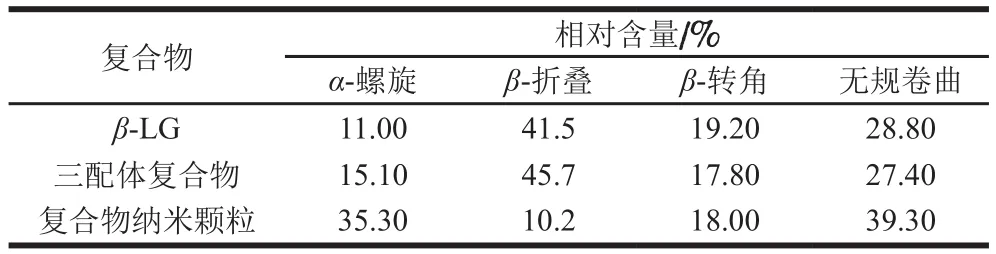
表4 复合物二级结构变化Table 4 Changes of secondary structures in composite nanoparticles
2.8 透射电子显微镜观察结果
如图8所示,经过80 ℃热处理15 min的β-LG呈球形且有聚集(图8A);三配体复合物(图8B)为圆形且分布均匀,并且在负染过程中形成了团簇;图8C、D分别为0.12 mg/mL和0.08 mg/mL多酚质量浓度下的复合物纳米颗粒,外形近似椭圆形,粒径在50~60 nm之间,与动态光散射结果一致。

图8 复合物透射电镜图Fig. 8 TEM images of composite nanoparticles
3 结 论
利用热变性后的β-LG为载体同时负载FA、QT和VA三种多酚,制备三配体复合物。再利用乳化-蒸发法成功制备出低于100 nm的复合物纳米颗粒,探究微射流压力、均质次数和多酚质量浓度对纳米颗粒的影响。结果表明,在微射流均质压力为60 MPa、均质1 次,加入的多酚质量浓度为0.08 mg/mL时,可获得粒径分布稳定的复合物纳米颗粒。通过分析同步荧光、三维荧光、外源荧光光谱的变化发现多酚对复合物蛋白的微环境、二级结构和疏水性有明显影响,乳化-蒸发法使蛋白表面疏水性升高,蛋白二级结构变化更明显;通过红外色谱分析,多酚与蛋白主要通过氢键结合。通过圆二色谱进一步分析复合物中蛋白二级结构的变化,相较β-LG,复合物纳米颗粒的二级结构变化较大;相较三配体复合物,纳米颗粒的α-螺旋相对含量增加,β-折叠相对含量减少,β-转角相对含量基本不变,无规卷曲增加;透射电子显微镜图像结果显示,2 种复合物均呈椭圆形,与三配体复合物相比,纳米颗粒分布更均匀、粒径更小。通过动态光散射和超高效液相色谱分析,复合物纳米颗粒对3种多酚的加载率和稳定性均高于三配体复合物。综上,可以推测出在乳化-蒸发过程中,微射流均质使蛋白暴露出更多多酚结合位点,提高蛋白的加载率;旋转蒸发去除溶剂则显著提高了复合物的粒径,使其达到纳米级,并将多酚包埋在蛋白内,因纳米颗粒具有尺寸效应和表面效应等特性,又可显著提高多酚稳定性,这为构建多种活性物质的包埋与输送体系提供了理论基础。
