丙氨酸和丁二酮Maillard反应形成烷基吡嗪化合物动力学分析
2022-02-16林珮璇张宏婧陈继承
林珮璇,张宏婧,陈继承
(福建农林大学食品科学学院,福建 福州 350002)
美拉德反应是食品热加工或长期贮藏后香气和色泽至关重要的来源[1]。烷基吡嗪[2]作为挥发性美拉德反应产物其中一类独特的风味物质,具有烤香、咖啡香、肉香、炒芝麻香、坚果香、花生香等强烈的芳香特征。烷基吡嗪既可单独使用,也可与其他香气产生叠加效果,使香味更加丰富多彩。对咖啡和面包等烘焙食品[3-4],葵花籽油等粮油产品[5],醋类、酒类和酱类等发酵制品[6-7]的风味品质评价都具有重要指导性意见。一直是香精香料学、食品加工工艺学、食品化学等领域研究热点。
美拉德反应是羰基化合物和氨基化合物的反应,底物虽简单但所涉及的生成路径、反应产物复杂多样并且受多种反应条件影响,机制复杂[8]。Zhao Jian[9]和Zhan Huan[10]等均认为反应温度和时间是影响美拉德反应产生风味物质的重要因素。Scalone等[11]研究也发现反应pH值影响风味物质种类及含量。烷基吡嗪的形成与羰基化合物密切相关,但仍存在很大争议[12-13]。Strecker降解是生成路径之一[14-15],Strecker降解涉及α-氨基羰基化合物的生成、缩合与氧化。α-氨基羰基化合物衍生自碳水化合物降解产生的二羰基化合物,在碱性、高温等条件下与氨基酸结合生成[9,16-17]。α-氨基羰基化合物通过缩合反应生成二氢吡嗪,二氢吡嗪作为重要的中间产物发生自氧化反应或与羰基化合物反应生成吡嗪类化合物[11,18]。烷基吡嗪的形成已在各种反应体系中进行了模拟研究,但建立的反应体系大多数集中于以糖类化合物或具有相似结构的化合物为碳源。多项研究[19-23]均以抗坏血酸为主体,与不同氨基酸建立反应体系探究吡嗪等芳香化合物的生成影响,且表示吡嗪化合物的生成过程中氨基酸只提供氮源,对碳骨架没有影响。Adams等[24]对吡嗪的生成探讨也基于抗坏血酸和氨基酸反应体系。也有部分研究涉及肽类对吡嗪类化合物生成的影响,但碳源底物大多仍以糖类化合物为主[15,25-26]。在糖类化合物参与的美拉德反应中会有部分糖类化合物参与发生焦糖化反应[27],焦糖化反应会引起褐变现象,而对风味贡献较小。烷基吡嗪的生成途径是从α-氨基酮开始,这是二羰基化合物与氨基酸通过Strecker降解缩合的产物[28-29]。在美拉德反应中二羰基化合物是烷基吡嗪生成的关键前体。Yu Ainong等[22-23]的研究也表示吡嗪芳香化合物的生成可能与L-抗坏血酸热降解过程中产生的一系列活性中间体,如乙二醛、丙酮醛、羟基丁二酮和丁二酮等密切相关。但较少研究涉及建立以α-二羰基化合物为碳源底物的反应体系,同时关于烷基吡嗪生成动力学也缺少讨论。另有研究指出乙偶姻是烷基吡嗪生成的重要前体物质之一,2,3-丁二酮(2,3-butanedione, 2,3-BD)又为乙偶姻的下游物质[30]。因此,本实验选以2,3-BD为美拉德反应羰基化合物来源,构建丙氨酸(alanine,Ala)-2,3-BD反应体系,通过高效液相色谱(high performance liquid chromatography,HPLC)法研究反应温度、时间、pH值对烷基类吡嗪化合物生成规律的影响,并通过数学拟合构建动力学模型,确定烷基类吡嗪化合物的表观活化能,以期为深入探讨吡嗪类化合物反应机理提供参考。
1 材料与方法
1.1 材料与试剂
8 种标准化学品(≥99%):2,3-二甲基吡嗪(2,3-dimethylpyrazine,2,3-DMP)、2,5-二甲基吡嗪(2,5-dimethylpyrazine,2,5-DMP)、2,6-二甲基吡嗪(2,6-dimethylpyrazine,2,6-DMP)、2,3,5-三甲基吡嗪(2,3,5-trimethylpyrazine,TriMP)、四甲基吡嗪(tetramethylpyrazine,TMP)、乙基吡嗪(ethylpyrazines,EP)、2-乙基-3-甲基吡嗪(2-ethyl-3-methylpyrazine,EP-3-MP)和2-乙基-5-甲基吡嗪(2-ethyl-5-methylpyrazine,EP-5-MP) 上海源叶生物科技有限公司;Ala、2,3-BD、盐酸、氢氧化钠、Na2HPO4·12H2O和NaH2PO4·2H2O 国药集团化学试剂有限公司;甲醇、乙腈(均为色谱级) 德国默克公司;实验用水是超纯水,使用Millipore公司的Direct-Q UV 3系统(18.2 MΩ·cm)生产;所有化学药品均为超纯或分析纯。
1.2 仪器与设备
FE28-standard pH计 上海梅特勒-托利多仪器有限公司;MX-S涡旋振荡器 北京大龙兴创实验仪器股份公司;DHG-9245A电热鼓风干燥箱 上海一恒科学仪器有限公司;水热合成反应釜 上海秋佐科技有限公司;2695-2998 HPLC仪、XBridge C18色谱柱(4.6 mm×250 mm,5 μm) 美国Waters公司。
1.3 方法
1.3.1 不同pH值磷酸盐缓冲液的制备
0.2 mol/L Na2HPO4的制备:称取71.628 0 g Na2HPO4·12H2O定容至1 000 mL容量瓶;0.2 mol/L NaH2PO4的制备:称取31.200 0 g NaH2PO4·2H2O定容至1 000 mL容量瓶。其中0.2 mol/L NaH2PO4的pH 4.2,按照一定体积比进行均匀混合配制得pH值分别为5、6、7、8和9的磷酸盐缓冲液(现配现用)。
1.3.2 体系反应液的制备
将Ala(1 mmol)溶解于10 mL Na2HPO4-NaH2PO4缓冲液中,通过0.1 mol/L NaOH溶液进行pH值调节。随后2,3-BD(1 mmol)加入溶液中,充分涡旋混合液并密封于水热合成反应釜中,置于鼓风干燥箱中反应。模型反应初始浓度为Ala∶2,3-BD=0.1 mol/L∶0.1 mol/L,每个样品重复进行3 次。待反应结束,迅速冰浴冷却终止反应,进行HPLC分析。
在反应温度90 ℃、反应pH 9,考察反应时间(2、4、6、8、10 h和12 h)对Ala-2,3-BD反应体系生成烷基类吡嗪化合物的影响。
在反应时间4 h、反应pH 9,考察反应温度(60、80、90、100 ℃和120 ℃)对Ala-2,3-BD反应体系生成烷基类吡嗪化合物的影响。
在反应时间2 h、反应温度60 ℃条件下,考察pH值(4.2、5、6、7、8和9)对Ala-2,3-BD反应体系生成烷基类吡嗪化合物的影响。
1.3.3 HPLC分析
参考课题组前期方法[31],并稍作改进。使用XBridge C18柱(4.6 mm×250 mm,5 μm)进行色谱分离,将样品(10 μL)注入HPLC系统。流动相A为乙腈,B为0.1%甲酸和0.1%三氟乙酸混合溶液。流速设置为1.0 mL/min,柱温为40 ℃,检测波长为275 nm。梯度洗脱程序见表1。
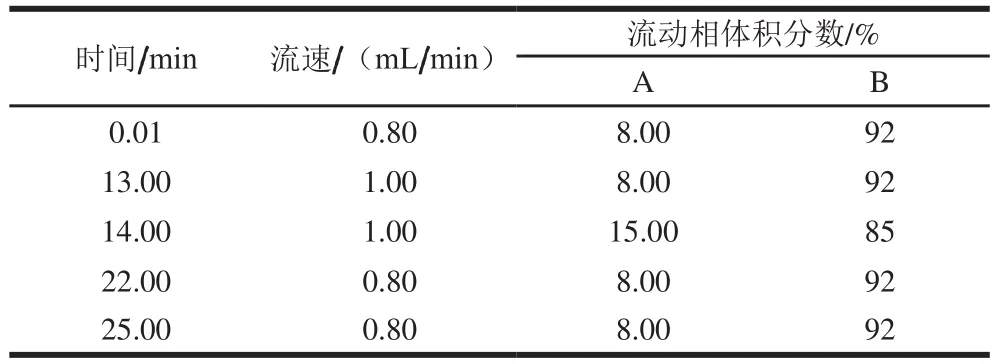
表1 HPLC梯度洗脱程序Table 1 HPLC gradient elution program
1.3.4 动力学模型
通过线性或非线性方程拟合将动力学模型转化为不同温度下的数学模型,并根据回归系数(R2)评估所建立模型的性能。根据零级和一级反应动力学的生成浓度(Ct,lnCt)相对于反应时间t(h)的线性回归得到烷基类吡嗪化合物的反应速率(k)。通过Arrhenius方程确定烷基类吡嗪化合物的表观活化能(Ea)。零级动力学、一级动力学、Arrhenius方程分别如式(1)~(3)所示:
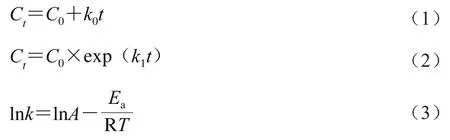
式中:Ct为烷基类吡嗪化合物浓度/(mmol/L);C0为反应初始浓度/(mmol/L);k、k0和k1为反应速率常数/(mmol/(L·h));A为指前因子/h-1;T为热力学温度/K;R为气体摩尔常数(8.314 J/(mol·K))。
1.4 数据处理
使用Origin 9.0软件(美国Origin Lab Corporation)进行线性回归分析和动力学常数计算。应用SPSS分析软件进行方差分析(ANOVA)和均值比较。P<0.05,差异显著,结果平行重复3 次,表示为。
2 结果与分析
2.1 烷基吡嗪化合物生成随反应时间变化的关系
Ala-2,3-BD反应体系中共检测了5 种甲基类吡嗪化合物:2,3-DMP、2,5-DMP、2,6-DMP、TriMP和TMP,其中2,3-DMP、2,5-DMP和2,6-DMP总概括为DMPs;3种乙基类吡嗪:EP、E-3-MP和E-5-MP。如图1所示,对于甲基类吡嗪而言,总含量随时间延长逐步累积(P<0.05),在反应前中段范围内(2~8 h)含量积聚变化幅度大,8 h后增速变化相对较为平缓。由图1A观察到,TriMP随反应时间变化趋势与总含量相似,反应10 h后含量趋于稳定(P>0.05)。DMPs反应8 h后含量增长也趋于平缓,其中2,6-DMP在体系反应中生成量最小,在2~12 h之间,质量浓度从1.28 mg/L上升至2.01 mg/L;2,5-DMP随时间的延长稳步增长,质量浓度最高达13.74 mg/mL;不同的是,2,3-DMP的增长速率在反应后段(12 h)含量略有下降。分子质量相同且共同具有2个甲基取代位点的2,3-DMP、2,5-DMP和2,6-DMP生成表现不同与其生成路径密切相关[32],在Yu Ainong等[23]研究中检出的甲基类吡嗪中2,5-DMP也具有较高的检出量。值得注意的是,TMP具有较大的占比,对总甲基类吡嗪化合物的贡献率高达39.3%~42.7%,并与反应时间延长呈正相关。Xiao Zijun等[30]研究指出乙偶姻是四甲基吡嗪的前体物质,并且课题组前期研究[33]也证实乙偶姻与四甲基吡嗪生成具有良好的正相关。2,3-BD作为乙偶姻的下游物质,本实验结果一定程度上也说明了以2,3-BD作为前体物质对TMP的生成具有一定优势性。总体而言,甲基类吡嗪化合物与反应时间具有良好的量效关系(P<0.05)。
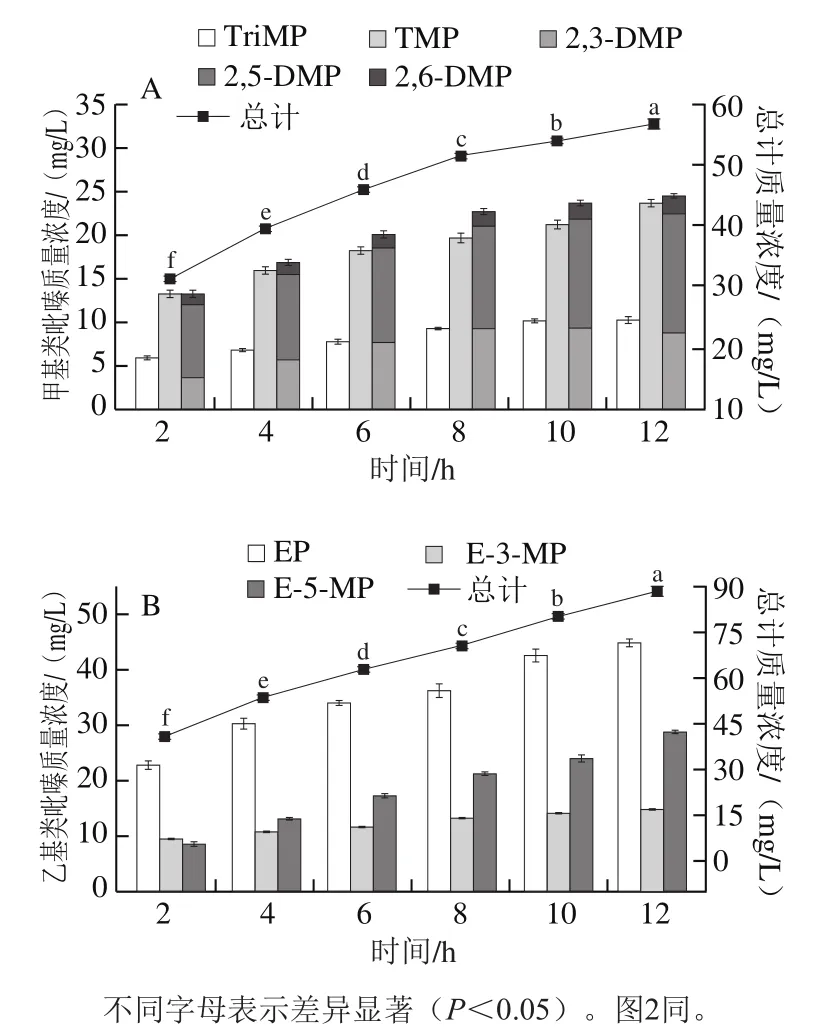
图1 Ala-2,3-BD反应体系中甲基类吡嗪(A)和乙基类吡嗪(B)化合物质量浓度随反应时间的变化Fig. 1 Relationship between methyl pyrazine (A) and ethyl pyrazine (B)concentrations and reaction time
如图1B所示,乙基类吡嗪化合物较甲基类吡嗪化合物总生成量大,且随时间的延长显著增加(P<0.05)。图1B中明显观察到EP具有较大的生成量。EP是吡嗪环的2-位经甲基单取代而来,Yu Ainong等[23]在L-抗坏血酸和L-谷氨酸反应体系研究中曾指出此类乙基吡嗪类化合物是来自抗坏血酸降解产生的丁二酮,与本实验结果具有共通性,2,3-BD为吡嗪类化合物生成直接创造了前体物质条件。反应时间的延长对EP和EP-5-MP都具有很大的促进作用,经12 h反应后的质量浓度最高,分别达到44.82 mg/L和28.72 mg/L。反应时间对EP-3-MP的作用不突出,EP-3-MP在整个时间范围内整体变化较为平缓,在2~12 h之间,质量浓度仅从9.53 mg/L上升至14.83 mg/L,但在短时反应下也具有一定生成比例因此可能其于体系反应的前段已积聚产生。
2.2 烷基吡嗪化合物生成随反应温度变化的关系
温度是美拉德反应中的关键调控因素[10]。如图2所示,在60~120 ℃,反应4 h,体系鉴定得到烷基吡嗪种类齐全且具有显著差异(P<0.05)。由图2A可知,甲基类吡嗪含量随温度变化显著(P<0.05),在100 ℃条件下总质量浓度达到最高值42.95 mg/L,随温度的递增含量出现了回落。TriMP、TMP和2,3-DMP随温度变化趋势均与总含量表现相似。其中TriMP和2,3-DMP在100 ℃温度范围内呈现上升趋势,且生成量达到最高分别为8.87 mg/L和6.89 mg/L。TMP生成表现略有差别,在90 ℃时达到最高生成量(15.84 mg/L)随后呈下降趋势,但在120 ℃条件下仍有22.6%的检出率,在所有甲基类吡嗪中具有较高的检出比例。由图2A明显观察到TMP和2,5-DMP产生量在体系中具有较高的占比,不同的是2,5-DMP在高温条件下(90~120 ℃)含量仍呈积聚现象。2,6-DMP随温度变化同2,5-DMP呈增加趋势,但积聚效果稍低。总体而言,甲基类吡嗪对温度具有较大敏感性,温度促进作用明显,在2,3-BD的反应体系下为吡嗪化合物的生成创造了更明确的前体条件,减少了前期副产物的生成,但与此同时,长时间过高温度的反应也加速了美拉德反应进程,推进物质的转化更多生成了如类黑精等物质,从而出现吡嗪类化合物含量降低现象[34]。
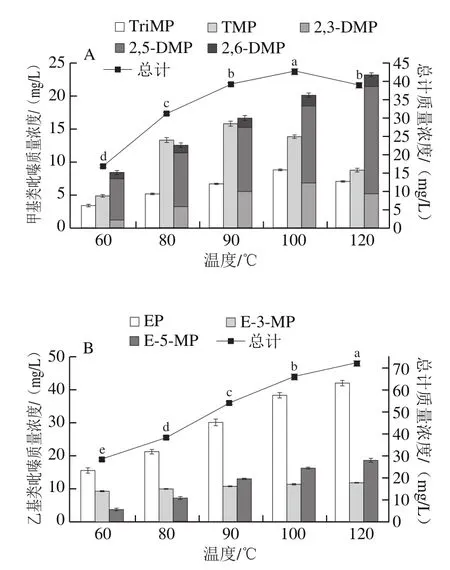
图2 Ala-2,3-BD反应体系中甲基类吡嗪(A)和乙基类吡嗪(B)化合物含量随反应温度的变化Fig. 2 Relationship betweenmethyl pyrazine (A) and ethyl pyrazine (B)concentrations and reaction temperature
如图2B所示,乙基类吡嗪化合物随温度变化呈现正相关性(P<0.05)。其中EP和E-5-MP随温度升高均呈较大幅度增加,最高质量浓度分别达到42.12 mg/L和18.64 mg/L。E-3-MP随温度变化最为平缓,60~120 ℃含量仅增加了27.8%,与时间变化趋势相同。但在低温条件下,E-5-MP在体系中的生成比例低于E-3-MP,说明E-5-MP的生成需要一定温度条件驱动才有利于激发。对体系中烷基类吡嗪总体而言,乙基类吡嗪化合物总质量浓度较甲基类吡嗪化合物质量浓度高33.32 mg/L,这主要归因于EP对总含量的贡献。在100 ℃条件下,EP占比高达58.20%。谭志伟等[35]建立的抗坏血酸-赖氨酸反应体系中,2,5-DMP、E-5-MP和E-3-MP随温度变化具有同样效果,进而分析高温有利于α-二羰基化合物发生缩合反应从而利于吡嗪的生成。不同取代基的吡嗪化合物随时间和温度的增加表现出不同的变化趋势这可能与复杂的美拉德反应进程,吡嗪化合物生成机理、反应速率密切相关[36]。
2.3 反应pH值对烷基吡嗪化合物生成影响

表2 pH值对Ala-2,3-BD反应体系中烷基类吡嗪化合物生成影响Table 2 Effect of pH on the formation of alkylpyrazines
在不同pH值反应体系溶液中进行8 种吡嗪化合物的生成鉴定。随着反应pH值的升高,吡嗪含量显著增加。由表2可知,当反应溶液pH值小于6时,除EP外体系中未检测出其他类吡嗪;当反应溶液pH值大于6时,吡嗪检出种类明显丰富且含量有所增加,与前人结论一致[22]。在pH 6的溶液中开始达到3种乙基类吡嗪检出的条件,但甲基类吡嗪仍有部分缺失。本研究中,在pH 8~9溶液中,目标烷基类吡嗪化合物得到完全检出,值得注意的是,仅TMP和E-3-MP含量上具有显著差异(P<0.05),但在pH 9时,吡嗪总质量分数显著增加至31.52 mg/L(P<0.05),与前期研究[21,37]发现一致趋势。结果证明,碱性条件下更有利于吡嗪化合物的生成,碱性条件下可能有利于促进氨基和羰氨的反应性,使美拉德反应发生更剧烈从而促进吡嗪的生成[20,37]。
2.4 动力学研究
相关研究表明[10],不同美拉德反应步骤对温度敏感性不同,它们可能不遵循相同的动力学模型。为更好地分析烷基类吡嗪化合物的生成,综合前面不同温度和时间的变化趋势,建立60~90 ℃范围内烷基类吡嗪形成的动力学模型,并用相关系数R2测量实验数据对模型的拟合优度。体系制备的Ala和2,3-BD的初始浓度均为0.1 mol/L。


图3 在60、80 ℃和90 ℃处理温度下Ala-2,3-BD反应体系6 种烷基吡嗪化合物动力学模型拟合Fig. 3 Kinetic models for the formation of six alkylpyrazines at reaction temperatures of 60, 80 and 90 ℃

表3 Ala-2,3-BD反应体系中6 种烷基吡嗪化合物动力学分析Table 3 Kinetic parameters for the formation of six alkylpyrazines
从图3、表3可以看出,反应温度越高,反应时间越长,产生的烷基类吡嗪也越多,这与前期研究具有一致性[34,38]。图3A显示DMPs的形成较好地拟合了一级动力学模型,速率常数k在60、80、90 ℃条件下分别为0.038 64、0.054 32、0.060 21 mmol/(L·h),并且R2均大于0.9。如图3B、C所示,在60 ℃条件下反应2 h,TriMP平均产量从0.020 19 mmol/L提高到0.084 03 mmol/L(120 ℃条件下反应12 h),TMP从0.018 53 mmol/L 提高到0.174 1 mmol/L,在不同时间下TMP随反应温度升高的浓度变化较TriMP高。与DMPs不同,具有3个甲基取代位点和4个甲基取代位点的TriMP和TMP生成均较好的符合零级动力学模型,与前期研究一致[38]。TriMP速率常数k在60、80、90 ℃时分别为0.002 92、0.003 70、0.004 32 mmol/(L·h);TMP分别为0.004 76、0.006 16、0.007 41 mmol/(L·h)。在各温度下的TMP生产反应速率常数均较TriMP大,说明在Ala-2,3-BD反应体系下TMP的产生较TriMP快。通过得到的反应速率将lnk相对于1/T作图,获得一条直线并根据Arrhenius方程使用该线的斜率计算表观活化能,y轴的截距等于lnA的值。由等式计算,DMPs表观活化能为15.161 3 kJ/mol,指前因子为9.277 9 h-1(表3)。TriMP和TMP具有与DMPs相近的表观活化能分别为12.880 3 kJ/mol和14.477 7 kJ/mol。Yu Hang等[38]在葡萄糖-甘氨酸模型体系中研究也指出2,5-DMP、TriMP和TMP三者在的表观活化能差异不大,具有差异的是,在本研究中观察到TMP较TriMP具有更高的表观活化能,这可能是由于反应前体的不同而表现出不同的积聚反应。
如图3D所示,EP的生成同DMPs遵循一级反应动力学,在不同时间下随温度的升高,EP表现出较高的生成量。在60 ℃条件下反应2 h,平均产量从0.098 18 mmol/L提高到0.414 49 mmol/L (120 ℃条件下反应12 h)。EP速率常数k分别为0.051 28、0.088 26、0.113 01 mmol/(L·h),相应R2值为0.975 4、0.995 8和0.961 4,具有较好地拟合效果,且具有最高的活化能(26.5036 kJ/mol)。此外2 种甲基取代的乙基类吡嗪化合物均遵循零级动力学模型(图3E和图3F),且具有较好的拟合效果(R2介于0.986 4~0.999 9之间)。EP-3-MP的速率常数k分别为0.003 27、0.004 06、0.004 53 mmol/(L·h);EP-5-MP分别为0.007 34、0.007 86、0.008 10 mmol/(L·h)。在体系整个反应过程中,EP-3-MP产量变化幅度较小,可能是该体系下EP-3-MP的生成较为稳定。相较于EP,EP-3-MP和EP-5-MP所需的活化能较低。其中EP-3-MP的表观活化能与甲基类吡嗪具有一定接近性,但较低于三者甲基类吡嗪,为10.872 1 kJ/mol;EP-5-MP的表观活化能为3.310 6 kJ/mol,是所有吡嗪中最低的,说明EP-5-MP的生成过程中具有较大的温度依赖性。
3 结 论
吡嗪的形成始于α-氨基酮,这是由氨基酸与二羰基化合物在美拉德反应中通过Strecker降解缩合而成的产物。在复杂的美拉德体系中吡嗪形成的作用途径不止一条,即使是一个非常简单的模型体系也能产生大量、种类繁多的烷基吡嗪。本实验建立Ala-2,3-BD美拉德反应体系,通过HPLC对2,3-DMP、2,5-DMP、2,6-DMP、TriMP、TMP、EP、E-3-MP和E-5-MP等烷基类吡嗪生成规律进行探讨。吡嗪的形成虽与氨基酸侧链无关,但不同氨基酸的反应性会决定不同吡嗪的形成程度,不同前体的选择将决定某种生成路线更占据优势性。α-二羰基化合物为吡嗪化合物的生成创造了更明确的前体物质。2,3-丁二酮为乙偶姻的下游物质,在该体系中检测到乙基类吡嗪相较于甲基类吡嗪具有更高的生成量,其中甲基类吡嗪中TMP和2,5-DMP生成量具有较高的占比;乙基类吡嗪中EP生成较为突出。总体而言,较高的反应温度和较长的反应时间有利于吡嗪类化合物的生成,但过长的时间以及过高温度加速了美拉德反应进程,推进物质的转化,可能更多生成了诸如类黑精等产物,从而在反应后段观察到TriMP、TMP和2,3-DMP出现含量降低的现象。烷基类吡嗪的形成具有碱催化效应,碱性条件下可能更有利于氨基和羰氨的反应性,使美拉德反应发生更剧烈从而促进吡嗪的生成,在pH 9的条件下吡嗪总量高达(31.52±1.35) mg/L。不同烷基吡嗪的生成过程中具有不同的生成速率,尽管烷基吡嗪在不同时间随温度变化生成浓度不同,但仍有部分吡嗪的生成动力学具有一定相似性。除DMPs和EP遵循一级动力学模型,其他吡嗪与零级动力学模型具有更好的拟合效果。3种甲基类吡嗪和乙基类吡嗪中的E-3-MP表观活化能具有一定相近性,此外E-5-MP所需的活化能最低,与吡嗪生成途径α-二羰基化合物缩合与氧化及其对温度敏感性密切相关。本研究结果为进一步明确吡嗪类化合物生成规律和反应机理提供参考。
