玉米醇溶蛋白-多酚相互作用及复合物制备与表征
2022-02-16梁宏闪赵靖昀代亚磊万楚筠
高 瑾,梁宏闪,赵靖昀,代亚磊,万楚筠,周 彬,*
(1. 湖北工业大学 发酵工程教育部重点实验室,湖北 武汉 430068;2.华中农业大学食品科学技术学院,湖北 武汉 430070;3.农业农村部油料加工重点实验室,湖北 武汉 430062)
食品体系是典型的蛋白质、多糖、多酚等复杂组分共存的软物质体系,这些分子之间可通过各种共价、非共价相互作用共同影响着食品的质构、营养及品质等,亦或是赋予食品体系中某单一组分所不具备的功能特性[1]。例如,蛋白质作为重要的食品组分,凭借其独特的界面特性和健康属性而倍受青睐,在食品体系(牛奶、蛋黄酱、冰淇淋、蛋白饮料等)中发挥乳化、发泡等功能[2-3]。然而并非所有的蛋白质均具有优异的界面特性。很多蛋白质需在较高的浓度水平下才能对界面起到稳定作用且其稳定性也是长期面临的技术难题[4-5]。更有甚者,某些蛋白质特殊的结构导致其亲水性或疏水性过强,因而不易在界面形成稳定牢固的界面膜[6]。
玉米醇溶蛋白作为典型的醇溶蛋白,主要存在于玉米胚乳中,是玉米制品加工过程中的主要副产物,具有特殊的氨基酸组成,分子中存在大量非极性氨基酸,仅能溶于60%~95%的醇类溶液、高浓度尿素溶液、强碱溶液等[7]。这种苛刻的溶解条件极大地限制了其应用范围。由于它具有强疏水性,故可以利用简易的反溶剂法制备胶体颗粒用于食品、医药等领域,从而引起学者的广泛关注。但是单独的玉米醇溶蛋白胶粒也正是因为其强疏水性导致其界面稳定性较差[8]。然而已有研究发现玉米醇溶蛋白与单宁酸(tannic acid,TA)通过非共价相互作用之后制备得到的复合纳米胶粒相比于单纯的玉米醇溶蛋白胶粒的界面稳定性显著提高,可在油水界面形成连续的界面网络结构[9]。又如小麦醇溶蛋白与TA非共价结合不仅可提高小麦醇溶蛋白胶体颗粒的稳定性,亦可增加其稳定的Pickering乳液的贮藏稳定性[10]。除此之外,多酚作为食品中常见的功能性化合物,广泛存在于植物组织中,具有良好的抗氧化、抗菌、抗肿瘤等功能特性[11-12]。其丰富的酚羟基可通过静电相互作用、氢键、疏水相互作用等非共价键与食品中蛋白质形成复合物,进而改变蛋白质的营养与功能特性[13]。但不同结构的多酚对于同种蛋白的影响迥异。例如,TA、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、没食子酸(gallic acid,GA)含有不同数量的邻苯三酚结构单元,它们对于玉米醇溶蛋白胶粒界面特性的影响有巨大的差异。故而探究不同结构多酚与玉米醇溶蛋白相互作用的差异,有助于解析多酚对玉米醇溶蛋白功能特性的影响机制,并对食品的结构化设计及新型食品配料的开发与利用提供理论指导。
本实验基于以往研究报道及团队前期研究结果[14-15],选取玉米醇溶蛋白与含有不同数量邻三元酚结构单元的多酚(TA、EGCG、GA)为研究对象,采用荧光光谱、紫外-可见光谱等技术手段解析3种多酚与玉米醇溶蛋白之间的相互作用,探讨多酚结构与二者比例对玉米醇溶蛋白-多酚胶体粒子微观结构及表面特性的影响,并研究玉米醇溶蛋白-多酚复合体系的抗氧化特性。该工作的开展有助于关联其形成的复合物在食品体系的物理化学性质,为复合物在食品配方中的优化提供科学依据,扩展蛋白质与多酚及其复合物在食品等工业领域的应用前景。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白 日本东京化学工业有限公司;TA、EGCG、1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海阿拉丁生化科技股份有限公司;GA 上海源叶生物有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
F-7000荧光分光光度计 日本日立公司;UV-2600紫外-可见分光光度计 苏州岛津仪器有限公司;Nicoletis-50傅里叶变换红外光谱仪 赛默飞世尔科技(中国)有限公司;FESEMs-4800扫描电子显微镜 日本Hitachi公司;DSC1差示扫描量热仪 瑞士梅特勒-托利多有限公司。
1.3 方法
1.3.1 玉米醇溶蛋白-多酚复合物的制备
玉米醇溶蛋白与TA、EGCG、GA的非共价复合物的制备过程参考相关研究方法[15]。将玉米醇溶蛋白及TA、EGCG、GA溶于70%乙醇溶液中,玉米醇溶蛋白母液质量浓度为0.5 mg/mL,TA、EGCG、GA母液质量浓度均为1 mg/mL。依次取不同体积的多酚溶液于10 mL玉米醇溶蛋白母液当中,不调节其溶液pH值,在室温条件下搅拌1 min,所得溶液为非共价复合物溶液。添加TA、EGCG、GA体积分别为0、25、50、75、150、200、300、400 μL。
1.3.2 荧光光谱分析
1.3.2.1 荧光光谱的测定
利用荧光分光光度计获得3种温度(25、30 ℃和35 ℃)下的玉米醇溶蛋白及其复合物的内源荧光图谱[16]。玉米醇溶蛋白的质量浓度固定为0.5 mg/mL,激发波长设置为280 nm,发射波长为300~500 nm,激发狭缝宽为10 nm,发射狭缝宽为5 nm。
1.3.2.2 荧光猝灭类型分析
利用Stern-Volmer方程对荧光数据进行分析,以验证其猝灭类型[17]。如式(1)所示:
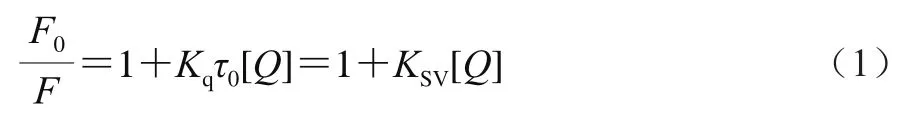
式中:F为有猝灭剂时玉米醇溶蛋白的荧光强度;F0为无猝灭剂时玉米醇溶蛋白的荧光强度;Kq为速率常数;τ0为无猝灭剂时生物大分子的平均荧光寿命,取其值为10-8s;[Q]为猝灭剂浓度;Ksv为Stern-Volmer猝灭常数。
1.3.2.3 结合位点及结合常数
玉米醇溶蛋白与TA、EGCG、GA的结合位点及结合常数[17]按式(2)计算:
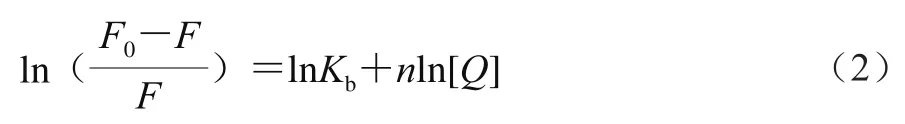
式中:Kb为结合常数;n为结合位点数。
1.3.2.4 热力学参数
按式(3)、(4)[17]计算热力学参数:

式中:R为气体常数,约为8.314 J/(mol·K);T为实验温度/K;Kb为与温度T对应的结合常数;ΔG为吉布斯自由能/(kJ/mol);ΔH为焓变/(kJ/mol);ΔS为熵变/(J/(mol·K))。
1.3.3 紫外-可见光吸收光谱
采用紫外-可见分光光度法测定玉米醇溶蛋白及其复合物的紫外-可见吸收光谱。固定玉米醇溶蛋白质量浓度为0.5 mg/mL,将样品置于光程为1 cm的比色皿中进行扫描。扫描范围为190 ~500 nm[10]。
1.3.4 玉米醇溶蛋白与多酚复合纳米颗粒的制备
将玉米醇溶蛋白与多酚同时溶于70%乙醇溶液中,利用反溶剂法制备复合纳米颗粒[9]。即将1 mL复合溶液快速加入到9 mL水溶液中,所制备的复合溶液中玉米醇溶蛋白终质量浓度为1 mg/mL,多酚终浓度分别为0.25、0.50、1.00、2.00、3.00 mmol/L。
1.3.5 玉米醇溶蛋白与多酚复合纳米颗粒的外观形貌及浊度
利用紫外-可见光分光光度计测量复合纳米颗粒溶液在波长600 nm处的吸光度,按式(5)换算得到溶液的透光率,以溶液透光率表示样品浊度[18]。

式中:T为透光率/%;A为吸光度。
1.3.6 玉米醇溶蛋白与多酚复合纳米颗粒表征
利用纳米粒度及电位分析仪检测玉米醇溶蛋白与多酚复合纳米颗粒的粒径及电位[9]。
1.3.7 玉米醇溶蛋白与多酚复合纳米颗粒的微观结构
使用扫描电子显微镜观察复合颗粒的微观结构[9]。取少量样品均匀铺展在锡箔纸表面,粘贴于双面导电胶上,喷金。在放大倍数为10 000条件下观察。
1.3.8 玉米醇溶蛋白与多酚复合物热稳定性分析
取4 mg玉米醇溶蛋白-多酚复合物样品于坩埚中密封,以密封的空坩埚作为空白对照,测试温度范围为25~150 ℃,升温速率为10 ℃/min,氮气流速为30 mL/min。
1.3.9 玉米醇溶蛋白与多酚复合物抗氧化性分析
1.3.9.1 DPPH自由基清除活性
配制1 mmol/L的DPPH-乙醇溶液,避光搅拌1 h使其充分溶解,4 ℃贮藏备用。实验中固定玉米醇溶蛋白质量浓度为0.5 mg/mL,在10 mL玉米醇溶蛋白溶液中添加400 μL多酚溶液(1 mg/mL)得到复合物备用。取200 μL复合物样品与3.8 mL DPPH-乙醇溶液(0.1 mmol/L)混合30 s后,避光反应1 h,利用紫外-可见分光光度计,测定其在波长517 nm处的吸光度,DPPH自由基清除率按式(6)[10]计算:
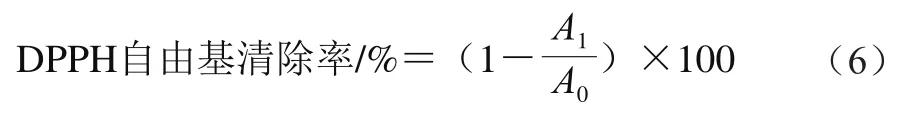
式中:A1为样品吸光度;A0为空白对照吸光度。
1.3.9.2 ABTS阳离子自由基清除活性
将7 mmol/L的2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)-乙醇溶液和2.45 mmol/L的过硫酸钾溶液等体积混合,在室温避光条件下反应12 h后作为ABTS母液备用。将ABTS母液用无水乙醇稀释至其在734 nm波长处吸光度为0.7±0.02,以此作为工作液。实验中固定玉米醇溶蛋白质量浓度为0.5 mg/mL,在10 mL玉米醇溶蛋白溶液中添加400 μL多酚溶液(1 mg/mL)得到复合物备用。取100 mL复合物样品与3.9 mL ABTS工作液混合30 s后,避光反应8 min,利用紫外-可见分光光度计测定其在波长734 nm处的吸光度,ABTS阳离子自由基清除率按式(7)[10]计算:

式中:A1为样品吸光度;A0为空白对照吸光度。
1.4 数据处理
2 结果与分析
2.1 荧光光谱分析
由图1可知,玉米醇溶蛋白的最大发射波长为304 nm,主要是由玉米醇溶蛋白的酪氨酸残基产生[19]。当复合体系中3种多酚的含量逐渐增加时,玉米醇溶蛋白的内源荧光强度逐渐降低,最大发射波长发生红移,表明两者之间发生了相互作用,这可能是由于玉米醇溶蛋白与多酚之间发生荧光猝灭,蛋白分子三级结构舒展,同时多酚的芳香环可与玉米醇溶蛋白的酪氨酸残基结合,芳香族氨基酸残基微环境的疏水性降低,致使玉米醇溶蛋白的内源荧光猝灭。此外,对比3种不同结构的多酚可知,TA致使玉米醇溶蛋白荧光强度下降幅度最大,其次为GA,最后为EGCG,这可能是TA分子质量较大,与玉米醇溶蛋白的亲和力更强,且TA的酚羟基含量较多,与玉米醇溶蛋白结合强度大于另外2 种多酚[20]。

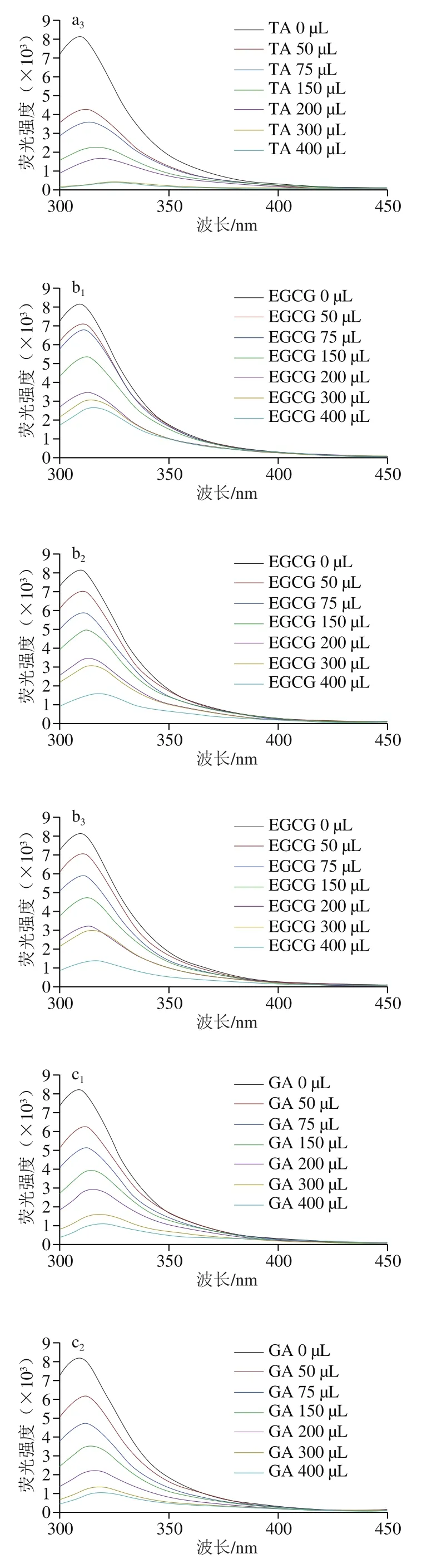
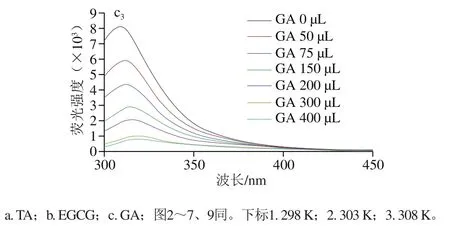
图1 玉米醇溶蛋白与3种多酚非共价复合物荧光发射图谱Fig. 1 Fluorescence emission spectra of non-covalent complexes of zein and three polyphenols
2.2 荧光猝灭类型分析
当蛋白质作为荧光基团,多酚作为猝灭剂时,蛋白质的荧光猝灭可分为2 种类型:一是为静态猝灭,即为蛋白与多酚形成非荧光络合物,二是为动态猝灭,蛋白质与多酚发生动态碰撞使荧光猝灭[21]。在图1中,随着复合体系温度的升高,玉米醇溶蛋白的内源荧光均出现降低趋势,表明温度对玉米醇溶蛋白与多酚的结合有明显的影响,可以利用Stern-Volmer方程,进一步分析荧光猝灭类型。由图2可知,3种多酚与玉米醇溶蛋白间的Stern-Volmer猝灭常数KSV及速率猝灭常数Kq(Kq=KSV/τ0)。如表1所示,在25、30 ℃和35 ℃三个温度下,3种多酚的猝灭常数KSV逐渐增大,玉米醇溶蛋白与TA在不同温度下的Kq分别为3.27×1013(25 ℃)、3.31×1013(30 ℃)、3.33×1013L/(mol·s)(35 ℃);玉米醇溶蛋白与EGCG复合体系的Kq分别为0.17×1013(25 ℃)、0.18×1013(30 ℃)、0.20×1013L/(mol·s)(35 ℃);玉米醇溶蛋白与GA复合体系的Kq分别为0.15×1013(25 ℃)、0.18×1013(30 ℃)、0.22×1013L/(mol·s)(35 ℃),3种多酚与玉米醇溶蛋白结合形成复合物的速率猝灭常数均大于动态猝灭中的最大碰撞猝灭常数2.0×1010L/(mol·s),此结果与荧光图谱最大波长红移结果一致。一般情况下动态猝灭只是影响猝灭分子的激发态,而不会改变猝灭物质的吸收光谱[22],因此在3种多酚与玉米醇溶蛋白的猝灭机制中均为静态猝灭占主导地位,多酚与玉米醇溶蛋白之间形成复合物。
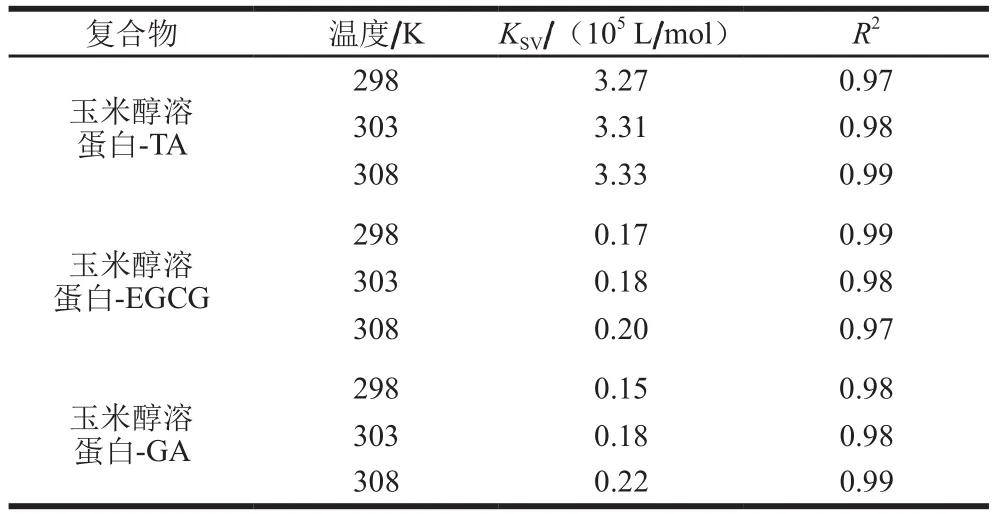
表1 不同温度下3种结构多酚对玉米醇溶蛋白的Stern-Volmer猝灭常数Table 1 Stern-Volmer quenching constants of three polyphenols for zein at different temperatures

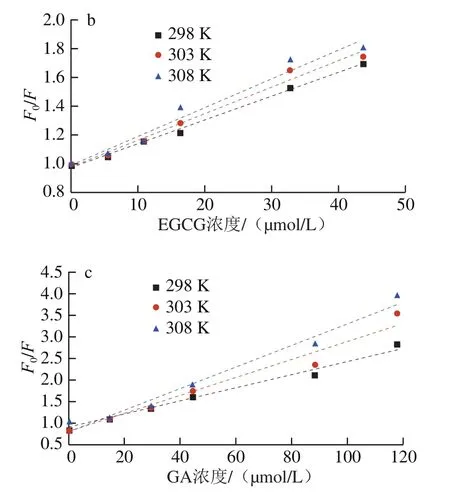
图2 玉米醇溶蛋白与3种多酚非共价复合物的Stern-Volmer曲线Fig. 2 Stern-Volmer curves of non-covalent complexes of zein and three polyphenols
2.3 结合位点及结合常数
玉米醇溶蛋白与多酚的结合常数及结合位点可根据荧光强度ln(F0-F)/F对lnC的线性关系(图3)求得。如表2所示,玉米醇溶蛋白与多酚的结合常数在107L/mol左右,表明两者之间能形成稳定的复合物。随着复合体系温度的升高,玉米醇溶蛋白与TA及EGCG结合常数逐渐降低,表明玉米醇溶蛋白与TA及EGCG是通过氢键结合,发生放热反应,而玉米醇溶蛋白与GA结合常数逐渐升高,表明玉米醇溶蛋白与GA是通过疏水相互作用结合,为吸热反应,在Cheng Jing等[23]的报道中同样发现β-乳球蛋白与花青素-3-O-糖苷的结合主要通过疏水相互作用,并且它们之间的结合过程为放热。由表2可知,玉米醇溶蛋白与3种多酚的结合位点数值(n)在1左右,表明蛋白质与多酚大约是按照1∶1的物质的量比结合。从25~35 ℃,玉米醇溶蛋白与TA结合位点下降幅度最大,表明温度对玉米醇溶蛋白与TA结合形成复合物的稳定性影响最大,这可能是由于升温破坏玉米醇溶蛋白与TA非共价相互作用。
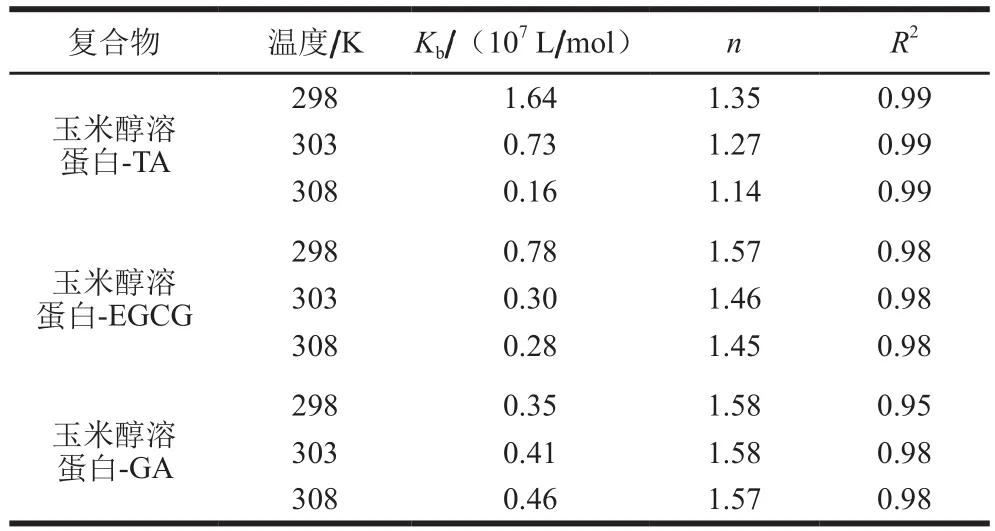
表2 不同温度下3种多酚与玉米醇溶蛋白相互作用的结合常数及结合位点Table 2 Binding constants and number of binding sites of three polyphenols to zein at different temperatures
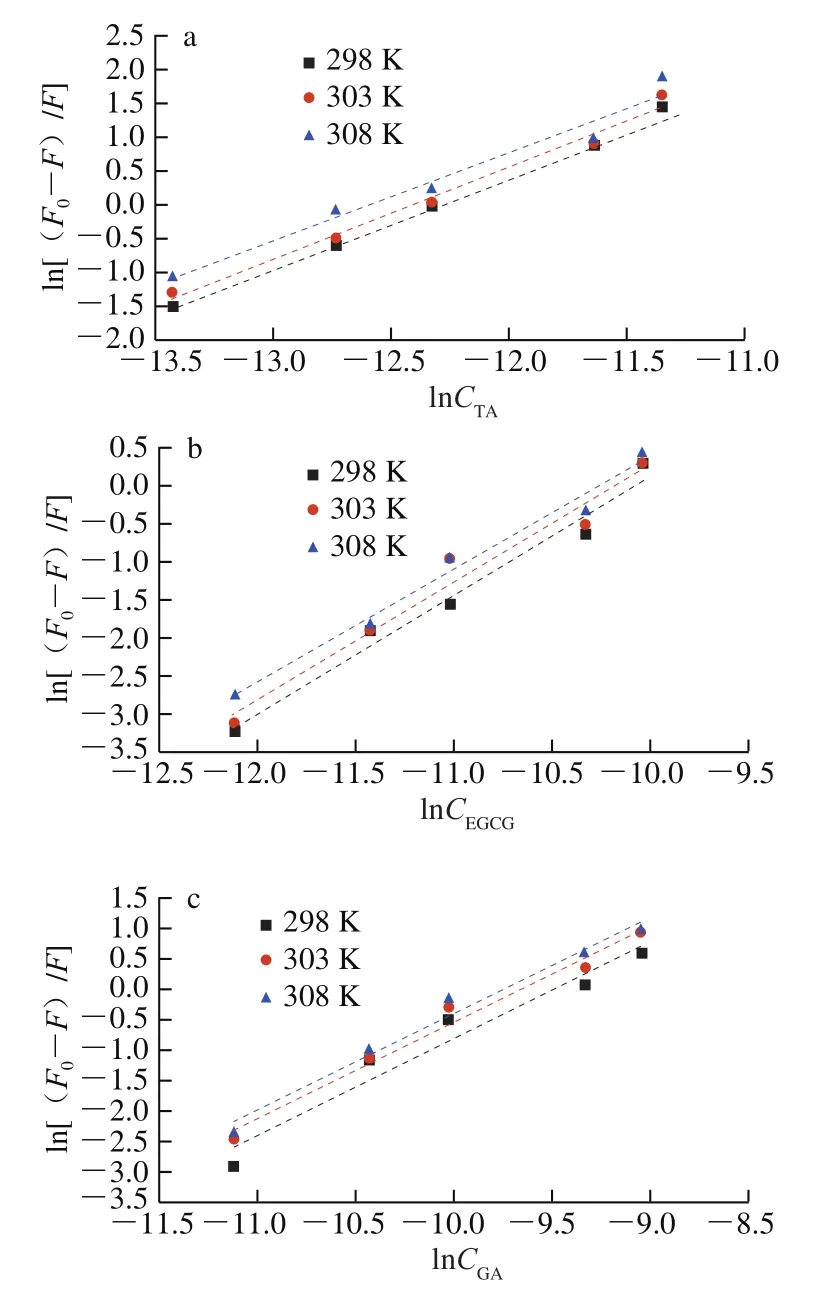
图3 3种多酚与玉米醇溶蛋白相互作用的双对数曲线Fig. 3 Double logarithmic plots of the interactions between three polyphenols and zein
2.4 热力学参数
通过Van’t Hoff公式计算可得到相应的热力学参数,从而进一步判断蛋白与多酚间的相互作用力类型。一般氢键及范德华力作用体系ΔH<0、ΔS<0,疏水作用力的体系ΔH>0、ΔS>0,静电相互作用的体系ΔH≈0、ΔS>0[24-25]。根据图4及表3可知,3种多酚与玉米醇溶蛋白结合形成复合物后,其ΔG<0,表明两者之间的反应均为自发反应,玉米醇溶蛋白与TA及EGCG结合过程均为放热反应,升高温度不利于两者之间的有效结合,而玉米醇溶蛋白与GA结合过程为吸热反应,升温有利于两者间结合。玉米醇溶蛋白与TA及EGCG结合过程中ΔH<0、ΔS<0,表明两者之间作用力主要是氢键相互作用,玉米醇溶蛋白与GA结合过程中ΔH>0、ΔS>0,表明两者之间作用力主要是疏水相互作用。
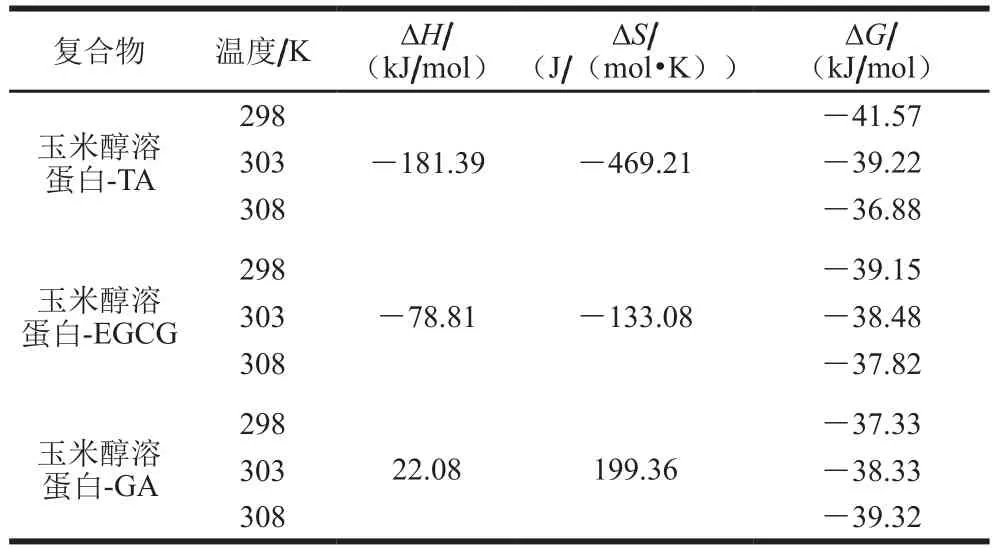
表3 3种多酚与玉米醇溶蛋白复合物在不同温度下相互作用的热力学参数Table 3 Thermodynamic parameters of the interactions between three polyphenols and zein at different temperatures
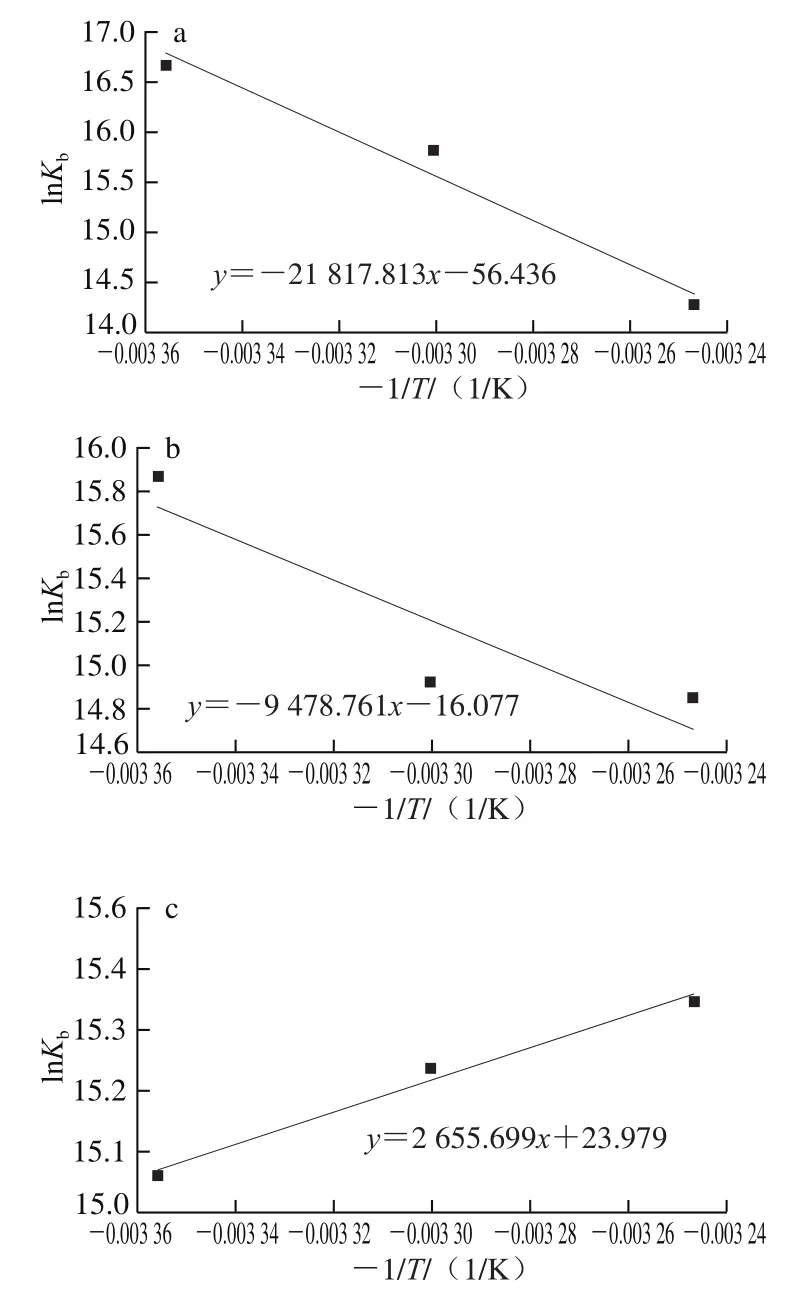
图4 3种多酚与玉米醇溶蛋白在不同温度下相互作用的热力学参数Fig. 4 Thermodynamic parameters of the interactions between three polyphenols and zein at different temperatures
2.5 紫外光谱的测定
如图5所示,玉米醇溶蛋白在波长210 nm及278 nm处均存在一个明显的吸收峰,其中在波长210 nm处的吸收峰主要由玉米醇溶蛋白的多肽骨架结构C=O产生,波长278 nm处的吸收峰由蛋白质中含共轭双键的酪氨酸和色氨酸等芳香族氨基酸残基产生[15,22]。在玉米醇溶蛋白醇溶体系引入多酚后,在波长280 nm处的吸光度增大,且随着多酚添加量的增加,峰值呈上升趋势且发生轻微蓝移。吸光度的这种变化表明多酚的加入改变了蛋白质发色团周围的微环境,玉米醇溶蛋白分子中的色氨酸和酪氨酸残基中的芳香杂环疏水基团暴露[26]。结果表明玉米醇溶蛋白与多酚在醇溶体系存在相互作用,且多酚的引入可改变玉米醇溶蛋白的三级结构。此外,在图5中玉米醇溶蛋白与EGCG在波长280 nm左右的紫外吸收峰强度明显低于玉米醇溶蛋白与TA及GA的吸收峰,这可能是EGCG的分子质量较小,所含酚羟基数量较TA少,且分子刚性较强,导致其不易与蛋白质分子结合。而在相同的质量浓度条件下,GA可与玉米醇溶蛋白结合的分子数量比EGCG多,相互作用较强。

图5 3种结构多酚与玉米醇溶蛋白相互作用复合物的紫外光谱图Fig. 5 UV spectra of complexes of three polyphenols with zein
2.6 玉米醇溶蛋白与多酚复合胶体颗粒的外观形貌及浊度
如图6所示,玉米醇溶蛋白与多酚复合胶体颗粒溶液呈现淡蓝色,这可能是由于玉米醇溶蛋白独特分子结构及自组装特性[27]。在图6a中,随着TA浓度的增加,样品溶液颜色逐渐加深,样品透光率由96.82%逐渐下降到30.25%,表明样品浊度逐渐增加,出现这一现象可能是由于较多的TA与玉米醇溶蛋白发生相互作用导致复合颗粒粒径发生变化或颗粒发生聚集[27],而在图6b和6c中,样品溶液的浊度并未发生明显改变,这可能是由于在相同物质的量下,EGCG及GA的分子质量较小,玉米醇溶蛋白与其结合并未在宏观条件下发生明显变化。从3种多酚与玉米醇溶蛋白结合形成复合物浊度的研究结果可知,玉米醇溶蛋白与TA发生非共价相互形成复合物且结合强度大于另外2 种多酚。多酚的结构及分子质量是影响玉米醇溶蛋白与多酚结合的主要因素,对比于另外2 种多酚,TA相对分子质量为1 701.2,所含酚羟基数量较多,且具有更大的分子柔性,因此更易与玉米醇溶蛋白形成复合物。

图6 玉米醇溶蛋白与多酚复合胶体颗粒外观形貌及浊度Fig. 6 Appearance and turbidity of zein and polyphenol composite colloidal particles
2.7 玉米醇溶蛋白与多酚复合胶体颗粒粒径、电位及微观结构
由图7a可知,随着TA的引入,复合胶粒的粒径明显大于玉米醇溶蛋白自组装形成的颗粒粒径(56.94 nm),并且随着TA浓度的增加,复合胶体颗粒的粒径由58.45 nm逐渐增大291.56 nm,电位绝对值由15.40 mV逐渐增大到18.33 mV(图7b)。结果表明玉米醇溶蛋白与TA通过非共价结合发生相互作用,这可能是由于TA浓度增大使复合体系的pH值降低,玉米醇溶蛋白远离等电点带正电,玉米醇溶蛋白的表面电荷增加,从而使胶粒间的静电排斥作用增强。由图7c、d可知,EGCG的添加可使复合胶粒颗粒的粒径减小,并且随着EGCG浓度的增加,粒径及电位均呈现降低趋势。EGCG为多合配体,其不同的酚基可与玉米醇溶蛋白的不同位点相结合导致玉米醇溶蛋白粒径减小,表面电荷降低,静电排斥作用减弱。在图7e、f中,GA与玉米醇溶蛋白结合后,复合颗粒的粒径随GA浓度的增加呈先增大后减小,电位呈现先减小后增大的趋势。

图7 玉米醇溶蛋白与多酚复合胶体颗粒粒径、PDI及电位Fig. 7 Particle sizes, polydisperse indexes and potentials of zein and polyphenol composite colloidal particles
由纳米颗粒微观形貌图(图8)可知玉米醇溶蛋白与多酚复合胶粒颗粒为粒径较小且分散性较好的球形粒子,此结果与其水溶液的多分散相指数(polymer dispersity index,PDI)结果一致。随着TA浓度的增加,纳米粒子间的交联作用逐渐增大,而玉米醇溶蛋白与EGGC及GA的胶体颗粒并未出现明显的交联现象,这可能是由于TA所含酚羟基数量较多且分子具有一定的柔性,可视为一种多位点交联剂,而EGCG分子质量较小,虽然也具有一定的分子柔性,但其交联作用弱于TA。GA苯环分子结构上具有3个酚羟基,但是其结构整体刚性较强,且其中的空间位阻有碍于玉米醇溶蛋白与其通过非共价相互作用结合,因此GA不易与玉米醇溶蛋白发生交联形成复合物[28]。

图8 玉米醇溶蛋白与多酚复合胶体颗粒微观结构Fig. 8 Microstructure of zein and polyphenol composite colloidal particles
2.8 玉米醇溶蛋白与多酚复合物热稳定性
通过差示扫描量热法可以了解多酚与玉米醇溶蛋白结合后对蛋白质热稳定性的影响。由图9可知,玉米醇溶蛋白在72.05 ℃出现代表蛋白质热变性温度的一个吸热峰,并且玉米醇溶蛋白与多酚结合后蛋白质的变性温度逐渐增大,表明多酚的引入会提高蛋白质的热稳定性。其中TA与玉米醇溶蛋白结合使蛋白质的热变性温度提高了22.36 ℃,明显高于另外2 种多酚(EGCG与玉米醇溶蛋白结合热变性温度提高了11.35 ℃;GA与玉米醇溶蛋白结合热变性温度提高了14.40 ℃),这可能是TA与玉米醇溶蛋白发生了较强的相互作用使蛋白质的结构发生改变,从而提高了蛋白质的热变性温度。
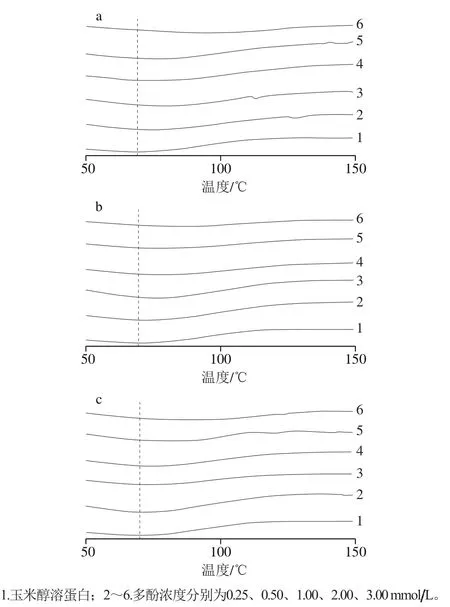
图9 玉米醇溶蛋白及其与3种多酚复合物的热稳定性Fig. 9 Thermal stability of zein and complexes of three polyphenols with zein
2.9 玉米醇溶蛋白与多酚复合物抗氧化性分析
由图10可知,玉米醇溶蛋白本身不具备抗氧化活性,随着多酚的添加,玉米醇溶蛋白与多酚形成复合物,使其具备一定的抗氧化活性,然而多酚本身的抗氧化活性受到抑制[10],这是由于玉米醇溶蛋白通过反溶剂法形成胶粒,多酚的部分酚羟基被包覆于胶体内部不能与自由基结合,同时,已有部分酚羟基与蛋白发生相互作用,降低了其与自由基碰撞的几率,导致玉米醇溶蛋白-多酚复合物的抗氧化性低于游离多酚[29]。玉米醇溶蛋白与GA形成复合物对ABTS阳离子自由基清除率高于另外2 种多酚,这可能是由于GA与玉米醇溶蛋白结合较弱,水溶液中存在更多的游离GA,样品溶液表现为更强的抗氧化能力。复合物的抗氧化活性增加可使后期研究玉米醇溶蛋白与多酚复合胶体颗粒稳定的Pickering乳液的抗氧化性得到提高,延长其保质期。
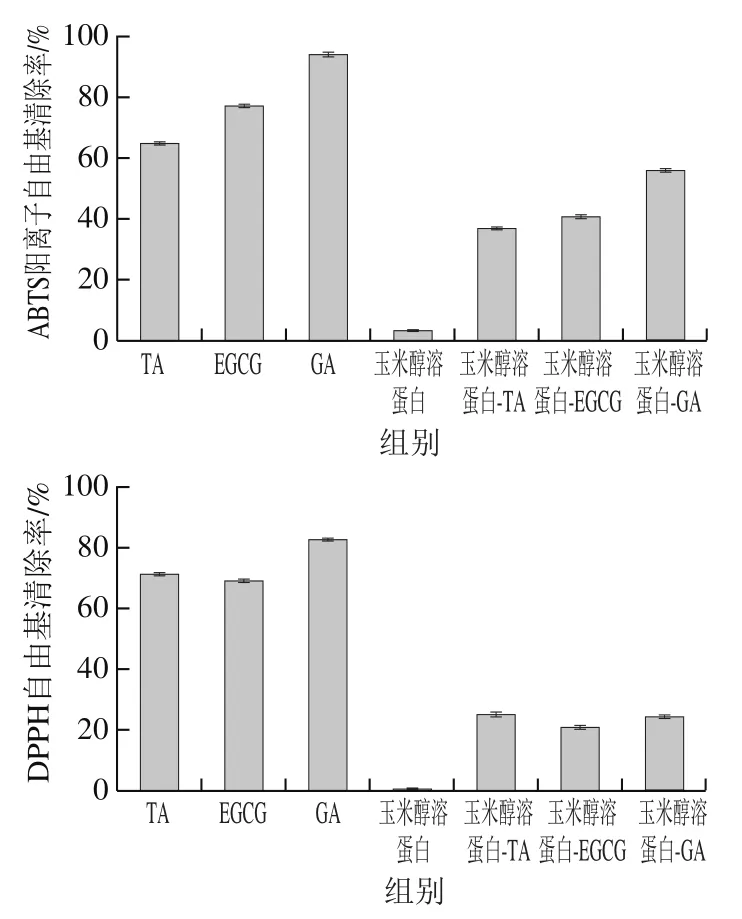
图10 玉米醇溶蛋白及其与3种多酚复合物的抗氧化性Fig. 10 Antioxidant activity of zein and complexes of three polyphenols with zein
3 结 论
本研究利用简单方法使玉米醇溶蛋白与多酚通过非共价相互作用方式形成复合物,对比3种含有不同数量邻三元酚结构单元的多酚对蛋白质物理化学性质及玉米醇溶蛋白胶体颗粒表面特性的影响。结果表明多酚引入可与玉米醇溶蛋白酪氨酸残基结合使蛋白质荧光猝灭,玉米醇溶蛋白与3种多酚可通过氢键及疏水相互作用以物质的量比为1∶1结合形成复合物,相互作用均为自发反应(ΔG<0),从而改变蛋白质的二级结构及三级结构,显著提高蛋白质的抗氧化性。玉米醇溶蛋白与TA相互作用后可使玉米醇溶蛋白胶粒的粒径增大,粒子间能形成交联作用,而玉米醇溶蛋白与EGCG及GA之间的结合较弱,其分子质量及分子结构对玉米醇溶蛋白胶体颗粒的表面特性影响较小,此研究结果对玉米醇溶蛋白及多酚在食品体系的开发和利用增加了新的可能性。
