赖氨酸对冷冻损伤肌原纤维蛋白凝胶性能的影响
2022-02-16韩馨蕊李朝蕊李保玲曹云刚熊幼翎
韩馨蕊,李朝蕊,范 鑫,李保玲,曹云刚,*,熊幼翎*
(1.陕西科技大学食品与生物工程学院,陕西 西安 710021;2.肯塔基大学动物与食品科学系,美国 肯塔基 列克星顿 40546)
肉制品加工业是我国食品加工业的重要组成部分。原料肉的保藏方法有很多,冷冻是目前应用最广、效果最好、最经济、最安全的保藏方法[1]。肉经冷冻处理可以抑制肉中微生物的生长、钝化酶的活性、减少脂肪及蛋白的氧化[2-3]。然而冷冻会因大冰晶的形成破坏细胞结构,导致蛋白质分子原有的高级空间结构遭到破坏,因而长期冷冻储藏原料肉的一个显著变化为其主要功能性蛋白——肌原纤维蛋白(myofibrillar protein,MP)的损伤变性,主要表现为溶解度及凝胶性能下降,最终影响产品品质及得率[4-6]。现有研究主要是通过革新冷冻及解冻方法或添加抗冻剂等手段降低原料肉由于冷冻解冻等过程导致的蛋白损伤,但存在效果有限或者由于技术不成熟、成本高昂等原因尚不能大范围应用推广等实际问题。实际情况是作为企业主要加工原料的冷冻肉很大一部分已经发生了冷冻损伤。因此,有效修复已损伤蛋白的功能特性具有非常重要的理论与应用价值。
赖氨酸(L-lysine,L-Lys)是一种碱性氨基酸,广泛存在于豆类植物和酪蛋白等蛋白的水解物中,具有安全性高、成本低等特点,在肉制品加工领域具有潜在的应用前景。Fu Yuan等[7]研究发现L-Lys的添加可以改变肌球蛋白分子粒径及分布以及凝胶分子间作用力,从而影响凝胶的持水性和硬度。Lei Zhen等[8]研究发现添加L-Lys增加了鸡胸肉肌动球蛋白表面疏水残基和活性巯基的数量,进而提高了凝胶硬度及持水性。Wang Yaosong等[9]研究发现添加L-Lys可以促进乳清蛋白形成均一、多孔的热诱导凝胶。Gao Ruichang等[10]研究发现添加L-His能显著提高天然肌球蛋白在低/高离子强度溶液中的溶解度。Zhou Cunliu等[11]发现,添加L-Lys使得猪肉肠具有更好的色泽,并且提高了其持水性和质构特性(硬度、弹性、咀嚼性)。基于以上研究,推测添加L-Lys有望改善冷冻损伤MP的溶解度和凝胶性能,但相关研究鲜见报道。因此,本实验通过构建反复冻融体系获得冷冻损伤原料肉,提取冷冻损伤MP后,研究不同浓度L-Lys(0、1、3、5 mmol/L和10 mmol/L)对冷冻损伤MP结构、溶解度、流变学特性、凝胶质构及微观结构的影响及其内在机制,以期为L-Lys作为品质改良剂在肉制品中的应用提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
猪外脊肉(longissimus lumborum),购于陕西西安市未央区润家超市,置于冰盒中运回实验室,剔除可见脂肪组织后,垂直于肌纤维走向切成100 g左右的肉排,采用聚乙烯袋真空包装,备用。
L-Lys 源叶生物科技有限公司;乙二醇双(2-氨基乙基醚)四乙酸(glycol-bis-(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA) 生工生物工程(上海)股份有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
HR/T20MM立式高速冷冻离心机 湖南赫西仪器装备有限公司;UV2900紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;PHS-25型数显pH计 上海仪电科学仪器股份有限公司;TA.Plus物性测试仪 英国Stable Micro System公司;Fluoro Max-4荧光分光光度计日本Horiba公司;CM-5分光测色计 柯尼卡美能达(中国)投资有限公司;Mastersizer 2000激光粒度分析仪 英国Malvern Instruments有限公司;Haake-Mars 60流变仪、DXR2显微共聚焦拉曼光谱仪 德国Thermo Fisher Scientific公司;FEI Q45+EDAX Octane Prime环境扫描电子显微镜 美国FEI公司;圆二色光谱仪 英国Applied Photophysics公司。
1.3 方法
1.3.1 冷冻损伤原料肉的制备
参照Xia Xiufang等[12]的方法进行冷冻损伤原料肉的处理:将分装好的新鲜原料肉随机分为两组;一组置于-18 ℃的冰箱作为空白进行相关指标的测定;另一组进行冷冻-解冻循环处理:将新鲜肉置于-18 ℃冷冻,3 d后取出,在室温下用自来水进行解冻直到肉样中心温度达到0~2 ℃后,即完成第1次冷冻-解冻过程,重复上述步骤3 次后进行相关指标的测定。
1.3.2 MP的提取
参照Park等[13]的方法进行。将不同处理样品肉在流水下进行解冻后,用刀切成若干小条称量,放置于组织捣碎机中,加入4 倍体积的僵直液(0.1 mol/L NaCl、2 mmol/L MgCl2、10 mmol/L Na2HPO4、1 mmol/L EGTA,pH 7.0),进行匀浆捣碎(15 s,4 次),4 ℃、2 000×g离心15 min后弃上清液,所得沉淀再次加入4 倍体积的僵直液,重复上述步骤共3 次。所得沉淀加入4 倍体积的0.1 mol/L NaCl溶液,搅拌均匀后经4 层纱布过滤,使用0.1 mol/L HCl溶液将滤液的pH值调至6.2,离心后所得沉淀即为MP。整个提取过程保持在0~4 ℃,将所得蛋白置于离心杯中,保存于碎冰中,并保证在48 h内使用。蛋白浓度采用双缩脲法测定。
1.3.3 MP-赖氨酸混合体系的制备
使用25 mmol/L磷酸盐缓冲液(含0.4 mol/L NaCl,pH 6.2)将冷冻损伤MP蛋白膏稀释为40 mg/mL,分别加入不同量的L-Lys,用上述缓冲液对体系进行稀释,使得最终体系中蛋白质量浓度为30 mg/mL,L-Lys浓度分别为0、1、3、5、10 mmol/L,用玻璃棒轻轻搅拌均匀,将样品4 ℃放置12 h。同时设置未冷冻损伤(不添加L-Lys)样品为空白对照。
1.3.4 圆二色谱测定
使用25 mmol/L磷酸盐缓冲液(含0.4 mol/L NaCl,pH 6.2)将MP样品稀释至0.2 mg/mL,以120 nm/min的扫描速率从200 nm扫描到260 nm,累计扫描3 次取其平均值并扣除缓冲液背景,使用CDNN软件计算蛋白二级结构含量。
1.3.5 内源性色氨酸荧光测定
使用25 mmol/L磷酸盐缓冲液(含0.4 mol/L NaCl,pH 6.2)将MP样品稀释为0.4 mg/mL,以283 nm作为激发波长利用Fluoro Max-4荧光分光光度计记录290~400 nm的发射光谱,激发和发射狭缝宽度均为1.5 nm。相同条件下记录样品缓冲液发射光谱,并从样品发射光谱中扣除以排除干扰。
1.3.6 粒度测定
在25 ℃使用Mastersizer 2000激光粒度分析仪采用静态光散射法对不同处理的MP样品的平均粒径进行分析,将稀释后的MP样品(2 mg/mL)分散在蒸馏水(分散介质)中,直至遮光效果达到10%~13%,以避免多次散射。设置MP颗粒折射率为1.570,分散剂折射率为1.330,吸收指数为0.001,重复测定3 次取其平均值。
1.3.7 溶解度的测定
使用25 mmol/L磷酸盐缓冲液(含0.4 mol/L NaCl,pH 6.2)将MP样品稀释至2 mg/mL,在5 000×g离心15 min,采用双缩脲法测定上清液的蛋白含量,溶解度计算如下式所示:

1.3.8 流变学性能的测定
根据Li Chuangqiang等[14]的方法进行动态流变学的测定。将样品混合物置于塑料离心管中4 ℃、1 000×g离心1 min,脱气后,置于间距为1 mm的流变仪平板之间,下压后轻轻拭去平板周围多余的样品,用硅油进行密封,防止加热过程中水分蒸发,平衡2 min后,在振荡模式下使样品以1 ℃/min的升温速率从20 ℃加热至75 ℃进行凝胶化。振荡频率设置为0.1 Hz,最大应变为0.02。记录实验中的弹性模量G’作为流变性能的评价指标。
1.3.9 MP热诱导凝胶的制备
准确称取5 g脱气后的MP样品(30 mg/mL)于玻璃瓶中,封口后置于水浴锅中以1 ℃/min的升温速率从20 ℃加热至75 ℃,并在75 ℃保温10 min,取出后立刻置于冰水混合物中冷却30 min,随后放入4 ℃冰箱冷藏过夜。在测定MP样品凝胶性能之前,需将样品提前取出在室温条件下平衡2 h[15]。
1.3.10 蒸煮损失率的测定
用小铲轻轻将凝胶与瓶壁剥离,并倒扣于滤纸上,静置20 min,使其蒸煮汁液流尽之后,对凝胶进行称量[16]。蒸煮损失率计算公式如下:

1.3.11 MP凝胶质构的测定
采用TPA质构分析法[17],测定凝胶的硬度、弹性、内聚性、咀嚼性和回复性等指标。使用小铲子轻轻将凝胶与小玻璃瓶壁剥离,将凝胶取出放置于平板上进行质构测定。测定参数设置如下:测前、测中、测后速率均为2 mm/s;下压百分比30%;两次下压时间间隔5 s;探头型号P/75;触发力10 g。
1.3.12 MP凝胶白度的测定
参照Xia Xiufang等[3]方法,分光测色计经自检及零点、白板校正后,进行样品测定。每个样品3 组平行,取平均值。凝胶白度值W按下式计算:
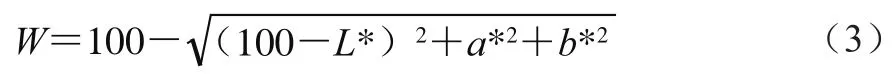
式中:L*为亮度值;a*为红度值(正值表示偏红,负值表示偏绿);b*为黄度值(正值表示偏黄,负值表示偏蓝)。
1.3.13 MP凝胶微观结构表征
参照Cao Yungang等[18]的方法并略作修改。将MP凝胶样品切成小方块后使用体积分数为2.5%的戊二醛磷酸盐缓冲液(0.1 mol/L,pH 7.4)固定4 h,使用pH 7.4的磷酸盐缓冲液清洗数次,然后通过一系列体积分数的乙醇溶液(50%、70%、90%、95%、100%)进行梯度脱水,用叔丁醇置换3 次,每次30 min。对样品进行冷冻干燥后喷金,然后使用扫描电镜观察其微观结构,加速电压为2.0 kV,放大倍数为5 000。
1.4 统计分析
使用Statistical 9.0分析软件通用线性模型程序(Analytical software,Tallahassee,FL,USA)对实验数据进行方差分析。采用LSD全配对多重比较方法进行显著性分析,P<0.05,差异显著。实验数据以表示,并使用SigmaPlot 12.5软件进行绘图。
2 结果与分析
2.1 L-Lys浓度对冷冻损伤MP结构的影响
不同处理MP二级结构的变化使用圆二色谱仪进行测定,结果如图1a所示。未经反复冻融处理MP的CD图谱在208、222 nm处有两个负峰,表明MP中α-螺旋相对含量较高[19]。经反复冻融处理后这2个峰的大小显著降低,说明反复冻融处理导致MP的α-螺旋相对含量下降,这可能是由于肌球蛋白尾部的α-超螺旋结构解旋[20],二级结构计算结果显示,α-螺旋相对含量下降伴随着β-折叠、β-转角和无规卷曲结构相对含量的显著上升(图1b)。L-Lys添加显著改变了冷冻损伤MP的二级结构,添加1、3、5、10 mmol/LL-Lys使得冷冻损伤MP的α-螺旋相对含量分别提高10.2%、11.5%、10.8%和10.6%,添加L-Lys使得冷冻损伤MP二级结构的构成比例接近于未经反复冻融处理组(图1b)。蛋白质的二级结构主要由氢键维系,L-Lys含有的羧基(—COOH)及氨基(—NH2)可能破坏了原有的氢键,并诱导新的氢键形成,从而引起蛋白二级结构的改变。
蛋白质内源性色氨酸荧光对于其周边微环境的极性非常敏感,当蛋白质处于折叠状态时,色氨酸残基主要位于蛋白质内核这样的疏水环境中,此时被激发的色氨酸具有相对较高的荧光强度;而当蛋白质部分或完全展开时,色氨酸残基就会更多的暴露于蛋白质分子表面,此时被激发的色氨酸荧光强度降低。因此,内源性色氨酸荧光特性经常被用于反映蛋白质的三级结构的变化[15]。如图1c所示,经反复冻融后MP的荧光强度显著下降,表明蛋白三级结构的展开。反复冻融破坏了MP天然的排列方式,蛋白展开变性使得原本位于内部的色氨酸残基暴露于表面而处于溶剂的极性环境中,从而引起内源荧光强度下降。L-Lys添加显著改变了冷冻损伤MP的内源性色氨酸荧光强度,当L-Lys添加量为1、3 mmol/L时,冷冻损伤MP的荧光强度显著上升,接近于未经反复冻融处理MP的荧光强度;当L-Lys添加量为5 mmol/L时反而促使荧光强度进一步降低;当L-Lys添加量为10 mmol/L时,荧光强度略微上升但变化不显著。一方面L-Lys的添加会引起氢键重排导致蛋白构象的变化,另一方面作为生物小分子物质L-Lys可能与MP中色氨酸残基静态结合导致荧光猝灭效应,因此不同浓度L-Lys对冷冻损伤MP荧光强度的影响是二者综合作用的结果。
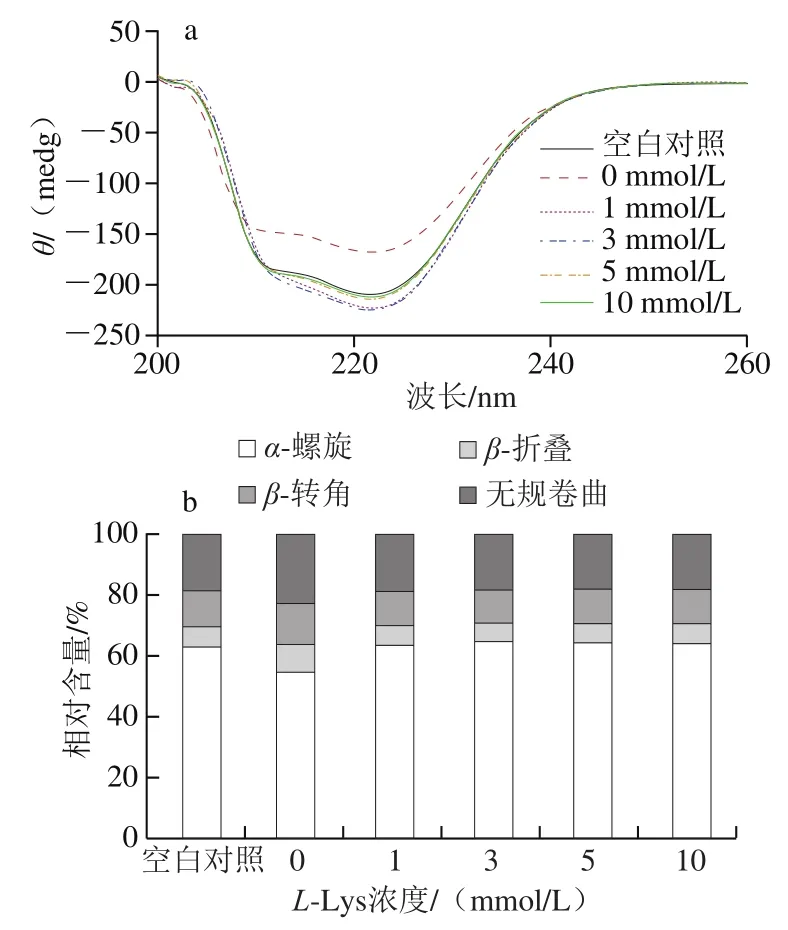
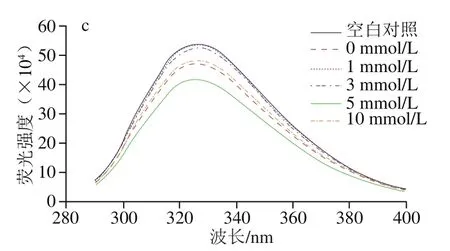
图1 L-Lys浓度对MP溶液二级结构(a、b)和三级结构(c)的影响Fig. 1 Effect of L-Lys concentration on secondary structure (a, b) and tertiary structure (c) of MP solution
2.2 L-Lys浓度对冷冻损伤MP粒度的影响
蛋白质的粒度是影响蛋白质功能特性的因素之一[21],也是蛋白质结构的宏观表现。粒径反映可溶性蛋白的粒度分布和聚集情况[22]。如图2所示,与未经反复冻融MP相比,经反复冻融MP的表面积平均粒径d(3,2)和体积平均粒径d(4,3)分别增加了4.841 μm和17.427 μm。这是由于反复冻融诱导MP结构展开,使得MP分子间S—S形成及疏水相互作用增强、蛋白质交联聚集加剧、导致MP的平均粒径增大[23-24]。不同浓度L-Lys处理对反复冻融MP的d(3,2)和d(4,3)产生了显著的影响,整体来看L-Lys处理倾向于降低冷冻损伤MP的粒径,且L-Lys浓度越大效果越好。与本研究结果类似,Fu Yuan等[7]在不同pH值处理条件下研究发现L-Lys和L-Arg的添加引起MP粒径减小。而马文慧等[25]研究发现在氧化条件下添加L-Arg引起MP粒径增大。不一致的研究结果表明碱性氨基酸对MP粒径的影响可能受原料肉、离子强度、氧化或冷冻处理等多种因素的影响。
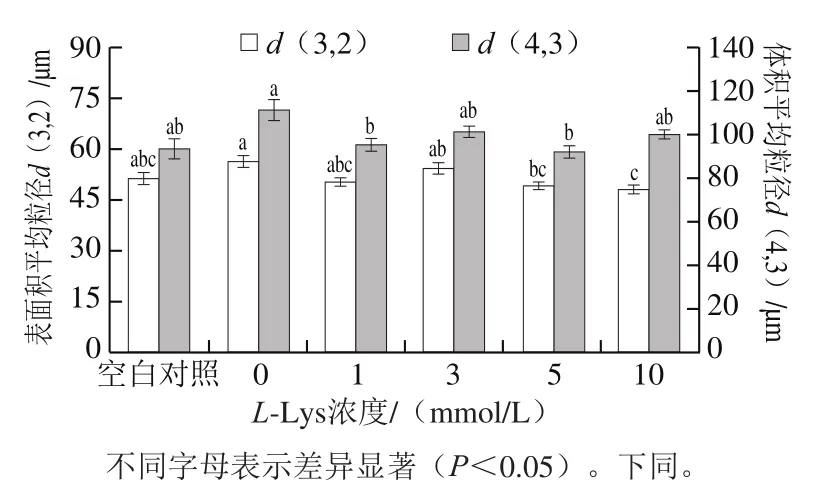
图2 L-Lys浓度对MP粒度的影响Fig. 2 Effect of L-Lys concentration on MP particle size
2.3 L-Lys浓度对冷冻损伤MP溶解度的影响
溶解度反映了蛋白分子间以及蛋白与水分子之间相互作用力的变化,能够间接反映出蛋白质变性和聚集情况[26-27]。如图3所示,未经反复冻融的MP样品的溶解度为61.10%,反复冻融导致MP的溶解度下降至41.61%(P<0.05)。这与Srikar等[28]报道的粉红鲈鱼蛋白在冷冻过程中溶解度下降的结果基本一致,这是因为冷冻导致蛋白发生变性,蛋白分子间二硫键及疏水相互作用增强,蛋白-蛋白交联形成聚集体[29]。不同浓度L-Lys处理对反复冻融MP的溶解度产生显著影响。添加1、3、5、10 mmol/LL-Lys使得反复冻融MP的溶解度分别增加至42.66%、50.66%、69.10%和64.93%,从整体来看,说明L-Lys对于MP的增溶作用随着L-Lys浓度的升高而增强。Guo等[30]也发现L-Lys能够显著提高猪肌球蛋白的溶解度。
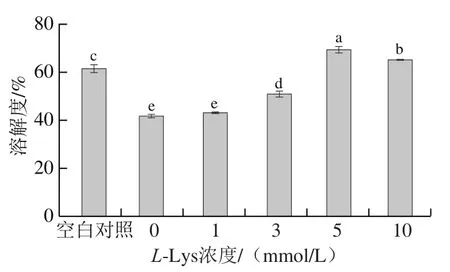
图3 L-Lys浓度对MP溶解度的影响Fig. 3 Effect of L-Lys concentration on MP solubility
2.4 L-Lys浓度对冷冻损伤MP流变学性能的影响
储能模量G’反映蛋白凝胶网络的结构属性,同时与凝胶强度联系密切[31]。由图4可以发现,未经反复冻融的MP样品的G’在45~56 ℃显著上升,这是因为肌球蛋白头部开始发生变性聚合,肌球蛋白溶液开始逐渐由于热变性而形成结构较为疏松的凝胶;56~62 ℃急剧下降,这是由于肌球蛋白的尾部展开破坏了已形成的网络结构;在最后的加热过程中(62~75 ℃)G’随温度升高持续上升,说明蛋白质进一步发生交联聚集,最终形成了永久性、不可逆的、更强的凝胶网络结构[17]。与未经反复冻融样品相比,冷冻损伤MP的G’值在整个热诱导成胶过程中均较低,说明反复冻融降低了MP的凝胶性能(包括肌球蛋白头部交联和尾部交联)。L-Lys的添加并不能提高热诱导凝胶过程中冷冻损伤MP的G’,相反会促进G’的损失,且L-Lys浓度越高MP的G’越低。这可能是由于L-Lys的存在抑制了加热过程中肌球蛋白结构的展开和交联,阻碍了凝胶网络的形成[32]。
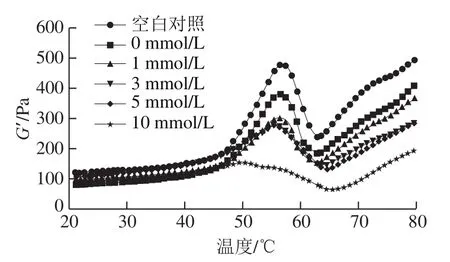
图4 L-Lys浓度对MP流变学性能的影响Fig. 4 Effect of L-Lys concentration on rheological properties of MP
2.5 L-Lys浓度对冷冻损伤MP凝胶蒸煮损失及白度的影响
如图5所示,未经反复冻融MP热诱导凝胶的蒸煮损失率为12.65%,经反复冻融处理并未引起MP热诱导凝胶的蒸煮损失率(12.76%)的显著变化,与本研究结果一致,Jittinandana等[33]研究15 次反复冻融并未引起鳟(Squaliobarbus ourriculus)蒸煮损失的显著变化。而Xia Xiufang等[12]发现猪MP凝胶蒸煮损失随着反复冻融次数的增加而增加,这可能是由于反复冻融导致肌球蛋白变性增加,也可能是由于反复冻融破坏了肌纤维的结构使得蛋白形成网络结构结构能力减弱。实验结果不一致可能与肉的种类、实验条件等不同有关。L-Lys添加显著降低了MP凝胶的蒸煮损失,且随着L-Lys浓度的增加蒸煮损失显著降低(P<0.05)。
如图5所示,未经反复冻融的MP凝胶白度为67.314,经反复冻融处理导致MP凝胶白度值下降,这可能与冷冻导致的脂肪和蛋白氧化以及色素变化等因素有关[17]。反复冻融MP凝胶白度值随着L-Lys浓度的增加而降低,这可能是由于实验所用L-Lys自身略带颜色。
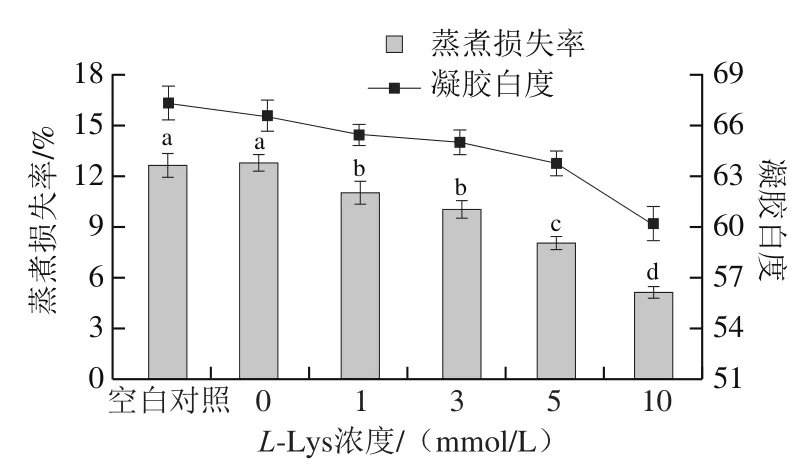
图5 L-Lys浓度对MP凝胶性能的影响Fig. 5 Effect of L-Lys concentration on gel properties of MP
2.6 L-Lys浓度对冷冻损伤MP凝胶质构的影响
如表1所示,与未经反复冻融MP相比,反复冻融处理导致MP样品的硬度下降了3.011 g。这与陈金玉等[34]研究发现虾蛄MP的热诱导凝胶强度随着冻融次数的增加显著下降一致。添加L-Lys导致冷冻损伤MP样品的凝胶强度明显降低,且MP凝胶的强度随着L-Lys添加量的增加而逐渐降低(P<0.05),这与流变测定结果一致。与本研究结果一致,付渊[32]研究发现L-Lys添加到鸡胸肉肌球蛋白凝胶中会导致凝胶硬度下降,并且随着L-Lys浓度的增加而降低。而雷振[35]发现添加L-Lys能够明显提高鸡肉肌动球蛋白凝胶硬度,这可能与肉的种类的不同有关。
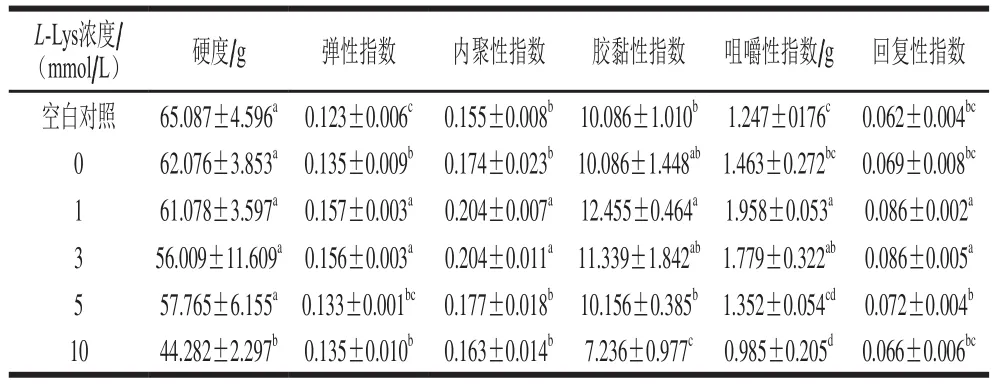
表1 L-Lys浓度对MP凝胶质构的影响Table 1 Effect of L-Lys concentration on the texture of MP gel
与未经反复冻融MP凝胶相比,冷冻损伤MP凝胶的弹性、内聚性、胶黏性、咀嚼性和回复性均有所上升。当L-Lys浓度为1 mmol/L时,全面提高了冷冻损伤MP凝胶的弹性、内聚性、胶黏性、咀嚼性和回复性;当浓度为3、5 mmol/L时,对冷冻损伤MP凝胶的上述质构特性影响不大;当浓度为10 mmol/L时,显著降低了所有质构指标的数值(P<0.05)。
2.7 L-Lys浓度对冷冻损伤MP凝胶微观结构的影响
凝胶的微观结构与质构、保水和流变特性相关。由图6可以看出,未经反复冻融MP凝胶的微观结构连续、均匀、致密,而反复冻融MP凝胶的微观结构粗糙,孔径大且不均匀。这也是冷冻损伤MP凝胶强度和蒸煮损失降低的原因。L-Lys添加对冷冻损伤MP凝胶的微观结构产生了明显的影响,随着L-Lys浓度的增加,冷冻损伤MP凝胶微观结构的孔径逐渐减小,三维网状结构更加致密均匀。Sun Jingxin等[36]研究发现均匀致密的凝胶结构有利于凝胶基质中水分的截留,这进一步解释了L-Lys添加显著降低了蒸煮损失。

图6 L-Lys浓度对MP微观结构的影响Fig. 6 Effect of L-Lys concentration on microstructure of MP
3 结 论
探究不同浓度L-Lys对反复冻融诱导的冷冻损伤MP结构及凝胶性能的影响。结果表明:L-Lys添加改变了冷冻损伤MP的结构,表现为α-螺旋相对含量和内源性色氨酸荧光强度上升,经L-Lys处理的冷冻损伤MP蛋白结构特性接近于未经反复冻融MP的结构特性。整体来看,随着L-Lys浓度(1~10 mmol/L)的升高,冷冻损伤MP的溶解度逐渐升高,G’及凝胶强度逐渐降低,蒸煮损失逐渐减小,凝胶微观结构逐渐趋于致密均匀。因此,L-Lys添加能有效降低冷冻损伤MP的蒸煮损失和凝胶强度,这说明添加L-Lys有望显著提升冷冻原料肉制品的得率并改善其嫩度和多汁性。
