基于氮阻遏效应分析汉逊德巴利酵母组胺调控
2022-02-16王新惠孙劲松刘力嘉张雅琳肖龙泉
王新惠,潘 攀,孙劲松,丁 悦,刘力嘉,张雅琳,肖龙泉,田 甜,刘 洋,*
(1.成都大学食品与生物工程学院,肉类加工四川省重点实验室,四川 成都 610106;2.宜宾学院 固态发酵资源利用四川省重点实验室,四川 宜宾 644000;3.成都农业科技职业学院,四川 成都 611130)
汉逊德巴利酵母(Debaryomyces hansenii)有代谢乳糖、乳酸盐和蛋白质的能力,且代谢可产生香味,常应用于肉制品发酵、干酪发酵、泡菜发酵以及果蔬病害拮抗等方面。一系列特性使得汉逊德巴利酵母应用研究涉及到食品加工、食品储藏、食品安全以及医药健康[1-7]。
汉逊德巴利酵母在发酵过程中不仅可以通过代谢糖、蛋白质等物质产生需要的风味物质以及利于人体消化的小分子物质[3],同时也会产生一些有毒有害的物质,如生物胺[8]。生物胺是一种非挥发性的含氮有机碱,食品中生物胺含量和种类各有异同,主要有组胺、酪胺、尸胺、腐胺、精胺和亚精胺,其中毒性较强和关注度较高的是组胺和酪胺,生物胺摄入后会刺激神经和血管,具有一定致癌性,组胺口服量达到8 mg便可能对机体产生轻微中毒症状[9-10]。食品中生物胺除在食品生产原辅料中含有少量外,主要通过微生物脱羧形成。在适宜的生长环境下,汉逊德巴利酵母通过分泌特定氨基酸脱羧酶作用于对应的前体氨基酸发生脱羧反应而生成相应的生物胺,究其原因,是汉逊德巴利酵母对含氮化合物利用不充分,而导致生物胺在机体内积累。当环境中存在多种氮源时,微生物会优先利用丰富型氮源,而被抑制贫乏型氮源利用,这种现象被称为氮代谢阻遏效应,这类全局调控的研究,对降低甚至消除生物胺等有害物质具有重要意义[11]。
目前,对微生物发酵剂研究主要集中在菌种分离鉴定、发酵剂配比和特性研究,对安全性研究主要集中在有毒有害物质含量检测和安全控制,组胺等有毒有害物质背后具体产生机理仍然不够清晰明了[7,12-14]。新一代测序技术已经成为各学科研究的应用重点之一[15],转录组测序通过快速获得某物种特定状态全部转录本,再进行新转录本预测和差异分析,具有较好的应用前景[16-17]。本研究通过添加组胺产生的前体物质L-组氨酸进行刺激培养,探索汉逊德巴利酵母氨基酸调控过程,旨在为进一步阐明组胺代谢机制提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
汉逊德巴利酵母菌株:课题组实验室保存,分离筛选于香肠。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[18]:酵母膏10 g、蛋白胨20 g、葡萄糖20 g,补水至1 000 mL,121 ℃灭菌20 min。
固体培养基:添加20 g/L琼脂粉于液体YPD液体培养基内,121 ℃灭菌20 min。
L-组氨酸培养基:添加不同比例L-组氨酸于已灭菌YPD液体培养基内,配制成质量分数为0.1%、0.5%、0.8%组氨酸培养基,并以不添加L-组氨酸的培养基作为空白。
1.1.2 试剂
L-组氨酸 美国 Sigma公司;蛋白胨、琼脂粉、葡萄糖(均为分析纯) 成都市科隆化学品有限公司。
1.2 仪器与设备
RC-I-20L超纯水机 成都瑞昌仪器制造有限公司;LRH系列生化培养箱 上海一恒科学仪器有限公司;JA3103N电子天平 上海民桥精密科学仪器有限公司;721可见分光光度计 上海菁华科技仪器有限公司。
1.3 方法
1.3.1 菌种活化培养
菌株划线培养于YPD固体培养基,稳定生长后取单菌落接种于YPD液体培养基进行活化培养,取对数期菌液划线培养于YPD固体培养基,30 ℃培养待用。
1.3.2L-组氨酸刺激培养
已灭菌YPD液体培养基中添加不同比例的L-组氨酸,配制成质量分数为0.1%、0.5%、0.8%组氨酸培养基,并以不添加L-组氨酸的培养基作为空白,30 ℃进行培养,每隔8 h取样一次。
1.3.3 OD值测定
以空白培养基作为对照,600 nm波长下,1 cm比色皿测定菌液OD值,平行测定3 次,对培养后期菌液进行稀释测定。
1.3.4 组胺含量测定
参照王新惠等[18]的方法对菌液中组胺含量进行测定。
1.3.5 转录组测序样品制备
将活化后的汉逊德巴利酵母菌株接种于YPD固体平板,稳定生长后,挑取单个菌种,无菌水稀释,取100 μL稀释液转接至YPD液体培养基,添加L-组氨酸作为实验组,设置空白对照,30 ℃振荡培养,各取样1 mL,液氮速冻,立即置于-80 ℃,后续用于转录组测序。
1.3.6 转录组测序样品处理
提取样品total RNA后使用DNaseI消化DNA,并对RNA样品进行检测[19]。使用Agilent 2100 Bioanalyzer检测提取质量,检查RNA的完整性,指标包括RNA完整值、片段大小、RNA浓度和28S与18S核糖体RNA比值。再使用紫外分光光度计NanoDrop检测RNA纯度(OD260nm/OD280nm)。检测结果达到要求后再进行文库建立。
1.3.7 转录组测序文库建立
RNA的完整性和纯度检测结果满足标准后,进行mRNA富集,富集完成后加入破碎缓冲液将其充分破碎;接着进行首条互补DNA的模板合成,再加入配合物合成非模板DNA链,并使用试剂盒对合成的互补DNA进行纯化;互补DNA纯化完成后末端修复、加A尾、连接测序接头,并依据聚合酶链式反应进行扩增。
1.3.8 转录组测序文库检测
扩增完成后,文库制备完成,接着利用Agilent 2100 Bioanalyzer检测建库中片段范围,利用ABI StepOnePlus实时聚合酶链式反应系统定量建库浓度。建库片段范围和浓度达到要求后,利用Illumina HiSeq仪器实行转录组测序。
1.3.9 转录组测序数据处理与分析
将测序结果所得原始数据进行筛选,并将筛选后数据进行参考序列比对。比对后实行表达量分析,并对比各组差异表达情况,进行基因本体论(Gene Ontology,GO)、Pathway和聚类分析等功能分析。
1.3.9.1 质量控制
对结果数据中质量较低、接头污染和为止碱基数量过高数据进行去除,去除后进行质量评估,质量评估主要包括数据量统计、碱基含量分布统计、碱基质量分布统计。
1.3.9.2 基因表达水平分析
采用生信软件Bowtie2将筛选后数据进行参考比对,再对转录本和基因表达水平进行计算。使用R软件进行相关性分析和聚类分析[20-21]。
1.3.9.3 差异表达基因(differentially expressed gene,DEG)分析
基因表达具有空间和时间特异性,在差异实验中表达水平对比产生显著差异的基因称为DEG。DEG检测使用PossionDis算法,|log2Fold Change|>1,同时q-value<0.001作为DEG筛选阈值,筛选完后使用R软件进行后续分析。
1.3.9.4 DEG功能富集分析
GO注释和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)注释完成后,参考官方生物通路分类,对DEG及其对应的生物通路进行分类分析。对得到的P值进行校正,并使用R软件中的phyper函数进行系列富集分析(蛋白容错率≤0.01)[22-25]。
2 结果与分析
2.1 L-组氨酸对汉逊德巴利酵母生长代谢的影响
2.1.1L-组氨酸添加量对汉逊德巴利酵母生长的影响
在适宜生长条件下,汉逊德巴利酵母通过分泌组氨酸脱羧酶作用于环境中组氨酸而产生组胺,因此组氨酸含量对可能汉逊德巴利酵母繁殖和代谢有很大影响。由图1可以看出,L-组氨酸刺激后各组间OD值无较大差异,均在32 h后进入快速生长期,48 h后生长繁殖速度下降。0.5%L-组氨酸刺激培养后,在48 h后生长速率高于其他实验组,且培养后期OD值略大于其他组;0.8%L-组氨酸组刺激培养前期生长速率较快,发酵后期OD值小于其他组。

图1 不同用量L-组氨酸刺激后菌液OD值变化Fig. 1 Changes in cell density, expressed as optical OD at 600 nm during culture in the presence of different concentrations of L-histamine
2.1.2L-组氨酸添加量对汉逊德巴利酵母组胺生成的影响
组胺大量生成需要3个条件:1)具有能够产生组氨酸脱羧酶的微生物;2)体系中含有游离组氨酸;3)适宜的生长繁殖环境。前体物质组氨酸作为产胺必要条件之一,对微生物代谢和体系中组胺含量有很大的影响。由图2可以看出,添加L-组氨酸对组胺生成具有促进作用,刺激培养8~24 h组胺开始积累,各组间无较大差异;24 h后各组出现差异并且生成速率增大,40 h后组胺生成速率降低。0.1%L-组氨酸和0.3%L-组氨酸刺激后组胺积累量比空白组略高,0.5%L-组氨酸和0.8%L-组氨酸积累量相比空白组较高。由于0.5%L-组氨酸和0.8%L-组氨酸无较大差异,选择0.5%L-组氨酸作为刺激培养条件;鉴于产物合成比基因表达滞后,结合生长代谢情况,确定接种后36 h作为取样时间。

图2 不同用量L-组氨酸刺激后组胺积累量变化Fig. 2 Changes in histamine contents during culture in the presence of different concentrations of L-histamine
2.2 转录组测序数据质量分析
对过滤得到的数据进行统计,结果如表1所示,对照组的测序结果共得到42.921 6 M clean reads,实验组的测序结果共得到41.415 4 M clean reads。0.5%L-组氨酸作实验组,其与空白对照组Q20大于95%,Q30大于87%,GC含量大于40%。结果表明测序数据质量符合要求。

表1 过滤后的reads数据量及质量统计Table 1 Statistics of the amount and quality of filtered reads
2.3 表达水平分析
转录本丰度是体现基因表达水平的重要指标,通常丰度越高表达水平越高。转录组测序分析则可以定位基因组区域或外显子区的reads,并且体现其表达水平,同时基因测序深度、基因长度均和表达水平呈现正相关趋势。为阐述其具体表达水平和对比情况,引入FPKM术语,FPKM是指每百万片段中每千碱基长度的片段数目。
如图3所示,当lg(FPKM+1)值小于1.8时,实验组基因密度略高,lg(FPKM+1)值大于1.8后,对照组基因密度略高。小提琴图是箱线图和密度图的集合,箱线图主要体现数据中位数、异常值以及分布区间等信息;密度图则主要体现其概率密度。小提琴图中箱型框表示四分位数范围,箱型框中间横线表示中位数,箱型框链接线条表示95%置信区间,箱型框周围图形宽度表示密度宽度(频率)。如图4所示,实验组和对照组基因表达水平中位数和分布密度无较大差别,实验组95%置信区间略大,两组样品分布情况趋势一致。

图3 FPKM分布图Fig. 3 FPKM distribution map
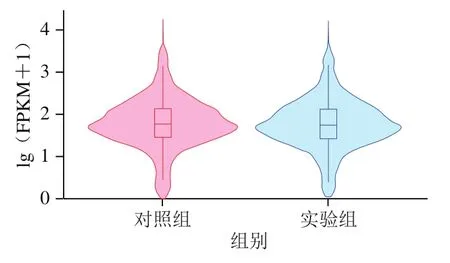
图4 FPKM小提琴图Fig. 4 FPKM violin map
2.4 DEG表达分析
2.4.1 差异表达水平
倍数表达图(MA图)可展现DEG的分布情况,图中每个点对应一个基因。两组样品基因的表达水平如图5所示,差异倍数的整体分布较为明显,较多基因log2Fold Change值较大,说明这些基因的差异变化较为显著。
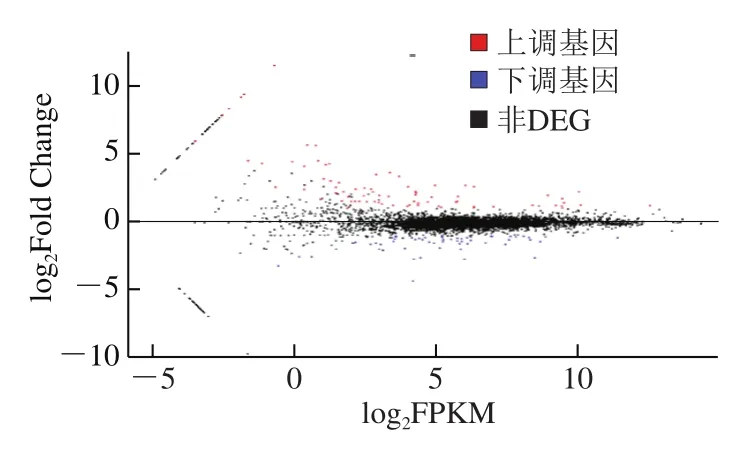
图5 DEG MA图Fig. 5 MA map of differentially expressed genes
2.4.2 DEG表达情况
设置筛选差异倍数和q-value阈值(|log2Fold Change|>1同时q-value<0.001),图6结果显示,检测DEG 133个,其中78个差异表达上调基因,55个差异表达下调基因,上调表达基因数量大于下调表达基因。
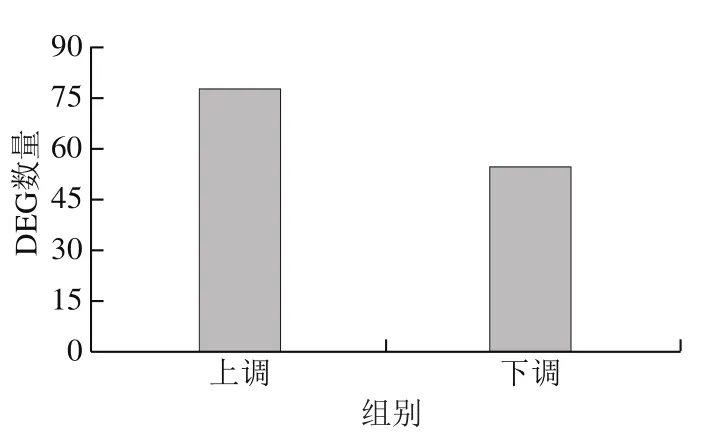
图6 DEG表达情况Fig. 6 Statistics of differentially expressed genes
2.5 DEG功能富集分析
2.5.1 DEG GO功能分析
GO作为基因功能国际标准统一分类体系,常用于基因和蛋白质限定和描述,是基因本体联合会创建的数据库之一。包含生物学过程、分子功能和细胞组分3个分支。由图7所示,本研究挑选了富集较为显著的24个条目进行显示。

图7 不同处理下DEG GO功能分类Fig. 7 GO functional classification of differentially expressed genes under different treatments
DEG参与的生物学过程包括代谢过程、细胞过程、细胞内定位、应激反应、生物调节、涉及多细胞有机体的过程、生物学过程调控、生物附着、细胞组分组织或生物合成、生物过程正向调节、氮利用、信号等过程。其中参与代谢过程DEG最多,说明大多DEG参与了细胞代谢和代谢物转化;其次参与细胞过程和细胞内定位DEG,说明DEG参与细胞转运代谢的过程也较多。
DEG参与的细胞组分包括胞膜组分、胞膜、细胞、细胞组分、细胞器、复合蛋白、细胞器组分、膜结合腔体、细胞间区域等过程。其中胞膜组分和胞膜中包含DEG最多,说明参与物质交换的DEG较多。
DEG参与的分子功能包括催化活性、结合蛋白、转录因子活性、抗氧化活性、转录调节活性、分子功能调节等过程。其中催化活性差异和结合蛋白DEG最多,说明大部分DEG参与了催化反应和特异性结合反应进程。
2.5.2 DEG Pathway功能分析
KEGG包含多个分类数据库,是一个关于对基因组、化学以及系统功能通信的整合数据库。KEGG GENES数据库主要储存基因组信息;KEGG通路数据库主要储存代谢通路信息;KEGG配体数据库则主要储存酶分子、酶反应及化学复合物信息,生信分析中对代谢过程、周期因子、跨膜转运、信号分子等信息研究较多,所以代谢通路数据库的使用频率最大,数据库也较为全面和完善。
功能分析中可以用散点图形式展现KEGG富集分析结果,可展示多变量平面分布情况。散点图中,主要通过两个因素展示富集结果,一个是q-value,指的是校正P-value,一般取值在0~1之间,值越接近1表示富集越不显著。另一是富集因子,表示代谢通路的DEG富集个数和注释到此通路基因个数的比值,取值越大表示富集程度越大。
如图8所示,参考KEGG通路数据分类标准,对第2层通路中DEG数量进行分析,统计DEG在该分类中的个数,并利用散点图的形式展示两组样品KEGG富集分析结果。分类结果显示,大多DEG集中在代谢过程通路;其次是次生代谢物的合成和硫胺素新陈代谢通路,以及过氧物酶体、半乳糖代谢、α-亚麻酸代谢、脂肪酸降解、鞘脂类代谢、氨基糖和核苷酸糖代谢、黄曲霉毒素生物合成、核黄素的新陈代谢、脂肪酸代谢、果糖和甘露糖代谢、不饱和脂肪酸合成、缬氨酸/亮氨酸/异亮氨酸的代谢、乙醛酸和二羧酸代谢、色氨酸代谢等通路均出现差异代谢。差异分布显示,L-组氨酸刺激后汉逊德巴利酵母出现差异代谢,主要集中在辅酶代谢、能量代谢、其他氨基酸代谢、脂肪代谢等过程。

图8 DEG KEGG富集散点图Fig. 8 KEGG enrichment scatter plot of differentially expressed genes
2.6 组胺合成代谢调控分析
2.6.1 氨基酸代谢调控分析
微生物对氮源的吸收利用呈现明显的偏好性,这种偏好性表现在环境中存在多种氮源时,微生物对谷氨酰胺等丰富型氮源的优先吸收代谢,精氨酸等贫乏型氮源则处于抑制状态。氨基酸代谢直接影响氮代谢阻遏效应过程,而氮代谢阻遏效应对生物胺代谢具有很大影响。
L-组氨酸刺激培养后氨基酸代谢、碳代谢和脂肪代谢简化图如图9所示,丙氨酸、丝氨酸、半胱氨酸、苏氨酸、天冬氨酸、谷氨酸、天冬酰胺、γ-氨基丁酸(gamma-aminobutyric acid,GABA)等代谢呈现差异上调;异亮氨酸、亮氨酸、色氨酸、缬氨酸、精氨酸等代谢表现为差异上调和差异下调共同呈现;酪氨酸、苯丙氨酸等呈现差异下调,这种现象可能是氮代谢过程整体调控的结果。果糖、葡萄糖、蔗糖、丙酮酸、α-酮戊二酸等呈现差异上调,表明糖酵解和三羧酸循环呈现上调趋势,这可能与碳代谢和氨基酸代谢之间关联转化代谢有关;脂肪代谢中DEG主要集中在在乙酰辅酶A代谢和脂肪氧化调控蛋白代谢,乙酰辅酶A氧化酶(1.3.3.6)呈现差异下调,乙酰辅酶A转酰酶系表现为差异上调和差异下调共同呈现,这可能是能量代谢引起差异变化。

图9 氨基酸代谢通路图Fig. 9 Metabolic pathways of amino acids
添加前体组氨酸后,不仅各类氨基酸呈现差异代谢,碳水化合物和脂肪等代谢也呈现不同方式的差异代谢,说明氮代谢、碳代谢、脂肪代谢是整合关联代谢过程,这对组胺代谢调控以及氮代谢阻遏效应分析具有一定参考价值。
2.6.2 组胺合成代谢酶系分析
氨基酸脱羧生成对应的生物胺除了需要游离前体氨基酸和适应的生长环境外,体系微生物还必须能产生氨基酸脱羧酶。前体氨基酸和生长环境属于宏观可调控条件,对生物体产生的氨基酸脱羧酶的研究显得十分重要。
组氨酸脱羧酶因组胺具有较强的毒理学作用而备受关注。研究表明,细菌中组氨酸脱羧主要有两种依赖机制,革兰氏阳性菌体现为丙酮基依赖,革兰氏阴性菌则体现为磷酸吡哆醛依赖,丙酮基化合物和磷酸吡哆醛作为必要辅酶因子参与脱羧反应[26]。
如图10所示,酸性磷酸酶(EC:3.1.3.2)在硫胺素新陈代谢、核黄素代谢以及代谢途径等通路中出现明显差异上调,其主要调控酸性硫胺素等物质等物质的生成反应,而磷酸硫胺素是组氨酸脱羧酶进行脱羧反应辅助因子。硫胺素酶(thiaminase,THI)控制硫胺素相关的新陈代谢,THI4、THI5在硫胺素新陈代谢和代谢途径等通路中出现差异上调,THI5是磷酸吡哆醛代谢关键控制酶之一,而磷酸吡哆醛是组氨酸脱羧酶进行脱羧反应关键辅酶因子。

图10 组胺及酶系代谢通路图Fig. 10 Metabolic pathways of histamine and coenzyme factors
辅助因子和维生素的代谢、跨膜运输和分解代谢等通路出现差异代谢,说明组氨酸刺激后汉逊德巴利酵母组胺代谢相关的辅酶、氨基酸和胺的转运代谢等途径出现差异代谢,虽然组胺代谢直接通路未察看到显著差异,但组胺调控的关键辅酶出现差异变化。
3 结 论
采用Illumina HiSeq测序平台,对L-组氨酸刺激培养汉逊德巴利酵母的转录组进行分析,测序数据质量符合要求,基因表达情况良好。对照组测序结果共得到42.921 6 M clean reads,实验组测序结果共得到41.415 4 M clean reads。实验组和对照组差异分析显示共有133个显著DEG,其中下调表达基因50 个,上调表达基因78个。GO功能分析表明,代谢过程、细胞过程、细胞内定位、胞膜组分、胞膜差异催化活性差异和结合蛋白等分类DEG较多,说明大多数DEG参与了细胞代谢、细胞转运、物质交换、催化反应和特异性结合等过程。KEGG富集分析显示大多DEG集中在代谢途径通路;其次是次生代谢物生物合成、硫胺素新陈代谢、过氧物酶体等通路。
L-组氨酸刺激培养结果表明,添加组胺前体物质L-组氨酸后,汉逊德巴利酵母在组氨酸代谢通路没有显著性差异变化,而在碳水化合物代谢、脂肪代谢、其他氨基酸代谢、辅助因子代谢和转运代谢等通路出现显著性差异变化,汉逊德巴利酵母组胺代谢过程可能是通过组氨酸和组胺跨膜运输相关蛋白和组胺反应辅酶因子(如磷酸吡哆醛和焦磷酸硫胺素)进行控制,或通过谷氨酸和α-酮戊二酸与碳代谢结合协同调控,具体进程仍需进一步实验验证[27-32]。通过添加组胺产生的前体物质L-组氨酸进行胁迫培养,研究结果为阐明汉逊德巴利酵母氨基酸代谢提供思路,为探索汉逊德巴利酵母氮代谢调控和组胺代谢机制过程提供参考依据。
